Распределение Максвелла 4.2. Краткая теория
 Скачать 55.31 Kb. Скачать 55.31 Kb.
|
|
ЦЕЛЬ РАБОТЫ: · Знакомство с компьютерной моделью, описывающей поведение молекул идеального газа. · Экспериментальное подтверждение распределения Максвелла молекул идеального газа по скоростям. · Экспериментальное определение массы молекул в данной модели. КРАТКАЯ ТЕОРИЯ: ВЕРОЯТНОСТЬЮ Рi получения некоторого результата измерения называется предел отношения количества измерений, давших этот результат, (Ni) к пол-ному числу измерений N, когда N ® ¥. ЭЛЕМЕНТАРНОЙ вероятностью dPυ при измерении величины скорости υ называется вероятность наличия скорости величиной от υ до υ + dυ. Эта веро-ятность пропорциональна приращению скорости dυ: dPυ = F(υ) dυ, где коэф-фициент пропорциональности F(υ) называется ФУНКЦИЕЙ РАСПРЕДЕЛЕ-НИЯ молекул по величине скорости. Она может быть выражена через другие функции распределения: F(υ) = j(υX)×j(υY)×j(υZ)×4pυ2 = f(υ)×4pυ2 , где j(υX), j(υY) и j(υZ) – функции распределения для соответствующих проекций скоростей молекул, а f(υ) – их произведение. В § 98 вы можете найти вывод формул, в частности, . СРЕДНЯЯ скорость. СРЕДНЯЯ квадратичная скорость υср.кв = . НАИВЕРОЯТНЕЙШЕЙ называется скорость υВЕР, при которой F(υ) имеет максимум: ТАБЛИЦА 2 Результаты измерений при T = 400 K
ТАБЛИЦА 3 Результаты измерений при T = 860 K
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА: Вычислите и запишите в таблицы средние значения количества частиц Nср, скорости которых лежат в данном диапазоне от υ до υ+ υ. Таблица при T = 400K: υ = 2; Среднее значения количества частиц Nср(от u = 0,5 до u = 2,5): (7+18+17+11+5)/5 = 11,6 Таблица при T = 860K: υ = 2; Среднее значения количества частиц Nср(от u = 0,5 до u = 2,5): (3+8+13+14+11)/5 = 9,8 Постройте на одном рисунке графики экспериментальных и теоретических зависимостей Nср(υ). Теоретические зависимости можно срисовать с экрана монитора компьютера, подобрав соответствующий масштаб по вертикальной оси ординат. 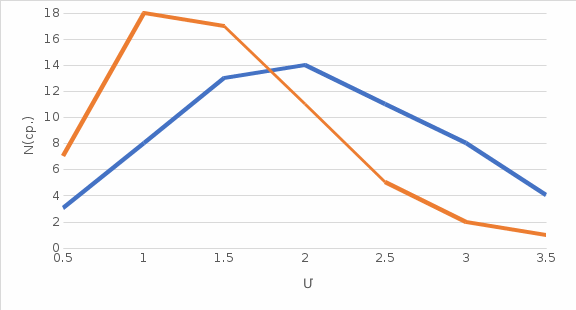 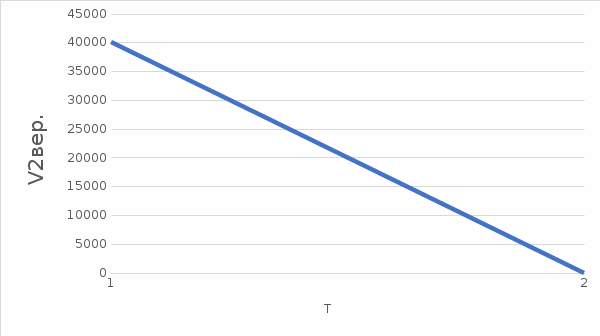 По данному графику определите значение массы молекулы 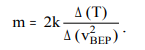 = 0,00312 * 10-23 = 0,00312 * 10-23Подберите газ, масса молекулы которого достаточно близка к измеренной массе молекулы. Запишите ответы и проанализируйте ответы и графики. m=91,8 * 10-27 Ответ: Неон Табличные значения
|
