шпоры к экзу по материаловедению. Матвед экз (я все сдала). Кристаллизация металлов, охлаждение чистого железа, его модификации
 Скачать 2.9 Mb. Скачать 2.9 Mb.
|
|
Кристаллизация металлов, охлаждение чистого железа, его модификации; Металлы — простые кристаллические вещества, которые обладают большой прочностью, электропроводностью, теплопроводностью, деформативностью и обладают особым металлическим блеском. Металл — структура из положительно заряженных ионов, омываемых электронным газом, между ионами и коллективизизОванными электронами возникают электростатические силы — металлическая связь. Ионы располагаются на таком расстоянии друг от друга, на котором энергия взаимодействия минимальна, поэтому все металлы и сплавы — кристаллические тела, атомы в них расположены закономерно Полиморфизм- свойство металлов существовать в различных кристаллических формах в зависимости от температуры, т.е. с изменением Т меняется тип кристаллической решётки. Полиморфное превращение протекает вследствие того, что образование новой модификации сопровождается уменьшением энергии Распространённые типы кристаллических решеток: а) Кубическая объёмноцентрированная кристаллическая решётка (ОЦК) – атомы расположены в вершинах куба и один атом в центре объёма куба. (Pb, K, Na, Li, W, Feα) б) Кубическая гранецентрированная (ГЦК) – атомы расположены в вершинах куба и в центре каждой грани. (Ni, Au, Pt, Feβ) в) Гексагональная кристаллическая решётка (ГПУ) – атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. (Zn, Be) Расстояния между ближайшими атомами называются периодами решётки (a, b, c). Для большинства металлов они составляют 01…07 нм.   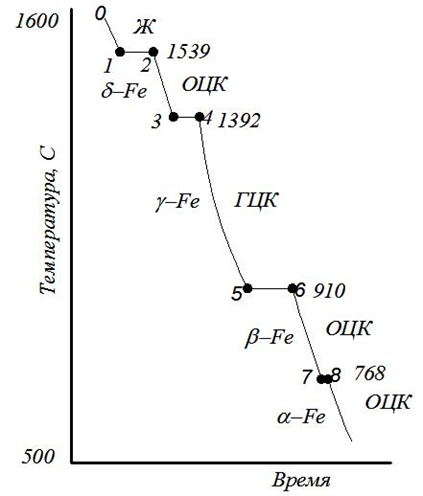 Рис. 1 Рис. 2 Рис. 3 Диаграмма олаждения чистого железа :…альфа-модификации железа, устойчивые в определенном темп. интервале. Кристаллизация – процесс перехода из жидкого состояния в твердое ( при определенной температуре для данного металла) Рис 3. Пространственные кристаллические решетки металлов образуются при их переходе из жидкого состояния в твердое. По мере понижения температуры атомы группируются в первичные кристаллы – т.н. центры кристаллизации. Второй стадией кристаллизации является рост кристаллов вокруг центров. С началом кристаллизации падение температуры прекращается (рис. 9.4), что объясняется выделением теплоты в процессе группировки атомов. После затвердения металла температура снова понижается При кристаллизации металлов и сплавов образуется слиток, имеющий обычно дендритное (древовидное) строение (рис.2). Его структура в общем случае состоит из трех зон. І зона образуется в результате появления на стенках формы большого количества мелких, хаотически ориентированных кристаллов. Не все они способны в дальнейшем расти, поэтому І зона называется зоной замороженных кристаллов. Благодаря росту отдельных кристаллов, которые ориентированы по отношению к направлению отвода тепла, образуется ІІ зона столбчатых кристаллов или зона транскристаллизации. За время формирования І и ІІ зон центральная часть расплава охлаждается ниже температуры плавления. Но поскольку отвод тепла здесь затруднен, зарождаются кристаллы, которые растут медленно, и образуется ІІІ зона объемной кристаллизации. Чем больше скорость охлаждения, тем больше ширина ІІ зоны. С практической точки зрения, благоприятнее структура зоны І, т.к. зоны ІІ и ІІІ делают слиток более хрупким. Для улучшения свойств слитка используют модифицирование. Для кристаллической структуры металлов характерны точечные, линейные, поверхностные и объемные дефекты. К точечным дефектам относятся вакансии – свободные узлы кристаллической решетки, межузловые и примесные атомы. Линейные дефекты кристаллической решетки представлены дислокациями и дисклинациями. Первые характеризуют определенную зону сдвига, вторые – поворот кристаллической решетки. Поверхностные (двумерные) дефекты возникают на границах отдельных кристаллов. Модифицирование – технологический процесс введения в жидкий металл специальных добавок. (Модификаторы – добавки 1,2 рода) На кривых охлаждения металлов переход расплава в твердое состояние и переход одной полиморфной модификации в другую характеризуется горизонтальным участком. В результате полиморфных превращений имеет место скачкообразное изменение свойств металлов: теплоемкости, теплопроводности, электрической проводимости, прочности и др. Виды сплавов, основные составляющие структуры сплавов; Сплавы — сложные кристаллические вещества, которые обладают свойствами металлов. (прочностью, электропроводностью, теплопроводностью, деформативностью и обладают особым металлическим блеском) Преимущества: - Более экономичные - Более низкая температура плавления - Улучшенные металлические свойства: - прочность; - деформативность; - коррозионная стойкость; - твёрдость. Сплавы могут быть на основе: - Металл + металл (2 и более элемента) — бронза, дюраль; - Металл + неметалл — сталь (углерод до 2.14%), чугун (углерод 2.14-6.67%). Все металлы и сплавы принято подразделять на две группы: - Чёрные — железо и сплавы на его основе (сталь, чугун). - Цветные — остальные металлы и сплавы на их основе. Виды сплавов: 1) По способу изготовления сплавов различают литые и порошковые сплавы. Литые сплавы получают кристаллизацией расплава смешанных компонентов. 2) По способу получения заготовки (изделия) различают литейные (чугуны), деформируемые (стали) и порошковые сплавы. 3) В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным — состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным). Металлические сплавы можно рассматривать как системы, состоящие из ряда однородных по составу, структуре и свойствам (гомогенных) частей или фаз, ограниченных поверхностями раздела (структурная составляющая сплава). В сплавах, в зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твёрдые растворы, механические смеси, химические соединения. Химические соединения Кристаллическая решётка отличается от исходных компонентов, имеют постоянную температуру плавления, свойства резко отличаются от свойств исходных компонентов. Многие химические соединения, образующиеся в сплавах, в отличие от обычных не подчиняются законам валентности и не имеют постоянного состава. Структурные составляющие сплавов рассмотрим на примере железоуглеродистых сплавов.Цементит (Ц) — химическое соединение железа с углеродом, содержание углерода = 6,67% 3Fe+C→Fe3C (карбид железа) Цементит обладает низкой пластичностью и высокой твёрдостью, хрупкий Твердый раствор Твердые растворы – это твердые фазы, в которых один из компонентов (базовый металл-растворитель) сохраняет свою кристаллическую решетку и в ней распределяются атомы других компонентов. Их концентрация может плавно меняться от нуля до определенной величины, называемой пределом растворимости. В зависимости от характера расположения атомов второго компонента различают твердые растворы замещения и внедрения. В т.р. замещения – атомы второго компонента замещают атомы в узлах кристаллической решетки растворителя. Феррит (Ф) — твёрдый раствор углерода в α-железе И других элементов. Твердый раствор замещения. Содержание углерода до 0,02% (практически 0) Составляющая стали, имеющая минимальную прочность, но максимальную деформативность. (Rp=250 МПа, δ=50%, НВ=800 МПа) В твердых растворах внедрения атомы второго компонента находятся в междоузлиях решетки основного металла, это атомы относительно малых размеров (углерод, азот, кислород, водород). Аустенит (А) — твёрдый раствор углерода в γ-железе. Так же азота, водорода. Содержание углерода до 2,14%. Устойчив только при высокой температуре, а с примесями Mn, Сг – при обычных, даже низких температурах. Механические смеси Перлит (П) — высоко дисперсная эвтектоидная смесь феррита и цементита, образуется при распаде аустенита при температуре 723° С и содержании углерода 0,83 %. Структура перлита состоит из пластинок феррита и цементита, на микрошлифе имеет вид перламутра. Ледебурит (Л) — эвтектическая смесь аустенита и цементита. В момент образования. Содержание углерода 4,3%. Так же в сплавах могут присутствовать чистые элементы Фазовый состав и структура сплавов зависит от их химического состава, режимов и способов их получения и обработки. Углеродистые стали — структура, свойства, применение; Сталь – железоуглеродистый сплав (С<2,14%) включающий ряд примесей, влияющих на ее структуру и свойства. В зависимости от химического состава стали, разделяют на углеродистые и легированные. Решающее влияние на механические свойства углеродистых сталей оказывает содержание углерода. Классификация сталей По содержанию углерода Малоуглеродистые, С≤0,24%; Среднеуглеродистые, 0,24% Высокоуглеродистые, С>50% По структуре Малоуглеродистые сплавы, с содержанием углерода до 0,02% называются техническим железом. Структура — чистый феррит Доэвтектоидная сталь, структура Ф+П. 0,02% Эвтектоидная сталь, структура 100% П. С=0,8% Заэвтектоидная сталь (инструментальная) структура П+Ц. 0,8 По качеству Обыкновенного качества…Ст3, Ст6 не более 0,05%S и 0,04% Р (применяется для изготовления строительных конструкций, арматуры, крепежных деталей, листового проката, труб, заклепок и т.д.) (указывают номер стали, в зависимости от ее химического состава и степени раскисления. С повышением условного номера стали увеличивается содержание углерода.) Качественные. не более 0,04%S и 0,035%Р Имеют более высокие показатели качества, нормированный химический состав. …, 0,8; …; 0,60 (Применяются для сварных конструкций, в машиностроении.) (Качественные углеродистые стали маркируют цифрами, указывающими содержание углерода в сотых долях процента.) По способу производства (по ухудшению качества, уменьшению стоимости) Конверторным (продувкой расплавленного чугуна сжатым воздухом или кислородом в больших грушевидных сосудах), выплавляется более 50% стали в мире, доля постоянно увеличивается Мартеновским (в печах Сименса-Мартена, с регенерацией тепла отходящих газов) производство постепенно уменьшается Электроплавкой (в электродуговых, индукционных, высокочастотных печах) (↑ качество, стоимость) По способу раскисления (по улучшению качества, увеличению стоимости) Кипящая сталь. Обладает высокой пластичностью, более хладноломка и способна к старению, хуже сваривается, при остывании выделяются газы — «кипение» Полуспокойная сталь. Занимает промежуточное положение Спокойная сталь. (полностью раскисленная) Является красноломкой. Для уменьшения содержания кислорода её раскисляют марганцем, кремнием и др. (↓ качество, стоимость) Зависимость свойств стали от химического состава; Углерод – важнейший компонент стали. С увеличением содержания углерода прямо пропорционально возрастает количество цементита – наиболее твердой и хрупкой составляющей стали. Соответственно уменьшаются пластичность и вязкость, относительное удлинение, ударная вязкость и трещиностойкость. До содержания углерода 0.55-0.65% возрастает предел выносливости, при большем - снижается. Примеси марганца и кремния раскисляют сталь, т.е. выводят оксиды металлов и способствуют предотвращению хрупкого разрушения стали при горячей пластической деформации. При этом марганец в количестве до 0,8% заметно повышает, прочность стали, а кремний (<0,37%) – предел текучести. Сера, образуя сульфид железа, способствует при обработке, стали прокаткой или ковкой (1000-1200°С) возникновению надрывов и трещин (горячеломкость). Сернистые включения снижают ударную вязкость, и пластичность стали, ухудшают ее свариваемость и коррозионную стойкость. В обычных углеродистых сталях содержание серы ограничивают до 0,05%, в качественных – до 0,04%, в высококачественных – до 0,015-0,025%. Вместе с тем в т.н. автоматных сталях, предназначенных для обработки резанием на станкахавтоматах содержание серы для улучшения обрабатываемости стали увеличивают до 0,15-0,25%. К вредным примесям относится также фосфор, который, растворяясь в феррите, хотя и увеличивает пределы прочности и упругости сплава, но уменьшает пластичность и вязкость. Содержание фосфора допускается в стали в количестве 0,025-0,045%. В небольших количествах в стали могут присутствовать газовые примеси – кислород, азот, водород. Они образуют хрупкие неметаллические включения в виде оксидов или находятся в свободном виде в трещинах, раковинах и т.д. Особенно вредным является растворенный в стали водород, который повышает хрупкость стали и приводит к образованию т.н. флокенов – тончайших трещин, резко ухудшающих все ее свойства 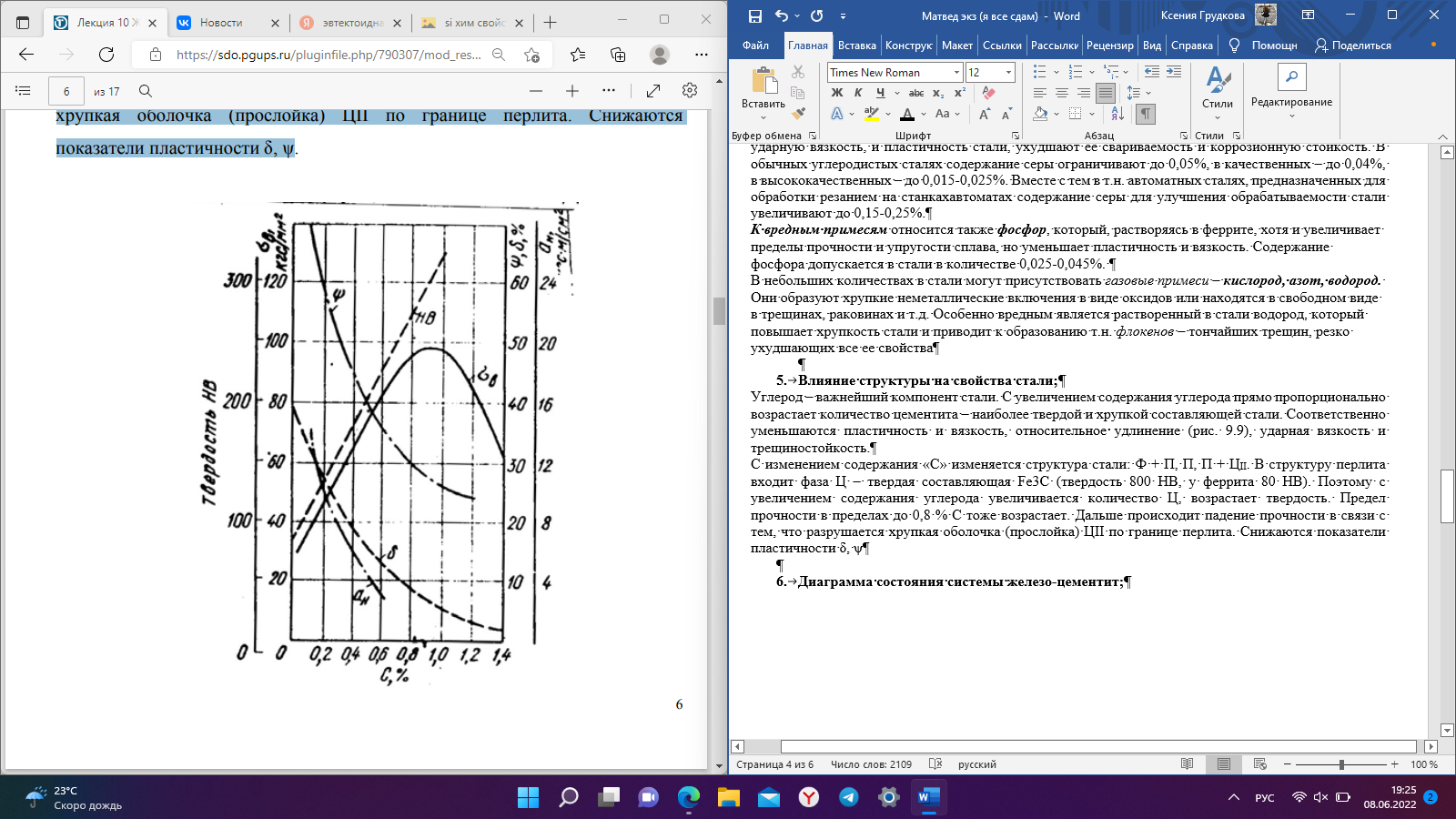 Влияние структуры на свойства стали; Влияние структуры на свойства стали;С изменением содержания «С» изменяется структура стали: Ф + П, П, П + ЦII. В структуру перлита входит фаза Ц – твердая составляющая Fe3С (твердость 800 НВ, у феррита 80 НВ). Поэтому с увеличением содержания углерода увеличивается количество Ц, возрастает твердость. Предел прочности в пределах до 0,8 % С тоже возрастает. Дальше происходит падение прочности в связи с тем, что разрушается хрупкая оболочка (прослойка) ЦII по границе перлита. Снижаются показатели пластичности δ, ψ Сплавы на основе феррита обладают мягкой и пластичной микроструктурой. Прочность и твёрдость аустенита в 2,5-3 больше феррита. Цементит придаёт стали твёрдость. Перлит имеет повышенную прочность и твёрдость по сравнению с ферритом. Поэтому доэвтектоидные стали гораздо более пластичны, чем заэвтектоидные. Кремний повышает прочность стали, но ухудшает её свариваемость и стойкость против коррозии. Алюминий входит в сталь в виде твёрдого раствора феррита и в виде различных нитридов и карбидов, хорошо раскисляет сталь, нейтрализует вредное влияние фосфора, повышает ударную вязкость. Марганец растворяется как в феррите, так и в цементите; образует тугоплавкие карбиды, что приводит к повышению прочности и вязкости стали. Медь несколько повышает прочность стали и увеличивает стойкость её против коррозии. Избыточное её содержание (более 0,7%) способствует старению стали. Азот в несвязанном состоянии способствует старению стали и делает её хрупкой, особенно при низких температурах. Диаграмма состояния системы железо-цементит; 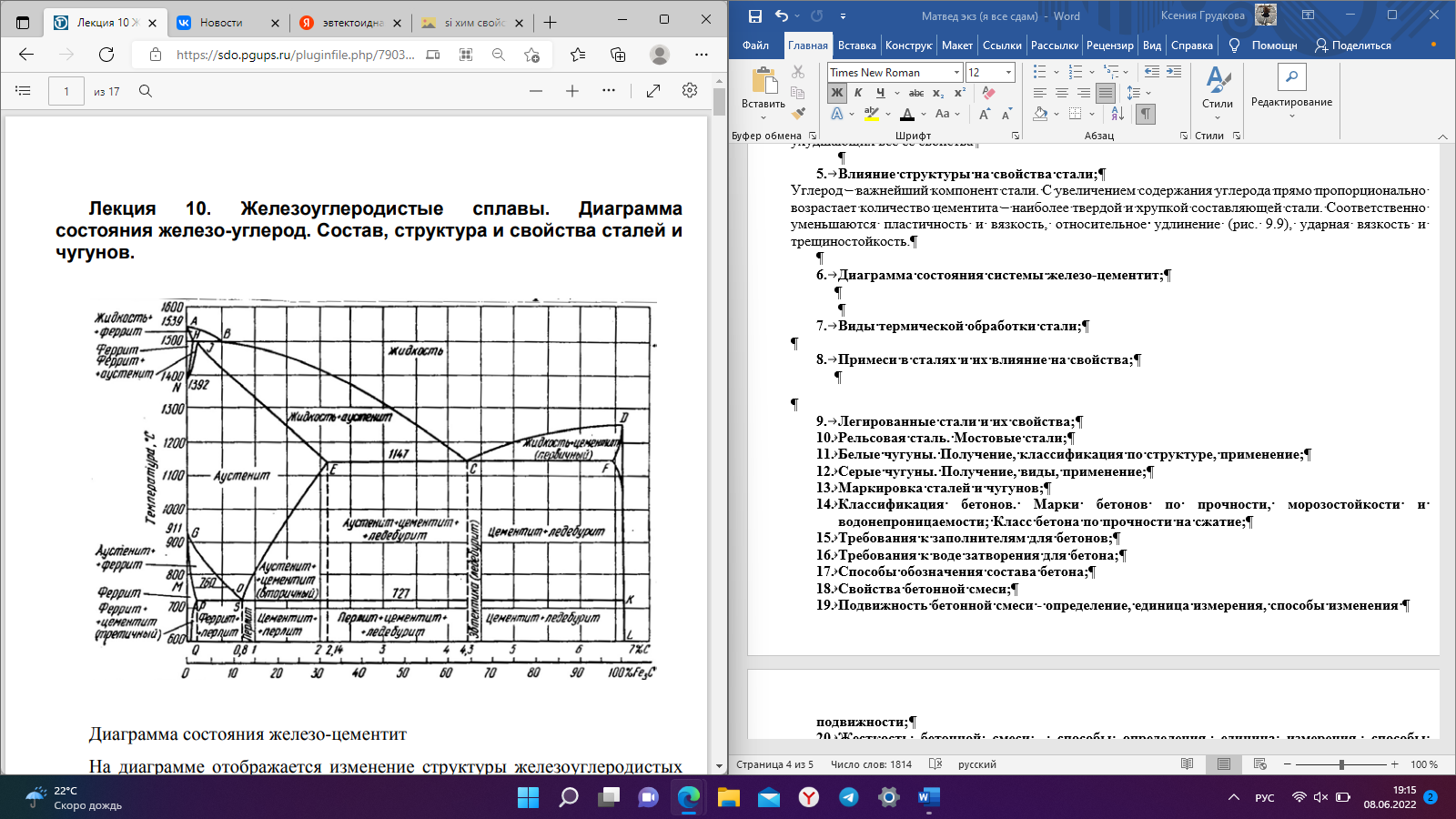 На диаграмме отображается изменение структуры железоуглеродистых сплавов в зависимости от температуры и содержания углерода. Основные точки точка А — температура плавления чистого железа (1539 ºС); точка D — температура плавления цементита (1500 ºС); точка С — эвтектическая точка, имеет минимальную температуру плавления, и отсутствует двуфазное состояние. точка S — эвтектоидная точка, отсутствуют двойные структуры. Основные линии АСD — ликвидус, выше этой линии все сплавы находятся в жидкой фазе. АЕСF — солидус, ниже этой линии все сплавы находятся только в твёрдой фазе. Между ликвидусом и солидусом все сплавы находятся в двухфазном состоянии. PSK — линия перлитных превращений Происходит распад аустенита с образованием перлита. Цементит – Fe3C, линия DFK; Феррит – Ф, Feα, левее GPS и AHN; Аустенит – A, Feγ, линия NJESG. Три горизонтальные линии: 1499 °С HJB перитектика, концентрация 0,1…0,5 % С LB + ФН → ФJ; 1147 °С – эвтектика ЕСF, концентрация 2,14…6,67 % С; 727 °С – эвтектоид PSK, концентрация 0,02…6,67 % С. Для всех С = 0 (закон Гиббса). Модификация Feα существует при температурах от комнатной до 911 °С и от 1390 до 1539 °С, имеет кристаллическую решетку ОЦК с периодом 0,286 НМ (при 20 °С). Особенность этого компонента заключается в ферромагнетизме, которая теряется при температуре выше 768 °С. Эта температура называется точкой Кюри. Модификация Fe γ существует в интервале температур от 911 до 1392 °С, имеющую ГЦК-решетку с периодом 0,364 нм. Фазами железо-углеродистых сплавов являются: расплав, феррит, аустенит, цементит, графит Виды термической обработки стали; |
