Кудрявцев Павел Степанович Курс истории физики
 Скачать 7.55 Mb. Скачать 7.55 Mb.
|
Механическая теория тепла и атомистикаГлубокие мысли Энгельса оставались неизвестными естествоиспытателям. «Анти-Дюринг» печатался в социал-демократической газете и носил явно выраженный полемический характер; «Диалектика природы» вообще стала известной лишь в 1925 г. Однако сами физики начали осознавать, что открытие закона сохранения энергии дает основу для нового синтеза, для цельного взгляда на природу, дает возможность построить единую физическую картину мира. Поскольку все формы энергии оказалось возможным измерить в единой мере, в единицах механической работы, считалось возможным свести все физические процессы к механическим движениям, построить механическую картину мира. Первым шагом в этом направлении явилось создание механической теории теплоты. Создатели механической или динамической теории теплоты осуществили программу, намеченную М.В.Ломоносовым еще в XVIII в. В основе этой программы лежало представление о теплоте как о форме движения мельчайших частиц вещества, «нечувствительных» частичек, по выражению Ломоносова, т. е. молекул и атомов согласно представлениям химиков XIX в. Атомно-молекулярное учение о материи сопутствовало физическим и химическим исследованиям на всем протяжении истории науки, начиная с Левкиппа и Демокрита. Оно то подавлялось и отходило на задний план, то вновь воскрешалось и вело мысль исследователя. Со времен Бойля оно стало служить химии и было положено Ломоносовым в основу учения о химических превращениях. Начало XIX в. ознаменовалось важными открытиями, стимулировавшими развитие химической атомистики. Это было открытие закона постоянства состава и закона кратных отношений. Закон постоянства состава был высказан еще в 1801 г. французским химиком Прустом (1754–1826). В противовес мнению другого французского химика–Бертолле (1748– 1822), учившего, что состав вещества изменяется непрерывно, Пруст утверждал, что процентное содержание компонент сложных веществ изменяется скачком. Спор с Бертолле продолжался восемь лет и закончился победой Пруста. Закон постоянства состава и скачкообразное изменение весового содержания компонентов в различных соединениях простых веществ подсказьюают идею о неизменяемых мельчайших частичках вещества, вступающих во взаимодействие друг с другом в сложных соединениях. Эта мысль была высказана и подробно обоснована  английским химиком Джоном Дальтоном. английским химиком Джоном Дальтоном.Джон Дальтон родился 6 сентября 1766 г. в семье деревенского ткача. Как и его знаменитый соотечественник фарадей, он приобрел знания самообразованием и уже к 15 годам достиг таких успехов, что получил место преподавателя математики в школе города Кендала. В 1793 г. он становится преподавателем натуральной философии (так в английских колледжах называлась физика) и математики в колледже в Манчестере, где знаменитый социалист-утопист Роберт Оуэн вводит его в состав Манчестерского литературного и философского общества. Членом этого общества позднее был другой знаменитый манчестерец –Джоуль, а в XX в. на заседании этого общества Эрнст Резерфорд сделал доклад о своих опытах, приведших к открытию ядерной модели атома. Дальтон в 1800 г. становится секретарем общества, а с 1817 г. его председателем. Умер Дальтон в Манчестере 27 июля 1844 г. Дальтону принадлежат фундаментальные исследования смесей газов и паров, в результате которых он вывел названный его именем закон независимости парциальных давлений компонентов смеси (1801–1802). В 1802 г. за несколько месяцев до Гей-Люссака он установил закон теплового расширения газов. В 1803 г. Дальтон, руководствуясь атомистической гипотезой, вывел закон кратных отношений и доказал его на примере углеводородных соединений – метана и этилена. Дальтон ввел в химию фундаментальное понятие атомного веса и, приняв за единицу атомного веса вес атома водорода, определил атомные веса некоторых элементов. Ошибочно приняв, что в состав молекулы воды входит один атом водорода и один атом кислорода, он неправильно определил атомные веса кислорода и азота. Но Дальтон первым составил таблицу атомных весов и ввел химическую символику, правда, не вполне удачную и замененную в химии более удобной символикой Берцелиуса (1779-1848). Как нередко бывает в истории науки, открытия, легшие в основу современной химии, делались независимо и почти одновременно многими исследователями. К открытию атомного веса подходил немецкий химик Иеремия Рихтер (1762–1807). Закон расширения газов был установлен независимо от Дальтона в 1802 г. французским физиком и химиком Жозефом Луи Гей-Люссаком (1778–1850). Через три года после этого открытия Гей-Люссак начал совместно со знаменитым немецким естествоиспытателем Александром Гумбольдтом опыты, которые привели в 1808 г. к установлению закона кратных объемов, согласно которому объем газообразного соединения находится в простом кратном отношении к объемам компонентов. Однако теоретическое истолкование этого закона в ряде случаев приводило к противоречию с, данными Дальтона, и Дальтон резко выступал против этого закона. Сам же Гей-Люссак отказался от попыток теоретически истолковать открытый им закон и рассматривал его как опытный факт. В 1811 г. итальянский физик и химик Амедео Авогадро (1776-1856), развивая атомно-молекулярную теорию, установил закон, ныне носящий его имя: при одинаковых условиях температуры и давления в равных объемах газов содержится одинаковое количество молекул. При этом Авогадро допускал, что молекула одного и того же элемента может состоять из нескольких атомов, и это дало ему возможность объяснить результаты опытов Гей-Люссака в терминах атомно-молекулярной теории. Аналогичную точку зрения высказал в 1814 г. Ампер. Дальтон, Берцелиус и другие видные химики не приняли теорию Авогадро и задержали развитие химической атомистики до 60-х годов XIX в., когда Же-рар (1816–1856) подтвердил закон Авогадро новыми опытными данными и поддержанная итальянским химиком Канниццаро (1826–1910) атомно-молекулярная теория прочно вошла в химию. Утверждение атомной теории в химии соответствовало ее применению в физике, когда открытие закона сохранения энергии воскресило представление о теплоте как о форме движения. Это представление, высказанное в 1620 г. в смутной форме ф. Бэконом, развитое в 1743–17,45 гг. М.В.Ломоносовым, было вновь высказано одним из основателей закона сохранения и превращения энергии – Джемсом Джоулем в докладе «Некоторые замечания о теплоте и о строении упругих жидкоcтей», сделанном на заседании Манчестерского литературного и философского общества 3 октября 1848 г. Доклад был опубликован только через три года в трудах общества и затем через шесть лет в «Philosophical Magazine» Джоуль начинает с указания на свои опыты, результаты которых были доложены на съезде Британской Ассоциации в 1842 г. Эти опыты показали, «что магнитоэлектрическая машина дает нам возможность обратить механическую силу в теплоту». Вместе с тем они привели к выводу о взаимной обратимости теплоты и механической силы и, следовательно, к выводу, «что теплота является либо vis viva (живой силой) весомых частиц, либо некоторым состоянием притяжения и отталкивания способным порождать vis viva (живую силу)».  Так Джоуль со всей ясностью пока зывает, что закон сохранения энергии находит свое выражение в превращении работы в теплоту в строго определенном количественном отношении. Ученый приходит к выводу, что теплота является формой кинетической энергии (живой силы) или потенциальной («некоторым состоянием притяжения и отталкивания») весомых частиц Упоминая о своих опытах 1844 г. по изменению температуры воздуха путем адиабатического сжатия или расшире ния, он заключает, что упругость газов «должна представлять собой эффект движения частиц, из которых состоит всякий газ». Приводя высказывание Дэви о теплоте как о колебательном движении частиц вещества, Джоуль указывает, что он лично «попытался показать, что вращательное движение, аналогичное описанному сэром Дэви, способно объяснить закон Бойля и Мариотта, а также другие явления, представляемые упругими жидкостями». Джоуль не знает, что Ломоносов объяснил закон Бойля с помощью гипотезы о вращательном движении «нечувствительных частичек». Однако он считает более простой гипотезу, высказанную в 1821 г. Герапатом, в которой частицы газа принимаются движущимися поступательно во всех направлениях, и исходит из этого представления, подчеркивая вместе с тем, что «гипотеза вращательного движения в равной мере хорошо согласуется с этими явлениями». Джоуль приводит подсчет скорости движения частиц водорода, находящегося при определенной температуре и давлении Он оперирует конкретными цифрами массы, температуры, давления водорода и, считая, что частицы движутся в сосуде кубической формы в равном количестве по трем направлениям, показывает, что «давление будет пропорционально квадрату скорости частиц» Джоуль определяет численное значение этой скорости. Вывод Джоуля совершенно конкретен газ – водород, масса газа 36,927 грана, давление 30 дюймов ртутного столба, температура 60° Фаренгейта. Скорость частиц водорода оказалась равной 6225 футам в секунду, при температуре замерзания воды (32° Фаренгейта) она будет 6055 футов в секунду Джоуль указывает, что при этих подсчетах частицы водорода считаются не имеющими заметного размера, иначе скорость получалась бы при том же давлении меньшей. Он указывает далее, что «абсолютная температура, давление и vis viva пропорциональны друг другу», а теплоемкость газа «выражается общей суммой vis viva при данной температуре» Таким образом, на основе конкретного числового подсчета Джоуль выводит основной закон идеального газа. В 1857 г в «Анналах» Поггендорфа была напечатана статья Клаузиуса «О роде движения, который мы называем теплотой «Перепечатывая эту статью в третьем томе своей «Механической теории тепла», Клаузиус дополнил ее исторической справкой, в которой упомянул о Джоуле, переиздавшем свою статью 1848 г. согласно пожеланию Клаузиуса в 1857 г., а также о работе Крѐнига «Очерки теории газов», опубликованной в «Анналах» Поггендорфа в 1856 г. В этой справке Клаузиус называет длинный ряд имен, начиная с Лукреция, Гассенди, Бойля и Даниила Бернулли. Ломоносова он, однако, не упоминает, его работы, опубликованные в «Новых Комментариях» Петербургской Академии наук, были к тому времени уже забыты. Сам Клаузиус сознается, что к его списку, «вероятно, можно будет прибавить еще и ряд других авторов», но он «не читал более старых авторов». Так или иначе, но имя Ломоносова в период торжества его идей не упоминалось. Клаузиус подчеркивает, что его термодинамические исследования не связаны с какими-либо представлениями О тепловом движении. Все сделанные в первой части «Механической теории тепла» выводы «основываются на некоторых обидах законах, которые можно признать правильными, не делая никаких определенных предположений о природе теплоты». Эта общность термодинамических методов, впервые четко констатированная Клаузиусом, делает термодинамику чрезвычайно мощным инструментом исследования, применимым во всех областях физической науки. Вместе с тем Клаузиус признает, что его исследования «не были свободны от мысли о некоторой гипотезе» и что он «уже в начале своих работ, относящихся к теплоте..., попытался разобраться во внутреннем состоянии движения нагретого тела и составил себе об этом некоторое представление...». Это признание Клаузиуса очень важно. Еще до опубликования первой своей работы он руководствовался мо-лекулярно-кинетической гипотезой, она помогала ему выработать основные понятия и принципы теории теплоты. Термодинамике специальная гипотеза о природе теплоты не нужна, но создателю термодинамики она была необходима. «Таково свойство гипотез, – писал Д.И.Менделеев. – Они науке, и особенно ее изучению, необходимы... Гипотезы облегчают и делают правильную научную работу–отыскание истины как плуг земледельца облегчает выращивание полезных растений». Клаузиус излагает основные представления новой теории газов, которую он называет «кинетической». Молекулы газа движутся прямолинейно с постоянной скоростью, которая изменяется в процессе столкновения с другими молекулами или с непроницаемой стенкой. При этом «живая сила их движений в среднем сохраняет ту же величину, какую она имела до столкновения». Давление газа объясняется ударами молекул о непроницаемую стенку. Наряду с поступательным движением Клаузиус допускает и вращательное, а также некоторое колебательное движение внутри отдельных частичек. Если даже принять атомы абсолютно неизменными, то молекула, состоящая из нескольких атомов, «не образует уже абсолютно неизменной массы» и атомы внутри ее «могут колебаться друг относительно друга». Клаузиус допускает также возможность того, «что каждый весомый атом обладает еще и некоторым количеством более тонкой материи и что последняя, не отделяясь от атома, может поблизости от него совершать некоторые движения». Наличие этих внутренних движений приводит к тому, что отдельные молекулы между собой и с молекулами стенки взаимодействуют не упруго. В среднем же установившемся состоянии поступательное движение молекул не изменяется под влиянием движения частей молекул, и «при исследовании совокупного действия большого количества молекул можно пренебречь неправильностями, имеющими место при отдельных столкновениях, и полагать, что по отношению к поступательному двиясению молекулы следуют общим законам упругости». При этом Клаузиус считает, что поступательное движение каждой молекулы в среднем находится в постоянном отношении к движению ее составных частей. Еще в 1857 г. Клаузиус вывел основную формулу кинетической теории газов, согласно которой давление газа равно двум третям средней кинетической энергии всех молекул в единице объема. В третьем томе «Механической теории тепла» он снова обращается к этому выводу. Рассматривая механизм удара молекулы о стенку, он считает, что благодаря наличию движений составных частей молекул таза и стенки происходит взаимодействие этих внутренних движений и «в зависимости от фаз, в которых находятся движения последних в момент удара, они могут различным образом повлиять на движение всей молекулы, возникающее в результате удара». Как видим, Клаузиус ясно представлял себе сложность процесса столкновения молекул и атомов и определяющую роль движений их структурных элементов. Но для большого числа молекул в среднем дело обстоит так, как если бы молекулы отражались после удара о стенку «согласно тем же законам, что и упругие шары от неподвижной стенки». Таким образом, механизм упругого удара, обусловливающий давление газа, получается, по Клаузиусу, в результате усреднения, когда «можно принять, что после отражения молекулы в среднем обладают той же самой живой силой, какую они имели в момент налета, и что среди отраженных молекул все направления движений по отношению к стенке представлены совершенно так же, как были представлены направления движений налетевших на стенку молекул». Если сделать такое допущение, то, указывает Клаузиус, «при определении давления совершенно безразлично, если вместо среднего лишь равенства допустить существование равенства при каждом отдельном ударе». При обычном, школьном выводе просто предполагается, что молекула сталкивается со стенкой по законам упругого удара, и таким образом игнорируется тот сложный путь, который привел Клаузиуса к этому допущению. Вторым допущением Клаузиуса является гипотеза идеального (совершенного) газа: во-первых, молекулы газа «настолько малы, что их объемом можно пренебречь по сравнению с объемом, занимаемым всем газом, и, во-вторых, молекулы проявляют силы взаимодействия, лишь находясь в непосредственной близости друг от друга». Кроме того, при подсчете давления Кяаузиус делает мимоходом предположение, что молекулы газа «движутся во всех возможных направлениях, так что любое направление столь же вероятно, как и все прочие». Это гипотеза молекулярного хаоса. При вычислении давления Клаузиус использует второй и третий законы Ньютона, а так как к тому же от столкновения до столкновения молекулы, по предположению, движутся равномерно и прямолинейно по закону инерции, то, очевидно, Клаузиус принимает, что к молекулам и атомам применимы законы Ньютона, законы классической механики. Итак, Клаузиус строит кинетическую теорию газов на основе классической механики, привлекая молекулярные представления и статистику. В формуле давления у него фигурирует средний квадрат квадратов скоростей отдельных молекул. Он вычисляет среднее число столкновений и среднюю длину свободного пробега молекулы, оперируя понятиями теории вероятностей. Эти результаты и методы подсчета Клаузиуса ныне вошли в учебники физики. 21 сентября 1859 г. на собрании Британской Ассоциации содействия прогрессу наук Джемс Клерк Максвелл сделал доклад «Пояснения к динамической теории газов». Максвелл отмечает, что из молекулярной гипотезы «может быть выведено так много свойств материи, в особенности если ее взять в газообразной форме, что истинная природа этого движения является предметом естественного интереса». Максвелл указывает далее, что Даниил Бернулли, Джоуль, Крѐниг, Клаузиус и другие «показали, что отношения между давлением, температурой и плотностью в совершенном газе могут быть объяснены, если предположить, что частицы движутся с постоянной скоростью по прямолинейным путям, ударяясь о стенки сосуда, содержащего газ, и вызывая этим давление». Для определения таких молекулярных величин, как средняя длина свободного пробега и диаметр молекулы, Максвелл исследует на основе законов механики движение и столкновение некоторого числа твердых, упругих шаров малого размера. Он приходит к выводу, что в такой системе в результате взаимных столкновений устанавливается распределение живых сил между частицами «согласно некоторому правильному закону». При этом возможно определить «среднее число частиц, скорости которых лежат между определенными пределами, хотя скорость каждой отдельной частицы изменяется при каждом столкновении». Максвелл находит следующие результаты. «1. Число частиц, скорость которых, разложенная в определенном направлении, лежит между х и x + dx, равно: 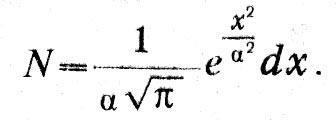 (1) Число частиц, действительные скорости которых лежат между v и v + dv, равно: 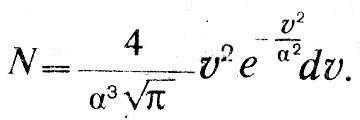 (2) Средняя скорость равна: Среднее значение равно: Максвелл в качестве общего вывода констатирует, что «скорости распределяются между частицами по тому же закону, по которому распределяются ошибки между наблюдениями в теории «метода наименьших квадратов». Скорости лежат в пределах от 0 до °°, однако число молекул, имеющих большие скорости, сравнительно невелико. Далее Максвелл показывает, что если в одном и том же сосуде движутся две системы частиц, то «средняя живая сила каждой частицы одинакова в обеих системах». Позднее Максвелл в своей речи «Молекулы» говорил по поводу этого предложения: «Динамическая теория говорит нам также и о том, что происходит, когда молекулы различных масс сталкиваются друг с другом. Большие массы будут двигаться медленнее меньших, так что в среднем каждая молекула, большая или малая, будет иметь ту же энергию движения. Доказательство этой динамической теоремы – и в этом я заявляю свои права на приоритет – в последнее время получило широкое развитие и усовершенствование благодаря трудам д-ра Людвига Больцмана. Самое важное следствие, из нее вытекающее, состоит в том, что кубический сантиметр любого газа при постоянных температуре и давлении содержит одинаковое число молекул». Так закон Авогадро получил свое истолкование в кинетической теории газов наряду с другими законами идеальных газов. , где х - заданное расстояние. Среднее расстояние, проходимое каждой частицей до столкнлвения, равно l =1/α. Он показывает далее, что давление, вызванное ударами частиц о стенку, выражается формулой: 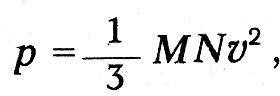 где N - число частиц в единице объема, М - масса каждой частицы, v - ее скорость. В выводе Максвелла фигурирует средняя длина свободного пробега, которая выпадает из конечного результата. Полагая MN = ρ - плотность газа, получаем: p=kρ, что выражает закон Бойля –Мариотта. При этом константа а выражается через средний квадрат скорости: 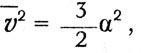 Длину свободного пробега Максвелл определяет из коэффициента внутреннего трения. Рассматривая перенос количества движения («момента», по терминологии Максвелла) между двумя слоями газа, движущимися с различными скоростями, он находит выражение для силы трения, приходящейся на единицу площади: F = 1/3 MNlv (du/dz) , где du/dz – градиент скорости. Полагая F = μ(du/dz), согласно закону трения, находим: μ =1/3 MNlv = 1/3 ρ lv. 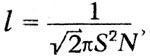 Но длина свободного пробега Но длина свободного пробегагде S - диаметр частицы. Отсюда получаем: Максвелл пишет, что его уравнение «приводит нас к замечательному выводу», заключающемуся в том, что «коэффициент трения не зависит от плотности. Этот вывод из математической теории является крайне поразительным, и единственный опыт, с которым я встретился в этой области, его как будто не подтверждает». На самом деле, как оказалось, этот вывод подтвердился опытом в широких пределах давлений, но Максвелл считает необходимым «сопоставить свою теорию с тем, что известно о диффузии газов и. о происхождении теплоты через газ». Таким образом, Максвелл исследовал впервые явления переноса. Подводя итоги своим исследованиям, Максвелл писал: «Мы проследили здесь за математической теорией столкновения твердых упругих частиц в различных случаях, в которых, казалось бы, существует аналогия с явлением газов. Мы вывели, как это уже раньше сделали и другие, отношения давления, температуры и плотности для отдельного газа. Мы также доказали, что когда два различных газа свободно действуют друг на друга (а это бывает, когда они находятся при одной и той же температуре), то массы отдельных частиц каждого газа обратно пропорциональны квадрату молекулярной скорости и что, следовательно, при равной температуре и равном объеме количество частиц в единице объема одинаково». В резюме Максвелла обращает; на себя внимание тот факт, что он ни слова не говорит об открытом им законе распределения скоростей, зато подроб^ но говорит об объяснении закона Аво-гадро. Заметим, что об этом объяснении он всегда упоминал в своих популярных статьях и выступлениях. Между тем мы сейчас видим главную заслугу Максвелла в открытом им законе скоростей и забыли о том, что сам Максвелл считал наиболее важным. Теорию равномерного распределения энергии по степеням свободы мы связываем с Больцманом. Она охватывает открытие Максвеллом равенства средних энергий молекул независимо от их массы при одной и той же температуре и объясняет неудачу его попытки истолковать соотношение теплоемко стей. В теории Максвелла особенно наглядно видны ее механические предпосылки. Модель твердых упругих шариков, предложенная Максвеллом для объяснения газовых законов, работает по законам механики Ньютона. Максвелл не сомневался в применимости этих законов к атомам и молекулам. Но его поражал один замечательный факт в атомно-молекулярном мире; строгая определенность свойств молекул и атомов. «Молекулы, – пишет Максвелл, – образованы по одному и тому же типу с точностью, какой мы не находим в ощущаемых нами свойствах тел, ими образуемых. Во-первых, масса каждой молекулы и все другие ее свойства абсолютно неизменны. Во-вторых, свойства всех молекул одного рода абсолютно тождественны». Открытие спектрального анализа вновь подтвердило эту определенность свойств молекул и атомов. «При помощи спектроскопа, – говорил Максвелл, – длины световых волн различного рода можно сравнивать между собой до одной десятитысячной доли. Таким путем убедились, что не только молекулы каких угодно образчиков водорода в наших лабораториях имеют один и тот же ряд периодов колебаний, но что свет с тем же самым рядом периодов колебаний испускается Солнцем и неподвижными звездами. Таким образом мы убеждаемся, что молекулы такой же точно природы, как у нашего водорода, существуют и в отдаленных пространствах... Молекула водорода... находится ли она на Сириусе или на Арктуре, совершает свои колебания в точности в то же самое время. Следовательно, каждая молекула во Вселенной носит на себе печать меры и числа настолько же ясную, как и метр парижских архивов или как двойной царский локоть карнакского храма». Ум Максвелла останавливается перед этой таинственной, не объяснимой никакими известными в его время естественными причинами загадкой определенности молекул, необычайной устойчивости их свойств. Он сравнивает эту устойчивость с устойчивостью планетных орбит и указывает, что «научное значение этих астрономических и земных величин много ниже фундаментальных величин, образующих молекулярную систему». «Как мы знаем, – пишет Максвелл, – естественные процессы изменяют и в конце концов разрушают весь порядок и размеры как Земли, так и всей солнечной системы. Но если случались и вновь могут случиться катастрофы, если старые системы могут разрушаться и на их развалинах могут возникать новые системы, то молекулы, из которых эти системы построены, неразрушимы и неизменны – это краеугольные камни материальной Вселенной». Максвелл считает, что такая определенность и неизменяемость молекул, придающая им, по выражению Джона Гершеля, «характерные признаки фабричных изделий », «исключает мысль о возможности их вечного существования и самопроизвольного происхождения», т. е. молекулы и атомы должны быть «изготовлены» богом. Так, по Максвеллу, мы подошли к точке, «дальше которой наука идти не может». Но наука пошла дальше. То, перед чем остановился Максвелл и к чему призвал на помощь бога, то, что было совершенно необъяснимо с точки зрения классической физики, привлекло внимание Бора. Он открыл в этой определанности «числа и меры» определенность квантовых законов, в которых господствует неизменная и неразрушимая величина – постоянная Планка. Бор в своей нобелевской речи также сравнивает законы, управляющие движением планет, с законами, господствующими в атоме водорода, как и Максвелл. Квантовая физика нашла ключ к разрешению загадки, перед которой остановился Максвелл. Но величие Максвелла в том и проявляется, что он понял, что это загадка, непосильная для классической физики. |
