Курс лекций №1. Курс лекций 1 по аналитическо й химии Содержание
 Скачать 204.5 Kb. Скачать 204.5 Kb.
|
|
Курс лекций №1 по аналитическо й химии Содержание Предмет и задачи аналитической химии. Значение аналитической химии в науке. Анализ в биологии и службе охраны природы. Концентрация и активность. Ионная сила раствора. Химическое равновесие. Константа химического равновесия (концентрационная, термодинамическая, условная). Равновесная концентрация. Понятие об аналитической концентрации. Теории кислот и оснований (Аррениуса, Льюиса, Бренстеда - Лоури). Протеолитическая теория: анализ роли растворителя. Классификация растворителей. Автопротолиз растворителей. Влияние растворителей на силу кислот и оснований. Равновесие в водных растворах сильных и слабых кислот и оснований. Расчет рН. Буферные растворы. Механизм буферного действия, понятие буферной емкости. Расчет рН. Равновесие в водных растворах гидролизующихся солей. Расчет рН. Понятие об окислительно-восстановительной системе. Окислительно-восстановительный потенциал. Уравнение Нернста. Константа равновесия ОВР. Понятие органичных реагентов. Теоретические основы их действия. Классификация методов анализа. Требования к методам анализа и к результатам. Аналитические реакции и реагенты, требования к ним. Способы повышения селективности и чувствительности. Дробный и систематический анализ ионов, групповой реагент. Подготовка образца к анализу: понятие средней пробы, ее представительность. Способы отбора, вскрытие. Гравиметрический метод анализа, сущность, виды. Механизм образования осадка. Условия образования кристаллических и аморфных осадков. Формы осадка, требования к ним и осадителю. Загрязнение осадка, борьба с загрязнением. Сущность титриметрического метода анализа. Требования к реакциям в титриметрии. Способы фиксирования точки эквивалентности. Кислотно-основное титрование, сущность метода, виды, область применения. Построение кривых титрования. Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов. Примеры окислительно-восстановительного титрования: перманганатометрия. Примеры окислительно-восстановительного титрования: иодометрия. Возможности метода, особенности фиксирования точки эквивалентности. Комплексонометрическое титрование, комплексометрическое титрование. Построение кривых титрования, фиксирование точки эквивалентности. Атомная эмиссионная спектрометрия. Качественный и количественный спектральный анализ. Атомно-абсорбционная спектрометрия, сущность метода. Понятие о других спектральных методах анализа: люминесцентный, рефрактометрический. Электрохимические методы анализа. Потенциометрический метод анализа. Потенциометрический метод анализа: прямая потенциометрия и потенциометрическое титрование. Полярографический метод. Сущность, схема прибора. Полярографическая волна, качественный и количественный полярографический анализ. Экстракция – сущность метода, количественные характеристики. Хроматография – теоретические основы, классификация методов. Другие виды хроматографии: ионообменная хроматография, гельпроникающая хроматография, тонкослойная хроматография. 1. Предмет и задачи аналитической химии. Значение аналитической химии в науке. Анализ в биологии и службе охраны природы. АХ - наука о методах определения качественного и количественного состава вещества, АХ является составной частью единой хим.науки. Предмет АХ - разработка методов анализа, их практическое выполнение, опр-е состава вещ- в, изучение физ.св-в вещ-в. Задачи: 1. развитие теории методов анализа. 2. разработка и совершенствование методов анализа. 3. обеспечение хим.-аналитич. контроля в процессе проведения научно-исследовательских работ. Большое место отводится в АХ поиску новых современных методов анализа, с использованием новых достижений науки и техники. Анализ имеет большое значение для промышленности, медицины. Определяется состав вод, почв. В пром-ти исп-ся состав как количественный так и качественный сплавов материалов и т.д. 2. Концентрация и активность. Ионная сила раствора. Концентрацию, в зависимости от раствора выражают след. способами: Т-титр. Если использумые вещ-ва является электролитами, то их состояние хар-ся степенью диссоциации L. Активность- та эффективная кажущаяся концентрация ионов в р-ре, в соотношении с кот. он проявляет себя в химич. реакции. Активность связана с концентрацией в соотношении: a=f*c, где f- коэф-т активности. Значение коэф-та активных ионов опр-ся только ионной силой раствора, и не зависит от природы других ионов, присутствующих в растворе - закон ионной силы Льюиса и Рэндала. Ионная сила при этом хар-т общее содержание ионов в растворе и рассчитывается как 3. Хим. равновесие. Константа хим. равновесия (концентрационная, термодинамическая, условная). Равновесная концентрация. Понятие об аналитической концентрации. Концентрации веществ, имеющие место в системе с момента наступления равновесия, называются равновесными [ ], эти концентрации остаются неизменными столько долго, сколько не изменяется внешнее условие. Равновесная концентр. вещества зависти от его исходной концентрации и расхода вещ-ва на протекание реакции до момента установления равновесия. 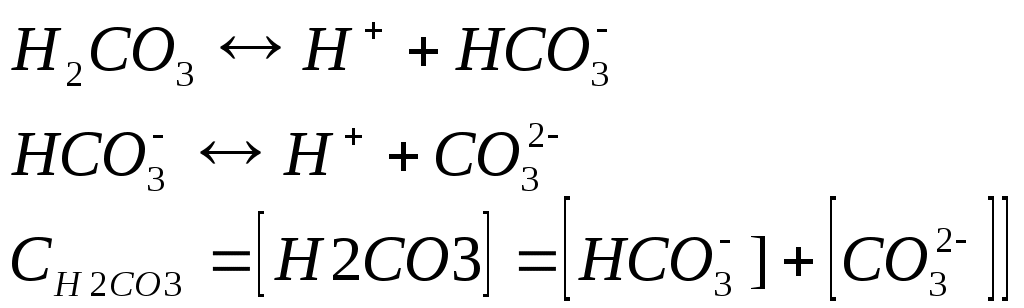 т.о аналитическая концентрация - это общая концентрация вещества в растворе, независимо от формы его содержания (ионы, молекулы). Для обратимых реакции закон действующих масс записывается в виде константы равновесия А+В↔С+Д 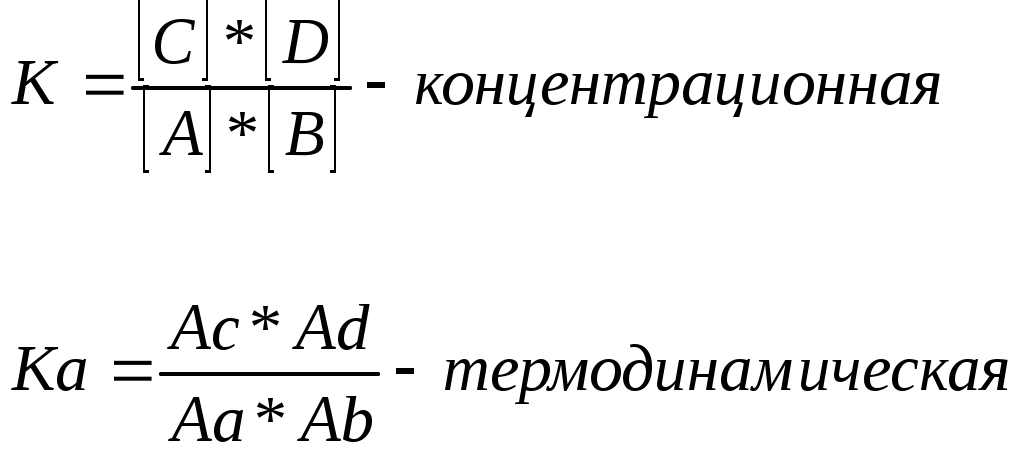 4. Теории кислот и оснований (Аррениуса, Льюиса, Бренстеда-Лоури). Одной из первых теорий объясняющих природу кислот и оснований явилась теория электролитической диссоциации Аррениуса - Оствальда. Согласно ей кислотой является электронейтральное вещество, которое при диссоциации в воде в качестве катиона образует только ионы водорода Н+. НА↔Н++А- А основанием является вещество, которое при диссоциации образует в воде в качестве аниона только гидроксид – ионы. NaOH→Na++OH- Но так как возникали некоторые трудности (некоторые вещества проявляли свойства солей, кислот и т.д), то пришла на смену протеолитическая теория кислот и оснований- Бренстеда-Лоури, согласно которой кислотой является любое вещество, способное отдавать протон, а основанием способное принимать протон. Многие соли в водных растворах ведут себя как кислоты, хотя Н+ в их составе нет. Эти факты были объяснены в теории Льюиса, но она не нашла широкого применения. 5. Протеолитическая теория: анализ роли растворителя. Классификация растворителей. Теория Бренстеда-Лоури, согласно которой кислотой является любое вещество, способное отдавать протон, а основанием способное принимать протон. Растворитель является не только средой, но и участником процесса. Растворители: протонные -могут отдавать или принимать протон. Кислотные - способны к отдаче протона, основные –способны присоединять протон, амфотерные и то и другое. апротонные – не обладают донорно-акцепторными свойствами по отношении к протону. Если вещество взято в качестве растворителя, то в зависимости от того, какая тенденция отдача или присоединение протона у него преобладает, то оно может различным образом влиять на ионизацию растворенного вещества. По влиянию на кислотно-основные св-ва: невелирующие и дифференцирующие. 6. Автопротолиз растворителей. Влияние растворителей на силу кислот и оснований. Автопротолизу подвергаются амфотерные растворители. Если вещество взято в качестве растворителя, то в зависимости от того, какая тенденция отдача или присоединение протона у него преобладает, то оно может различным образом влиять на ионизацию растворенного вещества. Автопротолиз растворителей протекает в незначит. степени, в растворе наступает равновесие которое описывается константой:  это важнейшее выражение, свидетельствующее о том, что в любом растворе имеются как ионы водорода, таки гидроксид ионы. Реакция среды: рН=-lgaH+ рН=7 в нейтральном растворе, рН<7 в кислом pH>7 в щелочном. Аналогично водородному определяют гидроксильный показатель рОН= lgaОН+ А выражение часто записывают в логарифмической форме: рН+рОН=14 7. Равновесие в водных растворах сильных и слабых кислот и оснований. Расчет рН. 1. Когда слабые кислоты диссоциируют в незначительной степени, то в растворе наступает равновесие. НА↔Н++А- Оно описывается 2. Сильные кислоты в водных растворах диссоциируют практически нацело НА→Н++А- Концентрация ионов водорода совпадает с общей концентрацией кислоты в растворе, а рН=- [H+]=Cк, рН=-lg[H+]=-lgCk 3. Сильные основания (щелочи) диссоциируют нацело ВОН→В++ОН- 4. Слабые основания - диссоциируют в незначит. степени и этот процесс описывается соответствующей константой, и наз-ся константой диссоциации слаб.основания. ВОН↔В++ОН- 8. Буферные растворы. Механизм буферного действия, понятие буферной емкости. Расчет рН. Существуют растворы при добавлении к которым небольшого количества кислоты, щелочи или при их разбавлении рН изменяется незначительно - буферные растворы. А указанная их способность поддерживать рН практически постоянной называется буферным действием. Буферной способностью обладают смеси следующего типа: 1.смесь слабой кислоты и соли с одноименным анионом. CH3COOH+CH3COONa 2. смесь слабого основания и соли с одноименным катионом NH3+NH4Cl 3. смесь слабой многоосновной кислоты различной степени замещенности NaH2PO4+Na2KPO4 Буферное действие растворов характеризуется буферной емкостью. Это то мин. кол-во сильной к-ты или щелочи, кот. необходимо добавить к 1 л. буферного р-ра, чтобы его рН изменилась на единицу. рН буф.р-ров зависит от конст.диссоциации слабой к-ты или основания и от компонентов буф. р-ра. [H+]= Ккисл*(Скисл./Ссоли) [ОH-]= Косн.*(Сосн../Ссоли) 9. Равновесие в водных растворах гидролизующихся солей. Расчет рН. Расчет рН в р-рах солей: гидролиз по аниону: для расчета рН в растворе соли удобнее пользоваться след. схемой: а) написать ур-е р-ции гидролиза; б) рассчитать концентрацию ионов; в) рассчитать рОН, затем рН. 2) при гидролизе по катиону: 3) в случае совместного гидролиза по катиону и аниону: 10. Понятие об окислительно-восстановительной системе. Окислительно-восстановительный потенциал. Уравнение Нернста. Признаком ОВР является переход электронов от одних частиц к другим. Напр. 2Fe2++Sn2+→2Fe2++Sn4+ Электрон переходит от ионов олова (восст-ль) к ионам железа (ок-ль). Каждую ОВР можно представить как сумму 2х полуреакций: Восстановление - окислителя и окисление-восстановителя. Роль окислителя закл.в присодеинении электрона, а роль восст-ля в их отдаче, т.о. различие в силе ок-ей и восст-лей связана с их спос-тью к присоединению или отдаче электрона. Чем легче атом, ион, молекула отдает электрон, тем является более сильным восст-лем, и наоборот, чем больше средство к эл-ну, тем более сильным окислителем она является Количественно эту активность хар-т значением Е-потенциала. ОВ систему или редоксопару запис-т: Fe3+ /Fe2+ Sn4+ / Sn Потенциал отдельн. редоксопар изменить невозможно, но можно составлять гальванич. элементы, комбинируя редоксопары с одной и той же системой, условно принятой в качестве отсчетной. Такой отсчетной системой явл. система (2Н+/Н2). Потенциал ОВ пары зависит не только от ее природы, но и от др.факторов- гл. является концентрация и активность. Ур-е Нернста: где, Е0 –станд. ОВ потенциал, R-газовая постоянная, T-абсолютная температура, n-число электронов участвующих в процессе, F-постоянная Фарадея (96500 Кл/моль), под log стоит отношение активности окислительных и восстановительных форм. Значение Е наз-т реальным ОВ потенциалом системы. 11. Константа равновесия ОВР. Возможность протекания ОВР в противоположном направлении свидетельствует о ее обратимости. Обратимые химические реакции характеризуются константой равновесия. ОВ потенциалы соответствующих редоксопар опр-ся Ур-ем Нернста. где, n- общее число электронов переходящих от ок-ля к восст-лю. Применение ОВР в анализе многообразно: для обнаружения ионов, для количественного обнаружения ионов, разделения ионов, устранения мешающих анализу ионов. 12. Понятие органич. реагентов. Теоретические основы их действии. Под органич. реагентами понимают органич. соединения, применяемые в анализе для след. целей: качественное и количественное обнаружение ионов. разделение ионов. маскирование. Широкое применение реагентов обусловлено их достоинствами в сравнении с неорганическими: высокая селективность. высокая чувствительность (опр-ет малое кол-во ионов в разбавленных р-рах) большое кол-во доступных реагентов и возм-ть изменения их свойств. Впервые реагенты были предложены для применения в анализе Илинским, кот. в кач. реагента анионы Со предложил использовать органические. Несколько позже Чугаевым был предложен диметилглиаксин для опр-я ионов Ni. Св-ва органич.реагентов зависят от присутствия в их молекулах опр.атомных групп, обладающих кислотными св-ми. Атомы водорода входящие в их состав способны замещаться атомами Ме. Кроме того в молекуле органич. реагента присутствует др.группа атомов, обладающих неподделенной электронной парой. Поэтому катион Ме одновременно образует донорно-акцепторую связь с указанным атомом. 13. Классификация методов анализа. Требования к методам анализа и к результатам. Анализ веществ проводится для установления количественного и качественного состава веществ. Качественный анализ - позволяет установить, из каких элементов состоит вещество. Количественный – позволяет установить количественное содержание составных частей в анализируемой среде. Методы могут классифицироваться в зависимости от кол-ва анализируемого вещества: Макрометоды, Полумикрометоды Микрометоды Ультрамикрометоды Субмикрометоды (очень важны в медицине, биологии). В зависимости от техники выполнения анализа: Химические - в основе хим. реакция. Физико-химические - о составе анализируемого вещества судят по физ.св-ву продукта (плотность). Физические - судят по физическому свойству. Четкой границы м/у физич. и физич.-хим. р-ции нет, а объединяет их то, что и там и там исследуются св-ва при пом. прибора. 14. Аналитические реакции и реагенты, требования к ним. Способы повышения селективности и чувствительности. Реагент - вещество, вызвавшее аналитическую реакцию. Аналитические реакции могут осуществляться двумя способами: Мокрым - хим. реакция, осуществляемая м/у растворами исследуемого вещества и реагента. Она проводится на фильтр. бумаге, предметном стекле с посследующим рассмотрением формы образовавшихся кристаллов. Сухим - прокаливание, пирохимические реакции. Хим. методы количественного анализа: гравиметрические (весовые), титриметрические (объемные). Требования методов анализа: 1.чувствительность- определение возможно меньших количеств веществ. 2. силективность - из большого кол-ва находящихся в образце метод д/определить одно единственное. 3. экспрессность - время затраченное на анализ должно быть минимальным. 15. Дробный и систематический анализ ионов, групповой реагент. Дробный анализ- обнаружение ионов при помощи специфических растворителей в необходимых порциях исследуемого раствора. Систематический Последовательность обнаружения ионов м/б различной. Если специфические р-ции отсутствуют, обнаружение ионов этим методом невозможно. Разрабатывается опр. последовательность реакций обнаружения отд. ионов. Например, раствор содержит ионы Ca2+ и Ва2+ . Чувствительной реакцией на ионы Са явл. образование осадка Ca2+ +С2О42- →СаС2О4 также и определяют ионы Ва Ва2+ +С2О42- → ВаС2О4 Значит, в присутствии Ва обнаружить Са невозможно. В связи с многообразием ионов их обычно отделяют от раствора не по одиночке, а целыми группами, например, добавление соляной к-ты вызывает осаждение ионов серебра, ртути. Такой реагент наз-т групповым. Требования: 1. ионы должны осаждаться практич.полностью. 2. избыток реагента не должен мешать обнаружению остальных ионов в р-ре. 3. образ-ся осадок должен быть раст-н в кислотах. 16. Подготовка образца к анализу: понятие средней пробы, ее представительность, способы отбора, вскрытие. В ходе анализа можно выделить след. этапы: 1. отбор и усреднение пробы, взятие навески. 2. разложение пробы. 3. разделение опр. компонента. 4. количественное определение. 5. расчет результатов. Иногда в анализе реализуются не все этапы, а некот. из них. Однако в любом случае необходимо отобрать от образца опр. кол-во вещества, таким образом, чтобы рез-т анализа показывал состав всего вещества. Это небольшое кол-во анализируемого вещества, кот. по всем показателям идентично основной массе наз-ся средней пробой. Основное требование к ней представительность, т.е. ее состав д/б идентичен среднему составу исследуемого образца. Сп-бы отбора: если вещество однородно и в жидком и газообр. состоянии, его перемешивают по всему объему и отбирают небольшое кол-во для анализа. твердые сыпучие вещества перемешивают и отбирают среднюю пробу методом «конверта», насыпают и отбирают пробу в указанных точках. в твердых несыпучих веществах образец сверлят равномерно по всему объему и для анализа берут стружку. Вскрытие перевод всех определяемых компонентов в удобное для анализа состояние (1.мокрое - растворение пробы в подходящем растворителе- вода, кислоты, 2.сухое- исп-ся когда подобрать растворитель невозможно -прокаливание). 17. Гравиметрич. метод анализа, сущность, виды. Механизм образования осадка. Условия образования кристалли. и аморфных осадков. Гравметрический м-д анализа - основан на точном измерении массы навески, выделенной либо в чистом виде, либо в виде соединения определенного раствора. Взвешивание произв-ся на аналитич. весах с точностью до 0,0001 гр. Результат анализа проводится с округлением до сотых 0,01 гр. Метод отгонки - определяемую составную часть образца отгоняют накаливанием, нагреванием. А) прямой м-д отгонки Б) косвенный. Методы отгонки является универсальными и имеют ограниченное применение. Метод осаждения - определяемый эл-т переводят в труднорастворимое соединение и по массе образовавшегося осадка расчитывают его содержание, выражая это содержание в % от массы исходного образца. Стадии: I. Растворение -навеску переводят в раствор. II. Осаждение- определяемый компонент осаждают в виде малорастворимого соединения. III. Отделение осадка- отд.осадок от раствора фильтрованием и промывают. IV. Прокаливание- осадок высушивают или прокаливают и точно взвешивают. V. Расчет результата - по массе осадка и его форме рассчитывают содержание в нем компонента и выражают это содержание в %. Вид осадка зависит как от индивидуальных свойств веществ, так и от условий осаждения. Чаще всего работают с аморфными осадками, т.к. кристаллич. не всегда можно получить. 18. Формы осадка, требования к ним и осадителю. На стадии прокаливания многие осадки претерпевают хим. превращение: Осаждаемая форма- то соединение, в виде которого определяемый ион осаждается из раствора. Весовая форма- то соединение, которое взвешивают для получения окончательного результата. Опред. ион соединитель осаждаемая ф-ма весовая ф-ма SO42- + Ba2+ → BaSO4 ↓ → BaSO4 Требования к осаждаемой форме: малая растворимость, крупнокристаллическая структура осадка, возм-ть легко и полностью переходить в весовую форму. Требования к осадителю: специфичность, летучесть. 19. Загрязнение осадка, борьба с загрязнением. Образующийся в анализе осадок практич. всегда является загрязненным, т.е. содержит примеси посторонних веществ. соосаждение. Механизмы протекания соосаждения: адсорбция- осаждение примесей на поверхности формирования осадка. окклюзия- захват примеси внутрь осадка, при его быстрой кристаллизации. изоморфизм- образование смешанных кристаллов. образование хим.осаждений. послеосаждение (1,3,4). Для удаления примесей используют приемы: промывание осадка созревание осадка перекристаллизация 20. Сущность титриметрического метода анализа. Требования к реакциям в титриметрии. Способы фиксирования точки эквивалентности. Титриметрический метод анализа основан на точном измерении объема реагента, затрачиваемого на реакцию с определяемыми ионами. Виды титр. метода анализа: кислотно-основное окислительно-восстановительное комплексо-метрическое осадительное. По способу титрования: прямое, обратное, заместительное. В ходе анализа требуется точно заметить момент наступления эквивалента, или зафиксировать точку эквивалентности. 1 индикаторный - в реакц. смесь + индикатор, кот. в точке экв. меняют цвет. 2 безиндикаторный - если титрант окрашен, то добавляют или его избыток, и появляется неисчезающее окрашивание раствора. В титр. методе реакции должны: протекать быстро, количественно, должна существовать возможность фиксировать точку эквивалентности, должны отсутствовать побочные реакции. 21. Кислотно-основное титрование, сущность метода, виды, область применения. Построение кривых титрования. Относятся методы, в основе которых лежит реакция нейтрализации. Н++ОН-→Н2О Различают: Ацидиметрию - определение оснований, титруя их кислотами. Алкалиметрия - щелочами. Метод исп-ся для определения сильных и слабых кислот и оснований, солей подвергающихся гидролизу. Характеристикой раствора, изменяющегося в ходе кисл.-осн. Титрования, является рН. Кривая, показывающая изменение рН раствора, изменяющаяся в зависимости от раствора прибавленного титранта наз. кривой кислотно-основного титрования. В основе метода лежит скачок рН. 22. Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов. Для фиксирования точки экв-ти в р-р + спец. вещество индикатор. К индикаторам осн.-кисл.титр-я предъявляют след. требования. окраска индикатора д/б интенсивной. окраска индикатора при близких значениях рН д/сильно различаться. изменение окраски д/происходить в узком интервале рН. изменение окраски д/б обратимым. Титр-е предст. собой слабые органические кислоты или основания, у которых неонизированные молекулы и ионы имеют разл. окраску. Изменение окраски инд. происходит не при всяком изменении рН, а лишь внутри опр.интервала значений рН, кот. наз. интервалом перехода индикатора. Середина этого интервала при кот. заканчивается титрование с данным индикатором наз. его показателем титрования. Фенолфталеин 9,0 рТ Лакмус 7,0 рТ Метил.красн. 5,5 рТ Метил.оранж. 4,0 рТ. Показатель титрования д/находится в области скачка на кривой титрования!!! Экстракция – процесс избирательного растворения отдельных компонентов смеси ве-в в каком-либо растворителе. 23. Примеры окислительно-восстановительного титрования: перманганатометрия. Возможности метода, особенности фиксирования точки экв-ти. Для опр-я многих неорганич. и органич. веществ используют перманганат калия. прямой метод титрования - когда р-ция происх. в сильно кислом растворе. косвенное- когда ионы осаждают в виде оксалатов, затем титруют перманганатом связанную с Ме щавелевую к-ту или ее избыток, введенный в раствор при осаждении. Многие органич. вещества так же окисляются перманганатом, но р-ция обычно протекает медленно и используют косвенное титр-е. При титр-ии перм. обычно не используют индикаторы, т.к окраска и так достаточно выражена для установления точки эквивалентности. Преимущества метода: исходные стандартные р-ры перм. окрашены в малиновый цвет, поэтому точку экв. можно определить по цвету - прямым методом, или по бесцветной окраске -косвенным методом. титр-е м/осуществлять в кислой или щелочной среде. перм. является дешевым и доступным реагентом. Недостатки: исх.реагент перм. калия трудно получить в чистом виде. некот. р-ции протекают при комн.темп. медленно. стандартные р-ры перм. не очень устойчивы. 24. Примеры окислительно-восстановительного титрования: иодометрия. Возможности метода, особенности фиксирования точки экв-ти. Иодометрия -метод анализа, при котором о кол-ве определяемого вещества судят по кол-ву поглощенного или выделенного иода. Окислитель -иод, кот. всупает в р-цию с некот. восстановителями. J2+2e↔2J- Определение иодиметрическим методом проводят как прямым, так и обратным титрованием. Кол-во выделившегося иода определяют титрованием его раствором тиосульфата натрия. Очень чувствительным является раствор крахмала. Если к раствору какого-либо восст-ля + раствор иода, то в точке экв. от линии капли иода раствор в присутствии крахмала приобретет неисчезающую синюю окраску. Но при постепенном добавлении восст-ля к раствору иода окраска будет исчезать. В иодометрии нужно иметь рабочий раствор иода для определения восстановителя. 25. Комплексонометрическое титрование, комплексометрическое титр-е. построение кривых титрования, фиксирование точки экв-ти. Комплексонометрическое титрование основано на реакциях комплексообразования. Растворы веществ, способные образовывать комплексные соединения - это титранты. Среди них исп-ся такие комплексообразователи, как J-, Cl-, Cr- и т.д. В кач. титрантов используют растворы комплексонатов (этилен, тетроуксусная к-та и ее соли). комплексон 2 Использование комплексонов в титриметрии выделило этот способ титрования в отд. область комплексометрического титрования - комплексонометрическое титрование. Осн. хар-кой раствора является концентрация ионов Ме в нем. Кривая титрования строится в координатах. Для фиксирования точки экв. исп-ся так наз. металоиндикаторы, кот. Является органич.красителями, образованными ионами Ме. Окрашенные комплексные соединения менее прочны, чем компл-с Ме с комплексоном. Комплексоны не является спец. реагентами, поэтому увеличить силиктивность их действия, т.е. определить ионы в присутствии других, можно лишь с изменением рН раствора. 26. Атомная эмиссионная спектрометрия. Качественный и количественный спектральный анализ. Атомная эмиссионная спектрометрия –физический метод определения хим.состава вещества по его спектру, испускаемому возбуждаемыми атомами. Суть метода: в устройство для ввода пробы + источник возбуждения (пламя горелки). Под воздействием высоких температур растворитель испаряется, а вещество переводится в атомарное состояние, и атомы возбуждаются. Затем атомы возвращаются в исходное состояние, испуская при этом избыточную энергию. Это излучение проходит ч-з диспергирующий элемент, где оно разлагается в спектр, после чего улавливается фотоэлементом. Вид спектра является качественной хар-кой вещества, а интенсивность линий спектра является количественной хар-кой. Т.к число линий атомов в спектре велико, то для аналитич. цепей исп-ся не все линии, а лишь некоторые из них - это так наз. аналитические линии. 27.Атомно-абсорбционная спектрометрия, сущность метода. Метод основан на поглощении лучей атомами в газовой фазе, образующийся в пламени, при распылении в нем исследуемого раствора. Метод предполагает создание слоя поглощающего атомного пара, пропускание пучка лучей ч-з слой, разложение прошедшего потока в спектр и измерение оптич. плотности. Концентрацию Эл-та м/находить по методу градуированного графика. 28. Понятие о других спектральных методах анализа: люминесцентный, рефрактрометрический. Люминесцентный. В опр.условиях поглощенная атомами энергия м/выделяться в виде лучистой энергии. Люминесцентное свечение м/б вызвано действием разл. видов энергии. Свечение вещества м/происходить под влиянием бомбардировки его потоком электронов- катодными лучами. Такое свечение наз-ся катодо-люминисценцией, оно исп-ся в лампах дневного света. Под влиянием энергии хим.реакции м/происходить свечение, называемое химиялюминисценцией. Свечение м/б вызвано поглощением лучистой энергии- фотолюминисценция. По хар-ру люминисцентного свечения различают фосфоросценцию (свеч.продолжающееся после удаления источника свечения) и фиуоросценцию (свеч.прекращающееся сразу же после удаления источника возбуждения свечения). Все эти виды свечения схожи по своей природе и объединяются общим понятием – люминисценция. Рефрактометрический основан на определении показателя (коэф-та) преломления исследуемого вещества. Если луч света переходит из одной среды в другую, то он частично отражается от поверхности раздела, а частично преломляется. Показателем преломления наз-т отношение sin угол падения луча света к sin угла его преломления. 29. Электрохимические методы анализа, обзор, краткая хар-ка. Основаны на взаимодействии вещества с эл. током. электровесовой- определяемый эл-т выделяют электролизом. Хар-ся высокой точностью, применяется для определения компонентов сплавов. Недостаток-энергоемкость, непродолжительность по времени. кулонометрический - основан на измерении кол-ва электричества, затраченного на р-цию с определяемым ионом. Расчеты ведутся по з-ну Фарадея. кондуктометрический- основан на измерении электропроводности исследуемого раствора. ЭС-электропроводность опр-ся суммарным соединением всех ионов. потенциометрический полярографический амперометрическое титрование - в кач. индикаторного электрода исп-ся полярографич.устр-во. 30. Потенциометрический метод. Измерения проводят в так наз.эл.хим.ячейке, это система из 2х электродов, погруженных в исследуемый раствор и соединенных с измерительным прибором. По роли в анализе электроды: индикаторный - электрод, потенциал которого зависит от концентрации определяемых ионов в исследуемом растворе. Исп-ся в кач. электрода стеклянный, металлический э-д. Ур-е Нернста: электрод сравнения -потенциал его постоянен, независимо от протекания какой-либо р-ции в растворе . 31. Потенциометрический м-д анализа: прямая потенциометрия и потенциометрическое титрование. 1. прямая потенциометрия -измеряют ЭДС гальв. элемента и по ур-ю Нернста рассчитывают концентрацию определяемых ионов. 2. потенциометрическое титрование- исследуемый раствор титруют подходящим элементом, одновременно следя за изменением потенциала электрода. Положение точки экв. опр-ся графически. Для получения более точных рез-тов исп-т дифференциальную кривую или метод Грана. В случае прямых потенциаметрич. измерений исп-ся след. способы расчета концентрации: 1. м-д градуированного графика 2. метод прямых расчетов (ур-е Нернста) 3. метод добавок. 32. Полярографический метод. Сущность, схема прибора. Основан на использовании концентрационной поляризации, возникающей в процессе электролиза, на электроде с малой поверхностью. В кач.такого исп-ся ртутный капающий электрод. Капля ртути, вытекающая из капиляра с опр.периодичностью, анодом при этом служит слой ртути на дне полярогорафич. ячейки. Ток от внешнего источника идет на реохорд (R) , при пом. (R) на ячейку плавно подается напряжение. Пока напряжение невелико, то и потенциал не большой, и восстановление ионов на катоде не происходит. Ток ч-з ячейку практич. не идет (участок 1) При пост. увеличении напряжения потенциал катода тоже увелич-ся, и достигает значения достаточного для восстановления ионов из раствора сила тока проходящая ч-з раствор резко возрастает (участок 2). Далее при увеличении напряжения достигается такое значение потенциала катода, при котором все ионы успевают разрядиться (участок 3). Величина тока, протекающая ч-з раствор достигает предельного значения и наз-ся диффузионным предельным током. Т.о. зависимость напряжения имеет вид ступеньки или полярографической волны. Если в растворе присутств. неск. ионов, способных восстанавливаться при разл. значениях потенциала, то кол-во ступенек на полярограмме возрастает. Ур-е полярографич. волны: 33. Полярографическая волна, качественный и количественный полярографич. анализ. Ур-е полярографич.волны: Величина, приложенного к ячейке напряжения связана силой, проходящей ч-з раствор тока описывается уравнением полярографич. волны. где, Е1/2 так называемы потенциал полуволны, является качественной характеристикой иона. Это то значение потенциала, при котором сила тока, протекающего ч-з раствор достигает половины величины Jдиф. (диффузионной силы тока). Количественной хар-кой является высота полярографической волны, или величина предельного Jдиф., которая прямо пропорциональна концентрации ионов. 34. Экстракция – сущность метода, количественные хар-ки. Экстракция процесс распределения растворенного вещества между двумя несмешивающимися жидкими фазами и основанное на этом выделение и разделение веществ. Процесс экстракции характеризуют следующими основными величинами; константа экстракции, константа распределения Р, коэффициент распределения Е, степень извлечения R, фактор разделения S. Разделение веществ методом экстракции основано на различной растворимости их в несмешивающихся растворителях. Если какое-либо вещество способно растворяться в двух несмешивающихся растворителях, например в воде и в каком-нибудь органическом растворителе, то оно распределяется между этими двумя растворителями и устанавливается равновесие: Авода↔Ар-тель По закону распределения, если распределяемое вещество в обеих фазах находится в одной и той же форме, то концентрации его в этих фазах связаны зависимостью: [Ар-тель]/[ Авода] = E где Е - коэффициент распределения. Коэффициент распределения зависят от температуры, свойств вещества и свойств фаз. Зависимость коэффициента распределения от температуры может быть самой разнообразной. В одних случаях с повышением температуры коэффициент распределения увеличивается — экстрагирование улучшается, в других коэффициент распределения уменьшается — экстрагирование ухудшается. Метод экстр. очень прост и эффективен. В делительной воронке встряхивают исследуемы раствор с органическим растворителем и после расслоения жидкостей выливают их последовательно из воронки. С пом. этого метода можно извлекать вещества из очень разбавленных растворов. 35. Хроматография –теоретич. основы, классификация методов. Хроматография - это физико-химический метод разделения и анализа смесей газов, паров, жидкостей или растворенных веществ сорбционными методами в динамических условиях. Метод основан на различном распределении веществ между двумя несмешивающимися фазами - подвижной и неподвижной. Подвижной фазой может быть жидкость или газ, неподвижной фазой - твердое вещество, которое называют носителем. Таким, образом, хроматографию можно определить как процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента. Хроматографический метод анализа разработан русским ботаником М.С.Цветом в 1903 г. С помощью этого метода он разделил хлорофилл растений на неск. веществ. Различные методы хроматографии можно классифицировать: По агрегатному состоянию фаз различают жидкостную и газовую хроматографию. Разделение веществ протекает по разному механизму, в зависимости от природы сорбента и веществ анализируемой смеси. По механизму взаимодействия вещества и сорбента различают сорбционные методы, основанные на законах распределения (адсорбционная, распределительная, ионообменная хроматография и др.), гельфильтрационные (проникающая хроматография), основанные на различии в размерах молекул разделяемых веществ. По технике выполнения хроматографию подразделяют на колоночную, когда разделение веществ проводится в специальных колонках, и плоскостную: тонкослойную и бумажную. В тонкослойной хроматографии разделение проводится в тонком слое сорбента, в бумажной - на специальной бумаге. В соответствии с режимом ввода пробы в хроматографическую систему различают фронтальную, элюентную и вытеснительную хроматографию. В вытеснительном методе после введения пробы и предварительного разделения слабоактивным элюентом состав элюента меняется таким образом, что он взаимодействует с неподвижной фазой (НФ) каждого из компонентов анализируемой смеси. Вследствие этого новый элюент вытесняет компоненты, которые выходят из колонки в порядке возрастания взаимодействия с НФ. В этом методе не достигается достаточно полное разделение из-за частичного перекрывания зон. Наибольшее распространение получил элюентный режим хроматографирования, позволяющий получать в чистом виде все компоненты пробы 36. Другие виды хроматографии. В газовой хроматографии (ГХ) в качестве ПФ используют инертный газ (азот, гелий, водород), называемый газом-носителем. Пробу подают в виде паров, неподвижной фазой служит или твердое вещество - сорбент (газо-адсорбционная хроматография) или высококипящая жидкость, нанесенная тонким слоем на твердый носитель (газожидкостная хроматография). Ионообменная хроматография (ИХ) является разновидностью жидкостной хроматографии и в аппаратурном оформлении ничем не отличается от других видов жидкостной колоночной хроматографии. В основе ионообменной хроматографии лежит процесс обмена между ионами анализируемого раствора (ПФ) и подвижными ионами того же знака ионообменника (НФ). В качестве ионообменников или ионитов обычно используют синтетические полимерные вещества, называемые ионообменными смолами. Они состоят из матрицы (R) и активных групп, содержащих подвижные ионы. Ионообменную хроматографию применяют для разделения фенолов, карбоновых кислот, оснований. Часто иониты используют для предварительного разделения сложных смесей на менее сложные. На ионном обмене основано получение ионитного молока для детского питания. Ионный обмен используют для очистки натуральных соков от ионов тяжелых металлов. Ионообменные смолы применяют для получения ионообменных мембран. Гельпроникающая хроматография (ГПХ) представляет собой метод разделения молекул, основанный на различии из размеров. В качестве НФ в ГПХ используют частицы, имеющие определенные размеры пор. Это различного рода гели (мягкие, полужесткие и жесткие). В качестве ПФ служат водные или органические элюенты. Т. о. при помощи ГПХ можно разделить смеси веществ в зависимости от размеров их молекул. Так можно разделить полипептиды, белки и другие макромолекулы. Гельпроникающая хроматография на колонке используется для очистки пестицидов, а также жирорастворимых витаминов перед их определением методом ВЖХ По механизму разделения различают распределительную, адсорбционную, осадочную и другие виды бумажной хроматографии (БХ). В распределительной жидкость - жидкостной хроматографии бумага, приготовленная из специальных сортов хлопка, выполняет роль носителя неподвижной жидкой фазы (НФ), в качестве которой часто выступает вода, адсорбированная парами бумаги. В таком случае гидрофильная бумага используется для нормально-фазовой хроматографии. Растворителями (ПФ) являются спирты (метанол, этанол, н-пропанол, бутанол), простые эфиры (этиловый, метиловый), кетоны (ацетон, ацетил-ацетон), эфиры органических кислот (метилацетат, этилацетат), пиридин, хлороформ. Чаще используются смеси растворителей Тонкослойная хроматография (ТСХ) является одним из наиболее простых и эффективных экспресс -методов разделения и анализа веществ в пищевых продуктах, биологических жидкостях и других объектах, не требующих сложного оборудования. В то же время метод обладает высокой избирательностью и чувствительностью (низким пределом обнаружения). Этим методом можно определить 10-20 мкг вещества с точностью до 5-7%. В зависимости от природы НФ тонкослойная хроматография может быть адсорбционной и распределительной. Наиболее широко применим в ТСХ первый вариант разделения. Хроматографическое разделение смеси на колонке вследствие медленного продвижения ПФ занимает много времени. Для ускорения процесса хроматографирование проводят под давлением. Этот метод называют высокоэффективной жидкостной хроматографией (ВЖХ) Модернизация аппаратуры, применяемой в классической жидкостной колоночной хроматографии, сделала ее одним из перспективных и современных методов анализа. Высокоэффективная жидкостная хроматография является удобным способом разделения, препаративного выделения и проведения качественного и количественного анализа нелетучих термолабильных соединений как с малой, так с большой молекулярной массой. |
