Химия1. Курс Лекций по дисциплине Химия и инженерная экология
 Скачать 1.01 Mb. Скачать 1.01 Mb.
|
Свойства Т.М.Лекция 2. ХИМИЧЕСКАЯ КИНЕТИКАСкорость химической реакции показывает изменение количества одного из веществ в реакции в единицу времени. При расчете скорости реакции необходимо учитывать условия ее протекания, а именно, идет ли реакция в объеме реакционной системы, как в случае гомогенных реакций или на границе раздела фаз,в случае гетерогенных реакций. Напомним: Гомогенные реакции – реакции между веществами, находящимися в одинаковых фазовых состояниях, за исключением твердых. Например: N2(г) + 3H2(г) = 2NH3 BaCl2(ж) + Na2SO4(ж)= BaSO4↓ + 2NaCl Гетерогенные реакции – реакции между веществами, находящимися в разных агрегатных состояниях. Например: Zn(т)+ H2SO4(ж) = ZnSO4 + H2↑ Расчет скорости для этих типов реакций осуществляют по формулам: для гомогенной реакции: 𝒗гом = ±∆𝒏/𝑽∆𝒕 или 𝒗гом = ±∆𝒄/∆𝒕 для гетерогенной реакции: 𝒗гет = ±∆𝒏/𝑺∆𝒕 в этих формулах: Δn – изменение количества одного из веществ в реакции, моль; ∆t – промежуток времени реакции, с; ∆c = ∆n/V – изменение концентрации реагирующего вещества, моль/л; V–объем реакционной системы, л либо м3; S–поверхность соприкосновения фаз, м2. Знак «–» в формулах используется в случае, если расчет ведут по концентрациям исходных веществ, которые уменьшаются в ходе реакции, а знак «+» в случае, если рассматриваются концентрации продуктов реакции, которые увеличиваются в ходе реакции (скорость реакции всегда положительна). В системе СИ единицами измерения скорости реакции являются: (для гетерогенных реакций). Химические реакции бывают простые и сложные. Простая реакция – реакция, протекающая в одну стадию, элементарный акт взаимодействия частиц. В элементарной реакции может участвовать либо одна частица (реакция распада), либо две,либо (очень редко) три частицы. Т.е. в простой реакции одновременно могут участвовать не более трех частиц. Число частиц, участвующих в элементарном акте реакции, называется молекулярностью. Реакции бывают мономолекулярными, бимолекулярными и тримолекулярными. Примеры простых реакций: J2 2J мономолекулярная 2СН3 С2Н6 бимолекулярная 2NO + O2 2NO2 тримолекулярная Сложная реакция включает в себя несколько различных стадий, приводящих к конечным продуктам. Сложные реакции бывают параллельными (одновременно идет несколько реакций) или последовательными (через образование промежуточных продуктов). Простые реакции встречаются достаточно редко. Чаще реакции бывают сложными, и символизирующие их уравнения отражают лишь конечный итог химических превращений. Скорость химических реакций зависит от: природы реагирующих веществ концентрации реагирующих веществ давления (в газовых реакциях) температуры катализатора от среды (для реакций в растворе) от площади поверхности соприкосновения (для гетерогенных реакций) Рассмотрим подробнее зависимость скорости реакции от концентрации реагирующих веществ, температуры проведения реакции и участия в ней катализатора. Влияние концентрации реагирующих веществ на скорость реакции В 1867 г. К. Гульдбергом и П. Вааге был сформулирован закон действующих масс (ЗДМ): Скорость простой химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам (коэффициентам в уравнении реакции). Для реакции аА + bB =} cC + dD, протекающей в одну стадию, математическое выражение ЗДМ примет вид: 𝑣 = 𝑘[𝐴]𝑎[𝐵]𝑏 здесь k – константа скорости реакции; [А], [B] – концентрации реагирующих веществ; а, b – коэффициенты в уравнении реакции. Константа скорости k зависит от температуры и природы реагирующих веществ. Физический смысл константы скорости: она равна скорости реакции, если концентрации реагирующих веществ – 1 моль/л. В том случае, когда одно из реагирующих веществ находится в твердом агрегатном состоянии (т.е. реакция гетерогенная), концентрация этого твердого вещества не учитывается в уравнении ЗДМ. Закон действующих масс для: г  омогенной реакции: гетерогенной реакции: Подчеркнем, что ЗДМ выполняется только для простых реакций. Для сложных реакций зависимость скорости от концентрации реагирующих веществ приобретает вид: 𝑣 = 𝑘[𝐴]а[𝐵]b где числа m, n – так называемые порядки реакции по веществу А и В. Порядок реакции определяют экспериментальным путем. Влияние температуры на скорость реакции Это влияние изучалось Вант-Гоффом, в результате чего опытным путем найдено приближенное правило (правило Вант-Гоффа): При повышении температуры на 10 ℃ скорость большинства реакций увеличивается в 2-4 раза. При температурах близких к комнатным это влияние достаточно точно описывается уравнением: где: υТн, ʋТк – скорости реакции соответственно при начальной (Тн) и конечной (Тк) температурах; γ – температурный коэффициент реакции (табличная или экспериментально найденная величина). Температурный коэффициент имеет значения от 2 до 4. Увеличение скорости реакции с ростом температуры объясняется большой скоростью движения частиц реагирующих веществ и их эффективными столкновениями за счет получения дополнительной тепловой энергии. Более точную зависимость константы скорости от температуры п ередает уравнение Аррениуса (1889 г.): где: k – константа скорости реакции; 29 A – предэкспоненциальный множитель; Еа – энергия активации реакции, Дж/моль; е – основание натуральных логарифмов, равное 2,718; R – универсальная газовая постоянная, 8,314 Дж/моль∙К; Т – температура в К. Химическая реакция осуществляется при столкновении молекул реагентов. Аррениус высказал предположение, что не каждое столкновение приводит к образованию продуктов реакции. Чтобы реакция осуществилась (столкновение стало эффективным), молекулы должны обладать повышенной энергией. Тот избыток энергии, которым должны обладать молекулы, чтобы их столкновение приводило к реакции, называется энергией активации (Еа). Другими словами, энергия активации – энергетический барьер, который должны преодолеть молекулы реагентов, чтобы осуществилась химическая реакция. У равнение Аррениуса в логарифмической форме имеет вид: Запишем уравнение Аррениуса для двух температур: 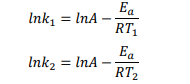 Вычитая из второго уравнения первое, получим: По этому уравнению, зная Еа, можно рассчитать, как изменится скорость реакции при изменении температуры. Влияние катализатора на скорость реакции Катализаторы – вещества, ускоряющие химические реакции. При этом катализаторы после реакции остаются в неизменном виде. Катализ – изменение скорости реакции под воздействием катализаторов. Различают гомогенный катализ, если катализатор и реагенты находятся в одинаковом фазовом состоянии и гетерогенный катализ, если катализатор и вещества находятся в разных фазах. Механизм действия катализатора основан на том, что он направляет реакцию по другому пути, имеющему меньшую энергию активации. Например, для реакции взаимодействия веществ А и В энергия активации равна Еа:  А + В АВ (Еа) А + В АВ (Еа)Катализатор взаимодействует с одним из реагентов с образованием промежуточного соединения АК, энергия активации этой реакции меньше:  А + К АК (Еа’ < Еа) А + К АК (Еа’ < Еа)Полученный комплекс АК вступает в реакцию со вторым реагентом, при этом образуется продукт и выделяется катализатор в неизменном виде:  АК + В АВ + К (Еа” < Еа) АК + В АВ + К (Еа” < Еа)Обе промежуточные стадии каталитической реакции имеют энергию активации существенно меньшую, чем энергия активации реакции без у 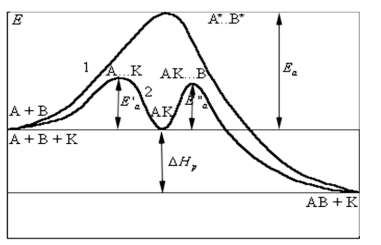 частия катализатора (рис. 4). Рис. 4. Энергетическая диаграмма некаталитической (линия 1) и каталитической реакций (линия 2). Используя уравнение Аррениуса для каталитической и некаталитической реакции и принимая, что величины предэкспоненциальных множителей для э тих реакций одинаковы, получим уравнение: где ∆Еа = Еа–Еакат – разница между энергией активации исходной реакции Еа и энергией активации каталитической реакции Еакат. Химическое равновесие Основные понятия химической кинетики Химическая кинетика - раздел физической химии, изучающий скорости и механизмы протекания химических реакций. Основные задачи химической кинетики: расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); определение механизмов реакций по кинетическим кривым (обратная задача). Химической реакцией можно считать любое изменение вещества, в ходе которого образуются или разрываются химические связи. Различают простые и сложные реакции. Простые реакции протекают в одну стадию. Их стехиометрическое уравнение правильно отражает реальный ход реакции. Известный пример – реакция образования йодоводорода: Сложные реакции протекают в несколько стадий. Стехиометрическое уравнение не отражает реального хода процесса и является отражением суммарного результата нескольких стадий. Например, реакция между пероксидом водорода и йодоводородом протекает в две стадии: Первая стадия: Вторая стадия: Суммарное уравнение: Большинство химических реакций являются сложными. Совокупность стадий, из которых складывается химическая реакция, называется механизмом химической реакции. Каждая отдельная стадия называется элементарным актом реакции. Скорость химической реакции Скорость реакции (v) – это изменение концентрации реагирующих веществ в единицу времени. Если концентрацию выражать в молях на литр, а время в секундах, то размерность скорости будет моль/(л*сек). Различают среднюю и истинную скорость реакции. Средняя скорость реакции  Средней скоростью реакции (v) называют отношение изменения концентрации реагирующих веществ (C2-C1) к промежутку времени (t2-t1), в течение которого это превращение произошло. 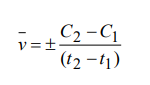 Истинная скорость реакции Истинной скоростью реакции называют изменение концентрации реагирующего вещества за бесконечно малый промежуток времени. Скорость реакции – всегда положительная величина. Знак минус перед dC dt означает, что концентрация исходного вещества в процессе реакции уменьшается. В общем случае, для реакции скорость реакции определяется следующим образом: В частном случае, для реакции  1A+2B 3C +2D Получаем Основной постулат химической кинетики Скорость химической реакции зависит от многих факторов: концентрации, природы реагирующих веществ, давления (для газов), температуры и даже формы реакционного сосуда. Зависимость скорости реакции от концентрации реагирующих веществ описывается основным постулатом химической кинетики: скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях: Например, для реакции aA + bB + dD....> Продукты имеем следующее уравнение 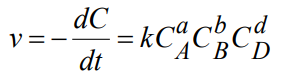 Это уравнение называется уравнением скорости химической реакции или кинетическим уравнением. Коэффициент пропорциональности k называют константой скорости реакции. При концентрациях реагирующих веществ, равных 1, скорость реакции равна величине константы скорости реакции. Константа скорости реакции не зависит от концентрации и характеризует влияние природы реагирующих веществ на скорость их взаимодействия друг с другом. Константа скорости реакции является мерой реакционной способности молекул. Влияние температуры на скорость химической реакции Правило Вант-Гоффа: В 1884 г. Вант-Гофф установил, что скорость почти всех химических реакций возрастает с повышением температуры в 2-4 раза на каждые 10 градусов. Математически эта зависимость выражается соотношением: Где v2 и v1 - скорости реакций при температурах T2 и T1, - это температурный коэффициент реакции. Для большинства реакций он лежит в пределах от 2 до 4. Коэффициент (гамма )показывает, во сколько раз увеличится скорость реакции при повышении температуры на каждые десять градусов. Теория активных столкновений Более точную зависимость константы скорость реакции от температуры дает теория активных столкновений С. Аррениуса (Сва́нте А́вгуст Арре́ниус), предложенная в 1889 г. В основе этой теории лежит представление, что для протекания реакции необходимо соударение между молекулами исходных веществ. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение. Активные соударения – это соударения, которые происходят между молекулами A и B с большим запасом энергии (Рис. 5). Тот минимальный запас энергии, которым должны обладать исходных веществ, чтобы их соударение было активным, называется энергетическим барьером реакции. 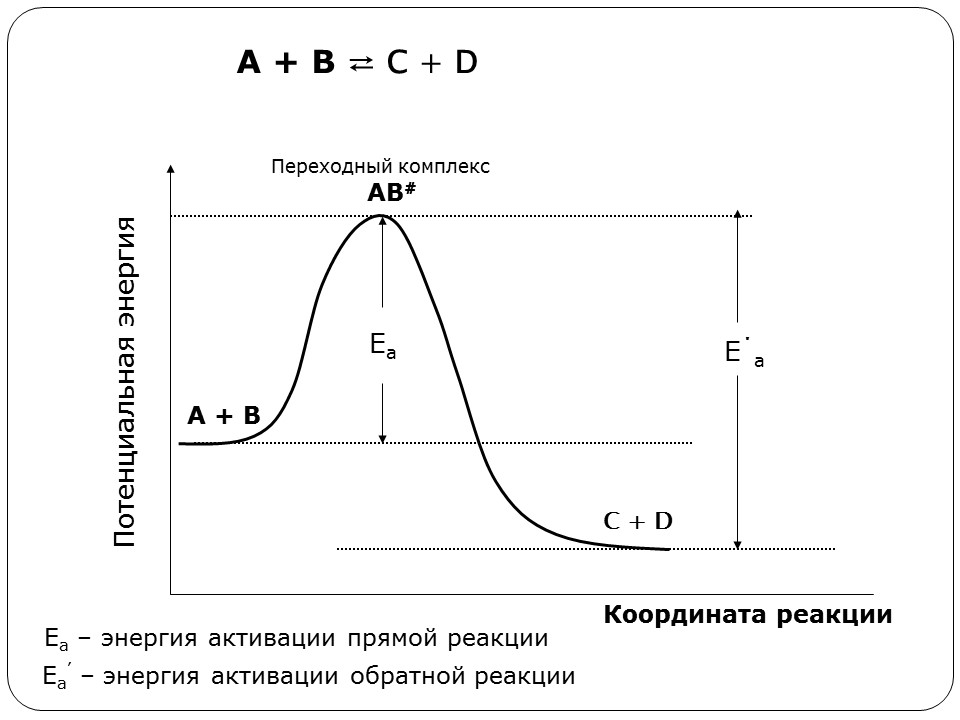 Рис. 5. Энергетическая диаграмма реакции A + B = C + D Ea – энергия активации. Ее можно охарактеризовать как некоторую пороговую энергию: если энергия сталкивающихся частиц меньше Ea, то при столкновении реакция не произойдет, если энергия превышает величину Ea, реакция протекает успешно. Уравнение Аррениуса (экспоненциальная форма): Константа скорости реакции связана с энергией активации (Ea) экспоненциальной зависимостью: 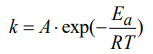 Где А – предэспоненциальный множитель, R – универсальная газовая постоянная (8.314 Дж/моль*К), Т – абсолютная температура (К). Экспоненциальный множитель характеризует долю активных соударений от общего числа соударений. Уравнение Аррениуса (линейная форма): Количественно (предэкспоненциальный) множитель и энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнение Аррениуса записывают в логарифмической (линейной) форме: 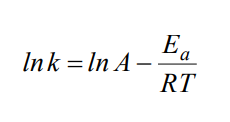 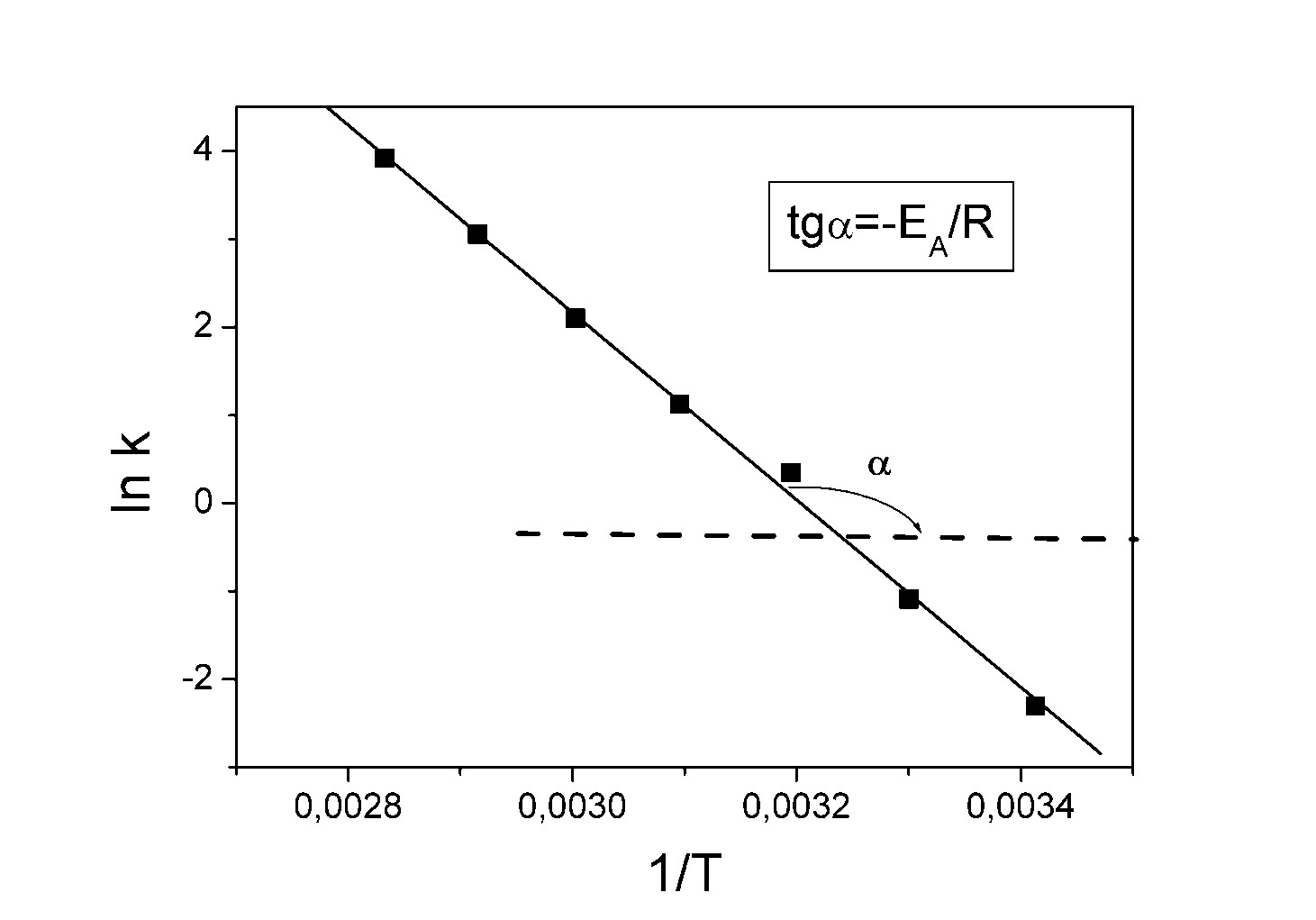 Рис. 6. Зависимость lnk от обратной температуры 1/Т. Аналитическое определение энергии активации Энергию активации можно также вычислить аналитическим путем, если известны значения константы скорости при двух температурах: 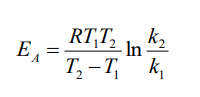 Катализ. Гомогенный, гетерогенный и ферментативный катализ. Катализ — изменение скорости реакции под действием особых веществ, которые участвуют в реакции, но в результате ее не расходуются. Эти вещества называются катализаторами. Катализатор не влияет на константу химического равновесия. Он только ускоряет достижение химического равновесия. Катализатор одинаково влияет на константу скорости прямой реакции и на константу скорости обратной реакции. Катализатор ведет реакцию по пути с меньшей энергией активации ЕА. Другими словами, катализатор увеличивает скорость реакции, т. к. уменьшается ЕА. Различают гомогенный и гетерогенный катализ. Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Согласно этой теории, катализатор образует с реагентами промежуточные соединения, которые уменьшают энергию активации реакции. Например, реакция 2SO2 + О2 → 2SО3 в присутствии оксида азота (II) может происходить по схеме: 2NO + О2 → 2NO2 (промежуточное соединение) NO2 + SO2 → SO3 + NO Как видно из схемы, в суммарное уравнение реакции катализатор NO не входит, т. е. в результате реакции он не изменяется. 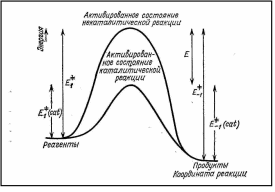 Рис. 7. Схематическое изображение влияние катализатора на энергию активации прямой и обратной реакции. В случае гетерогенного катализа катализатор и реагенты находятся в разных фазах и имеют границу раздела. На поверхности твердого катализатора (т.е. на поверхности раздела фаз) реагируют газообразные или жидкие вещества. Механизм каталитических гетерогенных реакций очень сложен и зависит от природы реакции. Вначале на активных центрах поверхности гетерогенного катализатора происходит процесс хемосорбции молекул исходных веществ, в результате чего происходит: (a) локальное увеличение концентрации молекул исходных веществ на активных центрах; (б) ослабление химических связей в молекулах исходных веществ, что заставляет их распадаться до атомов, которые реагируют друг с другом и образуют молекулу нового вещества, которое покидает поверхность катализатора. К каталитическим гетерогенным реакциям относятся известные реакции получения аммиака и оксида серы (IV). N2 + 3H2 (Fe, 500 оC)⎯→2NH3 2SO2 + O2 (V2O5, P,T)⎯→ 2SO3 Лекция 3. Растворы Растворы – гомогенные системы, состоящие из двух или нескольких компонентов. Раствор состоит из растворителя и растворенного вещества. Растворенное вещество (оно может быть газообразным, жидким или твердым) в виде атомов, молекул или ионов равномерно распределено в растворителе. В качестве растворителя может быть использована вода, а также органические вещества – спирт, эфир, бензол, хлороформ и т.д. В данном пособии рассматриваются водные растворы веществ. Раствор образуется при переходе вещества из индивидуального состояния в раствор. Растворение – сложный физико-химический процесс. При растворении происходит разрушение структуры вещества за счет разрыва связей в кристаллической решетке, а также распределение частиц растворенного вещества между молекулами растворителя – диффузия. Это физические процессы. Кроме того, между растворителем и растворенным веществом осуществляется химическое взаимодействие, которое заключается в образовании химической связи между частицами вещества и растворителя. Этот процесс носит название сольватация, а продукты процесса называют сольватами. В случае, если растворителем является вода, данный процесс называется гидратацией, а продукты – гидратами. При сольватации происходит изменение свойств растворенных веществ. Так, например, безводный сульфат меди бесцветен, а раствор имеет голубую окраску, так как при растворении в воде образуется гидратированный ион Cu2+∙4H2O голубого цвета. Обычно гидраты – соединения менее прочные, чем обычные химические вещества. Однако, иногда вода так прочно связывается с растворенным веществом, что при кристаллизации входит в состав твердой фазы. Образуются кристаллогидраты – соли, содержащие кристаллизационную воду, например, CuSO4∙5H2O, Na2SO4∙10H2O, Na2CO3∙10H2O. На разрыв связей в кристаллической решетке требуется затратить энергию, поэтому в физическом процессе происходит поглощение тепла (∆Н1 > 0). Химический процесс образования гидратов предполагает формирование новых связей, идет с выделением тепла, т.е. ∆Н2 < 0. Тепловой эффект растворения ∆Н является алгебраической суммой тепловых эффектов: ∆Н = ∆Н1 + ∆Н2. Суммарный эффект может быть эндотермическим, если на разрушение кристаллической решетки расходуется тепла больше, чем выделяется при гидратации, либо экзотермическим, если тепловой эффект гидратации преобладает. Например, энтальпия растворения нитрата аммония ∆Н = 25,7 кДж/моль (поглощение тепла), а серной кислоты ∆Н = -96,8 кДж/моль (выделение тепла). Помимо тепловых эффектов при растворении могут наблюдаться объемные эффекты. Например, при растворении спирта в воде объем полученного раствора заметно уменьшается. Объемные эффекты при растворении объясняются образованием сольватов. При растворении веществ образуются насыщенные, ненасыщенныеи пересыщенные растворы. Раствор, в котором данное вещество при данной температуре и давлении больше не растворяется, т.е. раствор, содержащий максимально возможное количество растворенного вещества, называют насыщенным, а раствор, в котором можно растворить добавочное количество вещества − ненасыщенным. Растворение любого вещества является самопроизвольным процессом, характеризующимся ∆G < 0. При достижении предельной растворимости вещества, т.е. в момент насыщения растворителя растворенным веществом ∆G = 0, и процесс дальнейшего растворения завершается. Пересыщенный раствор содержит при данных условиях больше растворенного вещества, чем в насыщенном растворе. При этом избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре. Пересыщенный раствор находится в состоянии неустойчивого равновесия и характеризуется ∆G > 0. Рассмотрим, как зависит процесс растворения газов, жидких и твердых веществ от внешних условий (T и p).Растворение газов в жидкостях. При растворении газов в жидкостях происходит выделение теплоты (∆Н < 0) за счет сольватации молекул газа и уменьшение энтропии (∆S < 0) за счет перехода из газовой фазы в жидкую. Поэтому из уравнения: ∆G = ∆Н – Т∆S (1) следует, что растворению газов способствуют низкие температуры. При растворении газов существенно уменьшается объем системы (∆V < 0). Исходя из этого и руководствуясь принципом Ле-Шателье, можно сделать вывод: растворение газов увеличивается при снижении температуры и повышении давления. Растворение жидкостей в жидкостях. Растворение жидкости характеризуется ∆Н < 0 и ∆S = 0, а также незначительным изменением объема системы. Поэтому можно заключить, что растворимость жидкости в жидкости увеличивается при повышении температуры растворения, но не зависит от давления. Растворение твердых веществ в жидкостях. Растворение кристаллических веществ чаще всего идет с поглощением тепла (∆Н > 0) и повышением энтропии (∆S > 0). Поэтому, согласно уравнению (1), растворение кристаллических веществ увеличивается с повышением температуры и не зависит от давления. Свойства растворов Все вещества по способности проводить электрический ток в водном растворе или расплаве делятся на электролиты и неэлектролиты. Неэлектролиты – вещества, водные растворы или расплавы которых не проводят ток. Например, углеводы, спирты, амины. В молекулах неэлектролитов присутствуют неполярные или малополярные связи. Электролиты – вещества, растворы или расплавы которых проводят электрический ток. К ним относятся кислоты, основания, соли. В молекулах таких веществ присутствуют полярные связи. Проводимость растворов электролитов связана с тем, что в их растворах осуществляется диссоциация молекул на ионы. Коллигативные свойства растворов неэлектролитов. Свойства растворов рассматривают на примере разбавленных растворов, при образовании которых тепловой и объемный эффекты равны нулю (идеальные растворы). В идеальных растворах частицы находятся на большом расстоянии друг от друга и силами взаимного влияния можно пренебречь. Приближением к идеальным растворам можно считать разбавленные растворы неэлектролитов. Такие растворы будут обладать общими свойстствами, которые не зависят от природы растворенного вещества, а зависят только от концентрации вещества в растворе. Эти свойства называются коллигативными. Рассмотрим следующие свойства растворов: 1) понижение давления насыщенного пара растворителя над раствором; 2) повышение температуры кипения раствора; 3) понижение температуры замерзания раствора; 4) повышение осмотического давления. Способы выражения концентрации растворов |
