Химия1. Курс Лекций по дисциплине Химия и инженерная экология
 Скачать 1.01 Mb. Скачать 1.01 Mb.
|
Основные классы неорганических веществК важнейшим классам неорганических веществ по традиции относят простые вещества (металлы и неметаллы), оксиды (кислотные, основные и амфотерные), гидроксиды (часть кислот, основания, амфотерные гидроксиды) и соли. Вещества, относящиеся к одному и тому же классу, обладают сходными химическими свойствами. Но вы уже знаете, что при выделении этих классов используют разные классификационные признаки. В этом параграфе мы окончательно сформулируем определения всех важнейших классов химических веществ и разберемся, по каким признакам выделяются эти классы. Начнем с простых веществ (классификация по числу элементов, входящих в состав вещества). Их обычно делят на металлы и неметаллы (рис. 13.1-а). Определение понятия " металл" вы уже знаете.
Из этого определения видно, что главным признаком, позволяющим нам разделить простые вещества на металлы и неметаллы, является тип химической связи. 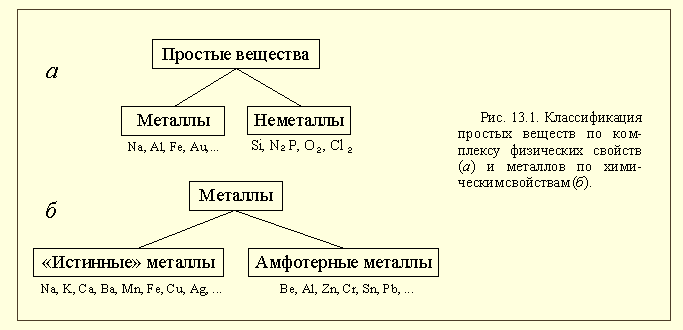
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов. Это название отражает способность этих металлов реагировать как с кислотами, так и со щелочами (как амфотерные оксиды или гидроксиды) (рис. 13.1-б). Кроме этого, из-за химической инертности среди металлов выделяют благородные металлы. К ним относят золото, рутений, родий, палладий, осмий, иридий, платину. По традиции к благородным металлам относят и несколько более реакционно-способное серебро, но не относят такие инертные металлы, как тантал, ниобий и некоторые другие. Есть и другие классификации металлов, например, в металлургии все металлы делят на черные и цветные, относя к черным металлам железо и его сплавы. Из сложных веществ наибольшее значение имеют, прежде всего, оксиды (см.§2.5), но так как в их классификации учитываются кислотно-основные свойства этих соединений, мы сначала вспомним, что такое кислоты и основания. Кислоты – сложные вещества, содержащие в своем составе ионы оксония или при взаимодействии с водой образующие в качестве катионов только эти ионы. Основания – сложные вещества, содержащие в своем составе гидроксид-ионы или при взаимодействии с водой образующие в качестве анионов только эти ионы. \ 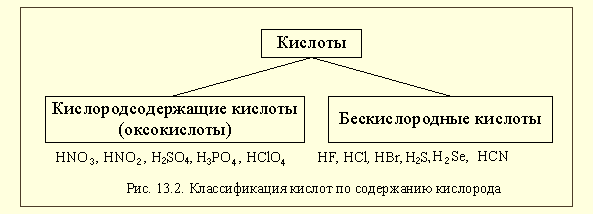 Кислородсодержащие кислоты (оксокислоты) – кислоты, в состав которых входят атомы кислорода. Бескислородные кислоты – кислоты, молекулы которых не содержат кислорода. Оксиды Оксиды – это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2. 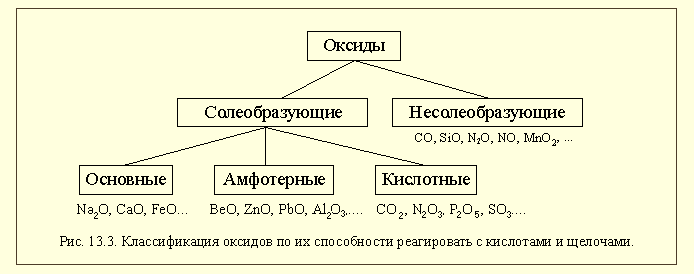 Основные оксиды – оксиды, способные реагировать с кислотами и не способные реагировать со щелочами. Кислотные оксиды – оксиды, способные реагировать со щелочами и не способные реагировать с кислотами. Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами. Гидроксиды Гидроксидами называются сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими гидроксогруппами. 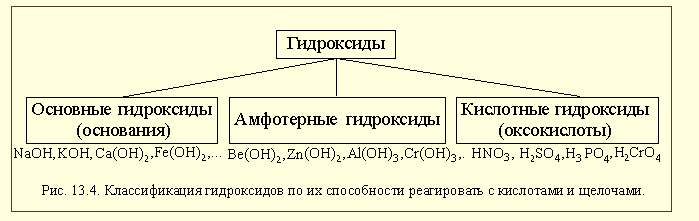 Осно́вные гидрокси́ды — это сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (—OH) и в водном растворе диссоциируют с образованием анионов ОН− и катионов. Амфотерными называются такие гидроксиды, которые способны отдавать в реакциях с другими соединениями как атомы (ионы) водорода, так и гидрокси-группы (анионы гидроксила). Кислотные гидроксиды (кислородсодержащие кислоты) всегда содержат атомы водорода, способные замещаться на атомы металла Соли Ме+кислотный отсаток 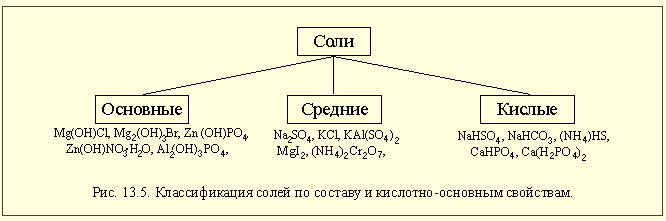 Основные соли – соли, в состав которых входят катионы, способные принимать протон и содержащие гидроксильные группы (группы – О– Н). Средние соли содержат только атомы металла и кислотного остатка. Кислые соли образуются многоосновными кислотами. |
