Химия1. Курс Лекций по дисциплине Химия и инженерная экология
 Скачать 1.01 Mb. Скачать 1.01 Mb.
|
Лекция 4. Окислительно-восстановитекльные реакцииОкислительно-восстановительные реакции (ОВР) – реакции, идущие с изменением степени окисления (с.о.) атомов, входящих в состав реагирующих веществ. Подробно понятие степени окисления рассмотрено в пособии «Общая химия ч.1» с.4. Изменение степени окисления (заряда атома в соединении) в процессе ОВР происходит потому, что атом либо отдает, либо принимает электроны. Окислитель – принимает электроны. Т.к. электрон – отрицательная частица, присоединение электронов ведет к понижению степени окисления, при этом окислитель восстанавливается. Типичные окислители (могут только принимать электроны) содержат атомы в максимальной степени окисления: KMnO4, K2Cr2O7, K2CrO4, H2SO4, HNO3, HCl+7O4. Восстановитель – отдает электроны. При этом степень окисления повышается, восстановитель окисляется. Типичные восстановители (могут только отдавать электроны) содержат атомы в минимальной степени окисления: все металлы (0 – степень окисления простого вещества для металлов является минимальной), N-3H3, H2S-2, HBr-, HI-. Если элемент находится в промежуточной степени окисления, то может проявлять как свойства восстановителя, так и свойства окислителя. Например, SO2: сера S+4 как восстановитель окисляется до S+6, как окислитель способна восстанавливаться до S0, S-2. Типы ОВР Окислительно-восстановительные реакции можно разделить на следующие группы. 4 1) Реакции межмолекулярного окисления-восстановления. В таких реакциях передача электронов осуществляется между разными веществами, одно из которых – восстановитель, другое – окислитель: 2Cu + O2 = 2CuO =Zn + 2HCl = ZnCl2 + H2 2) Реакции диспропорционирования (самоокислениясамовоcстановления). В них один и тот же атом является и окислителем, и восстановителем. Такой атом должен находиться в промежуточной степени окисления; отдавая электроны, он повышает свою с.о., принимая электроны – понижает с.о. Cl02 + H2O = HCl- + HCl+1O 4K2S+4O3 = K2S-2 + 3K2S+6O4 3) Реакции внутримолекулярного окисления-восстановления. В таких реакциях окислитель и восстановитель – разные атомы, но находятся в составе одной молекулы: 2KClO3 = 2KCl + 3O2 2Cu+2(N+5O-23)2 = 2Cu2+O + 2N+4O2 + 3O02 Составление уравнений окислительно-восстановительных реакций При составлении ОВР решаются две задачи: 1) написать возможные продукты реакции и 2) уравнять реакцию. Для решения первого вопроса необходимо определить окислитель и восстановитель, знать возможные с.о. элементов-участников ОВР и предположить, до какой с.о. может пройти окисление и восстановление. Для того, чтобы уравнять реакцию, используют метод баланса. Будем использовать метод электронного баланса. Рассмотрим алгоритм написания ОВР на примере простой реакции, в которой участвуют два вещества – окислитель и восстановитель. Al + O2 → … На первом этапе определим окислитель и восстановитель. Для этого выясним исходные с.о. элементов. В нашей реакции участвуют простые вещества, следовательно, с.о. алюминия и кислорода – 0. Алюминий – металл, для металлов 0 – минимальная с.о., значит алюминий – восстановитель. Кислород – окислитель. Алюминий повысит свою с.о. До какой? Для ответа на этот вопрос, необходимо знать характерные с.о. элементов. В случае алюминия – все просто: в соединениях он проявляет постоянную с.о., равную +3 (это можно определить, рассмотрев электронную конфигурацию атома алюминия по таблице Менделеева). Кислород понизит свою с.о. до --2 (наиболее характерная с.о. кислорода). Т.о., можем записать продукт реакции – оксид алюминия Al2O3: Al + O2 → Al2O3. Составим электронный баланс уравнения. Для этого выпишем отдельно окислитель и восстановитель и процесс отдачи и принятия электронов: Al0 -3e- → Al3+O2 + 4e-→ 2O2- Для нахождения коэффициентов ставим рядом с продуктами число электронов таким образом, чтобы электроны, которые принял окислитель, оказались у восстановителя, а электроны восстановителя – у окислителя, т.е. крест-накрест: Al0 -3e- → Al3+ 4 O2 + 4e- → 2O2- 3 Полученные коэффициенты запишем в уравнение реакции: 4Al + 3O2 → 2Al2O3 Рассмотрим реакцию KMnO4 + NaNO2 + H2SO4 → … ОВР. Гальваника Окислительно-восстановительные реакции. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Окисление Окисление - процесс отдачи электронов атомом, молекулой или ионом. Zn 0 – 2e => Zn 2+ Восстановление Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Электрохимические процессы Электрохимические процессы - это процессы взаимного превращения химической и электрической форм энергии. Это процессы превращения химической энергии в электрическую и обратно. Электродный потенциал Электродный потенциал – это разность потенциалов, которая возникает на границе раздела металл-раствор, если металлическую пластинку опустить в воду или раствор, содержащий ионы этого металла 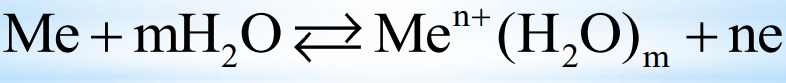 Стандартный водородный электрод Стандартный электродный потенциал – это электродный потенциал, измеренный при стандартный условиях (Т = 298 К; [Mе n+ ] (концентрация) = 1 моль/л, P = 101,3 кПа) относительно стандартного водородного электрода. 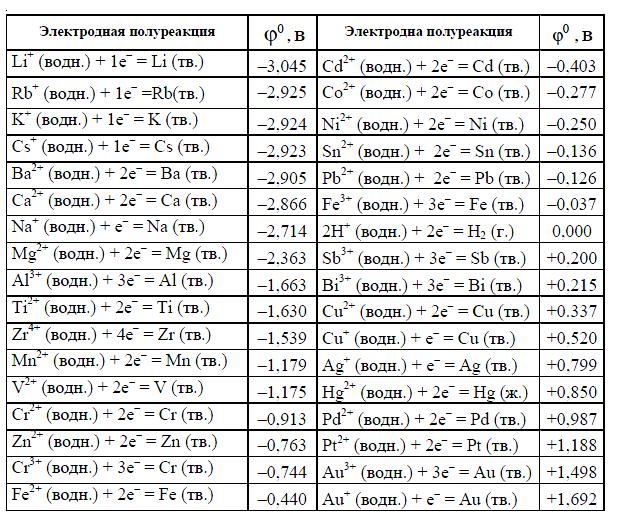  Формула Нернста Применима в случае отклонения условий от стандартных( нормальных): T – 298 K P – 1 атм. (760 мм. рт. ст., 101 кПа) С – 1 моль/л 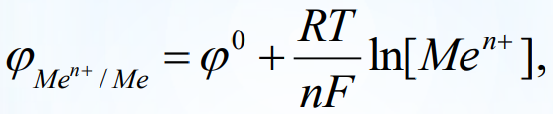 где ϕ0 стандартный электродный потенциал металла, n - число электронов, принимающих участие в процессе, F - постоянная Фарадея (96500 Кл/моль) R – универсальная газовая постоянная Формула Нернста формула Нернста при Т=298 К 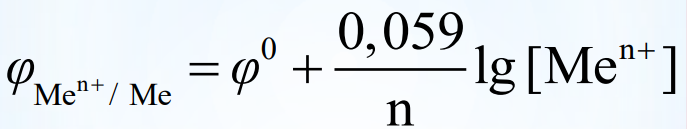 формула Нернста при стандартных условиях: lg[Men+] = lg1=0 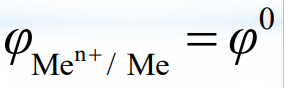 Гальванические элементы Гальванический элемент - это устройство, которое преобразует энергию химической реакции в электрическую за счет самопроизвольного протекания ОВР на электродах. Анод – электрод, изготовленный из более активного Mе, с меньшим ϕ0. Катод – электрод, изготовленный из менее активного Mе, с большим ϕ0. 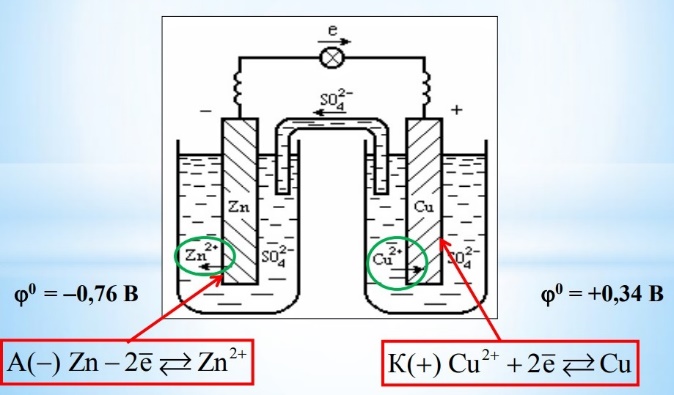 Электрохимическая схема ГЭ: А (-) Zn | ZnSO4 || CuSO4 | Cu (+) К Электродвижущая сила ГЭ (ЭДС) Электродвижущая сила ГЭ (ЭДС) – это максимальная разность потенциалов электродов данного ГЭ, которая определяется в условиях равновесия. ЭДС = ∆ϕ0 = ϕкатода - ϕанода |
