фазовые равновесия. Курсовая Фазовые равновесия Выполнила Студентка группы дхм 311 Шамаева Амина Проверила
 Скачать 361.44 Kb. Скачать 361.44 Kb.
|
|
3.3.2 Равновесие пар — жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей Если система образована из двух летучих ограниченно смешивающихся жидкостей, то при испарении такой системы пар будет содержать оба компонента и находиться в равновесии с каждой из жидких фаз. Согласно правилу сосуществования фаз в гетерогенной системе две фазы, порознь находящиеся в равновесии с третьей фазой, равновесны и между собой. Следовательно, оба жидких раствора равновесны не только с паром, но и между собой. При равновесии химический потенциал каждого из компонентов гетерогенной системы во всех равновесных фазах одинаков: 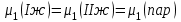 (13) (13)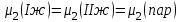 (14) (14)При невысоких давлениях пар можно рассматривать как смесь идеальных газов. Тогда 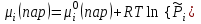 (15) (15)Поскольку при заданной температуре 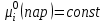 , то парциальное давление пара Рiодного и того же компонента над обеими равновесными жидкими фазами одинаково. Так как общее давление пара над раствором равно сумме парциальных давлений компонентов, то при равновесии над обоими жидкими слоями общее давление пара также одинаково. В расслаивающихся равновесных системах с изменением состава системы составы равновесных жидких фаз не изменяются. , то парциальное давление пара Рiодного и того же компонента над обеими равновесными жидкими фазами одинаково. Так как общее давление пара над раствором равно сумме парциальных давлений компонентов, то при равновесии над обоими жидкими слоями общее давление пара также одинаково. В расслаивающихся равновесных системах с изменением состава системы составы равновесных жидких фаз не изменяются.Следовательно, при постоянной температуре с изменением состава расслаивающейся системы парциальные давления отдельных компонентов и общее давление пара сохраняются постоянными (правило Коновалова). Характер изменения общего и парциальных давлений пара от состава раствора с ограниченной растворимостью жидкостей показан на рис. ниже. Заштрихованная область на диаграмме соответствует области расслоения при температуре Т. Пунктирными линиями Аbи Ва показан характер изменения парциальных давлений компонентов всистеме, подчиняющейся закону Рауля. Кривые аСDВ и АFНbизображают изменения парциальных давлений пара компонентов А и В, кривая аКLb— изменение общего давления пара в зависимости от состава жидких фаз.  рис. зависимость общего и парциальных давлений пара от состава раствора в системах с ограниченной взаимной растворимостью жидкостей при Т=const. 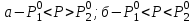 Для изучения равновесия пар – жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей, пользуются диаграммами состояния давление – состав и температура кипения – состав. 3.3.3 Равновесие пар—жидкий раствор в системах с взаимно нерастворимыми жидкостями Совершенно несмешивающихся жидкостей не существует, так как любые жидкости в какой-то степени растворимы друг в друге. Однако если взаимная растворимость жидкостей ничтожно мала, то эти жидкости можно рассматривать как взаимно нерастворимые. В системах, состоящих из взаимно нерастворимых жидкостей, испарение каждой жидкости происходит независимо от присутствия другой, и давление пара каждого компонента при данной температуре сохраняется постоянным для любых соотношениях жидкостей. Температура кипения смеси из двух взаимно нерастворимых жидкостей ниже температур кипения чистых компонентов, так как общее давление паров (Р) над системой выше давления пара каждого из компонентов в отдельности ( 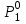 и и 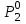 ) и равно ) и равно  . . Если паровую фазу рассматривать как смесь идеальных газов, то в соответствии с законом Дальтона состав пара можно определить по уравнению 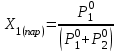 ; ;  При заданной температуре пар такого состава изображается фигуративной точкой. Если составы исходной жидкой смесии пара совпадают, то при изобарном испарении вся жидкость превращается в пар того же состава, а при конденсации такого пара образуются два жидких слоя, суммарный состав которых совпадает с составом исходной смеси. Если составы исходной смеси и пара различны, например жидкая смесь, то при давлении будут испаряться обе жидкости и образуется пар определенного состава.Дальнейшее испарение жидкого компонента приведет к изменению состава пара и к понижению давления над жидкостью. Во всем интервале давлений пар насыщен относительно одного компонента. После исчезновения жидкой фазы пар становится ненасыщенным относительно обоих компонентов и при неизменном составе будет перегреваться. При изотермическом сжатии пара рассмотренные стадии будут происходить в обратной последовательности. Таким образом, испарение и конденсация аналогичных смесей характеризуются наличием некоторого интервала давлений, в котором сосуществуют чистый жидкий компонент и паровая смесь. 4. Уравнение Клапейрона Термодинамическое обоснование эмпирических соотношений между давлением равновесного пара и температуре было дано Клапейроном в 1834 г. Рассмотрим жидкость, находящуюся в равновесии с ее паром при температуре Т и давлении, равном давлении равновесного пара Р при этой температуре. Термодинамическим критерием равновесия при постоянных температуре и давлении является равенство изобарных потенциалов для этих двух состояний: 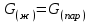 , (16) , (16)где «ж» и «пар» — индексы, обозначающие жидкость и пар. Если температура повысилась до Т+dТ, то для того чтобы обе фазы остались в равновесии, давление должно увеличиться до Р+dР, равного давлению пара при этой более высокой температуре. При бесконечно малом повышении температуры и давления изобарный потенциал для жидкости станет равным G(ж)+dG(ж), а для пара G(пар)+dG(пар). Так как обе фазы находятся в равновесии, то 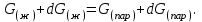 (17) (17)С учетом уравнения (16) условие сохранения равновесия при изменении температуры и давления имеет вид: 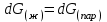 (18) (18)Так как dGпредставляет собой полный дифференциал, то уравнение (18) можно написать следующим образом: 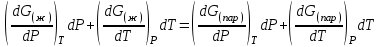 (19) (19)На основании уравнений 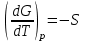 и и 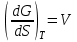 уравнение (19) можно переписать в виде уравнение (19) можно переписать в виде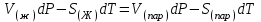 (20) (20)При подстановке получим 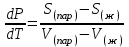 (21) (21)Так как по уравнению 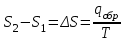  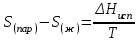 (22) (22)где 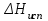 — изменение энтальпии при испарении жидкости при температуре Т, то уравнение (21) можно написать следующим образом: — изменение энтальпии при испарении жидкости при температуре Т, то уравнение (21) можно написать следующим образом: (23) (23)Это важное соотношение известно как уравнение Клапейрона. Оно дает зависимость скорости изменения давления равновесного пара с температурой (dР/dТ) от энтальпии испарения 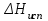 , объема жидкости V(ж) и объема пара V(пар) при температуре Т и давлении, равном давлению насыщенного пара. Вследствие того что вывод уравнения (23) не зависит от каких-либо предположений относительно природы обеих фаз, можно легко вывести такие же уравнения для равновесия между твердым веществом и паром, находящимся в равновесии с ним, а также для равновесия между твердым веществом и жидкостью и между двумя различными кристаллическими формами твердого вещества. Для этих случаев уравнение (23) можно написать так: , объема жидкости V(ж) и объема пара V(пар) при температуре Т и давлении, равном давлению насыщенного пара. Вследствие того что вывод уравнения (23) не зависит от каких-либо предположений относительно природы обеих фаз, можно легко вывести такие же уравнения для равновесия между твердым веществом и паром, находящимся в равновесии с ним, а также для равновесия между твердым веществом и жидкостью и между двумя различными кристаллическими формами твердого вещества. Для этих случаев уравнение (23) можно написать так: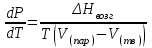 (24) (24) 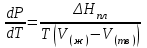  (25) (25)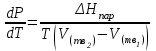 (26) (26)где 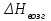 , ,  и и 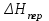 — энтальпии возгонки, плавления и перехода (между твердым состоянием 1 и 2) соответственно. Теплоты возгонки, плавления и испарения при заданной температуре связаны соотношением — энтальпии возгонки, плавления и перехода (между твердым состоянием 1 и 2) соответственно. Теплоты возгонки, плавления и испарения при заданной температуре связаны соотношением (27) (27)поскольку количество тепла, необходимое для испарения данного количества твердого вещества, остается постоянным, независимо от того, проводится ли процесс испарения твердого вещества непосредственно или путем первоначального плавления твердого вещества с последующим испарением жидкости. Каждое из этих уравнений можно выразить через мольные величины. При пользовании уравнениями (23) — (26) необходимо выражать изменение энтальпии процесса в тех же единицах, что и произведение давления на изменение объема. Для этой цели полезно рассчитать множитель для перевода кал в л • атм: 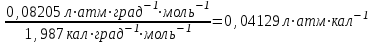 5. Уравнение Клаузиуса — Клапейрона Клаузиус показал, как можно упростить уравнение Клапейрона для случаев испарения и возгонки, исходя из предположения, что пар подчиняется закону идеального газа и что мольным объемом жидкости 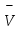 (ж) по сравнению с мольным объемом пара (ж) по сравнению с мольным объемом пара 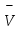 (пар) можно пренебречь. Например, для воды при 100° V(пар) =30.2 л а V(ж)=0,0188 л. Подставляя RT/Р вместо V (пар), получим (пар) можно пренебречь. Например, для воды при 100° V(пар) =30.2 л а V(ж)=0,0188 л. Подставляя RT/Р вместо V (пар), получим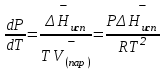 (28) (28)После преобразования выражение принимает вид: 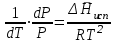 (29) (29)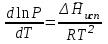 (30) (30)Интегрирование в предположении, что 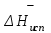 не зависит от температуры, дает: не зависит от температуры, дает: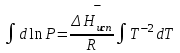 (31) (31)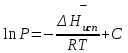 (32) (32)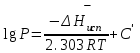 (33) (33)где С — константа интегрирования. Теперь очевидна теоретическая основа эмпирического соотношения 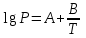 . Уравнение (32) представляет собой уравнение прямой линии, если рассматриватьlnР как функцию . Уравнение (32) представляет собой уравнение прямой линии, если рассматриватьlnР как функцию 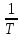 . Тангенс угла наклона прямой равен . Тангенс угла наклона прямой равен 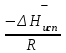 а при использовании десятичных логарифмов он равен а при использовании десятичных логарифмов он равен 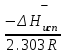 . Таким образом, теплоту испарения можно рассчитать с применением выражения . Таким образом, теплоту испарения можно рассчитать с применением выражения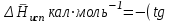 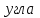  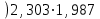 (34) (34)Часто удобнее пользоваться уравнением, полученным при интегрировании в пределах Р2, Т2 и Р1, Т1: 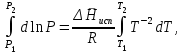 (35) (35)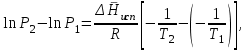 (36) (36)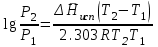 (37) (37)По этому уравнению можно рассчитать теплоту испарения, исходя из давления равновесного пара при двух различных температурах; если известны теплота испарения и давление пара при одной температуре, можно рассчитать давление пара при другой температуре при условии, что 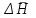 остается постоянной. Давление можно выразить в любых единицах, но эти единицы должны быть одинаковыми для обоих давлений. Точно так же можно выбрать любые единицы энергии при условии, что остается постоянной. Давление можно выразить в любых единицах, но эти единицы должны быть одинаковыми для обоих давлений. Точно так же можно выбрать любые единицы энергии при условии, что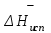 и Rбудут выражены в одинаковых единицах. Изменение давления пара твердого вещества с температурой можно выразить с помощью уравнения (37) при условии, что температурный интервал не слишком широк. Вследствие того, что теплота возгонки твердого вещества больше, чем теплота испарения соответствующей жидкости, давление пара твердого вещества быстрее изменяется с температурой, чем давление пара соответствующей жидкости, и кривая идет круче. Дифференциальное выражение (28) можно применять, если изменения температуры и давления малы. Например, удобно пользоваться следующей формулой для внесения поправок в температуру кипения при колебаниях атмосферного давления: и Rбудут выражены в одинаковых единицах. Изменение давления пара твердого вещества с температурой можно выразить с помощью уравнения (37) при условии, что температурный интервал не слишком широк. Вследствие того, что теплота возгонки твердого вещества больше, чем теплота испарения соответствующей жидкости, давление пара твердого вещества быстрее изменяется с температурой, чем давление пара соответствующей жидкости, и кривая идет круче. Дифференциальное выражение (28) можно применять, если изменения температуры и давления малы. Например, удобно пользоваться следующей формулой для внесения поправок в температуру кипения при колебаниях атмосферного давления: (38) (38)Так как уравнение (37) для расчета теплоты испарения выведено в предположении, что пар есть идеальный газ, то результаты, получаемые при пользовании этим уравнением, не более точны, чем расчеты, в которые входит уравнение 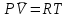 . .Другое приближение содержит допущение о том, что теплота испарения не зависит от температуры. Однако в широком интервале температур графики зависимости lgP от 1/Т несколько искривлены, потому что 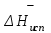 меняется с температурой. В этом случае можно рассчитать теплоту испарения для какой-нибудь определенной температуры из наклона кривой путем проведения касательной к этой кривой при заданной температуре. Уравнение для давления равновесного пара, которое дает линейное изменение меняется с температурой. В этом случае можно рассчитать теплоту испарения для какой-нибудь определенной температуры из наклона кривой путем проведения касательной к этой кривой при заданной температуре. Уравнение для давления равновесного пара, которое дает линейное изменение 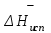 с температурой, можно вывести следующим образом. Согласно уравнению с температурой, можно вывести следующим образом. Согласно уравнению 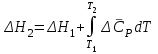 зависимость мольной теплоты испарения зависимость мольной теплоты испарения 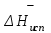 от температуры выражается уравнением от температуры выражается уравнением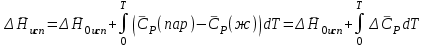 (39) (39)где 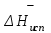 - гипотетическая теплота испарения при абсолютном нуле. В предположении, что - гипотетическая теплота испарения при абсолютном нуле. В предположении, что 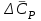 не зависит от температуры, не зависит от температуры,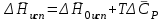 Так как разность 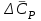 отрицательна, отрицательна, 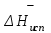 уменьшается по мере повышения температуры. Именно этого можно было ожидать на основании молекулярно-кинетических представлений, потому что жидкость с повышением температуры расширяется, вследствие этого расстояние между молекулами увеличивается и для их отрыва при образовании пара требуется меньше энергии. уменьшается по мере повышения температуры. Именно этого можно было ожидать на основании молекулярно-кинетических представлений, потому что жидкость с повышением температуры расширяется, вследствие этого расстояние между молекулами увеличивается и для их отрыва при образовании пара требуется меньше энергии.Подставляя 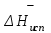 в уравнение (30), получим в уравнение (30), получим 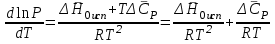 (40) (40) Тогда неопределенный интеграл этого выражения равен:  (41) (41)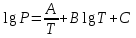 (42) (42)Для определения трех констант А,В,С нужно решить систему из трех уравнений, при составлении которой необходимы точные данные при трех температурах. Уравнение (42) применимо в более широком интервале температур, чем уравнение (32), однако и оно не является точным, поскольку отклонение свойств пара от свойств идеального газа приводит к заметной ошибке, которая не учитывается при выводе уравнения. 6. Практическая часть 6.1 Вопросы Каким правилом выражается связь между числом степеней свободы, числом фаз и числом компонентов в гетерогенной системе? Дать понятия: гетерогенная система, фаза, составляющее вещество системы. С помощью какого уравнения выражается связь между основными термодинамическими параметрами однокомпонентной двухфазной системы, находящейся в состоянии равновесия? Вывести это уравнение. Свяжите составы жидкости и ее пара с общим давлением и парциальным давлением пара. Интерпретируйте диаграмму температура – состав и используйте для ее определения поведение смеси при дистилляции. Справедливо ли уравнение Клапейрона – Клаузиуса для фазовых переходов между твердым и газообразным агрегатными состояниями вещества? Аргументируйте свой ответ. Что характеризует число степеней свободы равновесной термодинамической системы? Сформулируйте основной закон фазового равновесия. Как классифицируются системы? Охарактеризуйте однокомпонентные гетерогенные системы. Диаграмма состояния воды. Кстати, что такое фазовая диаграмма? Что такое моно- и энантиотропные фазовые переходы? Охарактеризовать каждый из них. |
