Пероксосоединения хрома. курсовая_пероксосоединенияхрома. Курсовая работа Белаш Галины Алексеевны, студентки 1 курса, специальность Химия лекарственных соединений
 Скачать 310.38 Kb. Скачать 310.38 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ХИМИЧЕСКИЙ ФАКУЛЬТЕТ Кафедра неорганической химии Пероксосоединения хрома Курсовая работа Белаш Галины Алексеевны, студентки 1 курса, специальность «Химия лекарственных соединений» Научный руководитель: заведующий кафедрой неорганической химии, кандидат химических наук Е.И. Василевская Минск, 2021 ОГЛАВЛЕНИЕВВЕДЕНИЕ 3 ГЛАВА 1. НЕОРГАНИЧЕСКИЕ ПИГМЕНТЫ НА ОСНОВЕ СОЕДИНЕНИЙ МЕДИ 4 1.2.Нахождение в природе 4 1.3 Области применения и токсичность соединений хрома 5 ГЛАВА 2. ОБЗОР ИССЛЕДУЕМЫХ СОЕДИНЕНИЙ ХРОМА 7 2.1 Разнообразие соединений хрома 7 2.2 Соединения Cr(V) 7 2.3 Соединения Cr(VI) 10 ЗАКЛЮЧЕНИЕ 17 ЛИТЕРАТУРА 18 ВВЕДЕНИЕХимия хрома очень разнообразна, а его соединения востребованы в наше время. Они активно используются в промышленном производстве, особенно в металлургии, химической, огнеупорной промышленности и других. Область применения достаточно широка, поэтому углубленное изучение свойств хрома и его соединений является необходимым. Данная работа посвящена изучению основных физических и химических свойств хрома в его соединениях в степенях окисления +5 и +6, их устойчивость, условия и способы получения, применение. Цели работы: 1. Рассмотреть соединения хрома в степенях окисления +5 и +6, их устойчивость, окислительно-восстановительные свойства. 2. Рассмотреть пероксосоединения хрома, их получение, свойства, применение. ГЛАВА 1. НЕОРГАНИЧЕСКИЕ ПИГМЕНТЫ НА ОСНОВЕ СОЕДИНЕНИЙ МЕДИОбщая информация и свойства некоторых красителей Впервые хром был получен из крокоита (хромата свинца) в 1797 г. Л. Н. Вокленом. До этого, в 1766 г., Леманн описал новый минерал, найденный на Урале на Березовском руднике. Новый минерал имел множество различных названий: сибирский красный свинец, красная свинцовая руда, каллохром, леманит, березовит. Название "крокоит" произошло от греческого слова, означающего шафран, и впервые было использовано в 1841 г. немецким ученым Брейтгауптом. В 1797 г. Воклен провел анализ крокоита. Для этого он поместил растертый в порошок минерал в раствор карбоната калия и прокипятил. В результате, он получил карбонат свинца(II) и желтый раствор калиевой соли неизвестной кислоты (хромат калия). При взаимодействии полученного раствора с солью ртути (II) выпадал красный осадок (хромат ртути (II)), при взаимодействии с солью свинца(II) выпадал желтый осадок (хромат свинца), а при добавлении к раствору хлорида олова (II) раствор приобретал зеленый цвет (хлорид хрома (III)). Затем, осадив свинец из крокоита соляной кислотой и отфильтровав осадок, Воклен упарил раствор и, смешав выпавшие красные кристаллы (оксид хрома (VI)) с углем, нагрел до высокой температуры. В результате он обнаружил множество серых сросшихся металлических иголок. Так впервые был получен элемент, получивший название "хром" (от греч. χρῶμα — цвет) за разнообразные цвета его соединений. В 1854 году удалось получить чистый металлический хром электролизом водных растворов хлорида хрома (III). В металлургии, где расход хрома для легирования сталей очень велик, используют не сам хром, а его сплав с железом – феррохром, в котором содержание хрома около 60%. Впервые феррохром был получен в 1820 году восстановлением смеси оксидов железа и хрома древесным углем в тигле. В 1865 году был выдан первый патент на хромистую сталь[8]. Нахождение в природе Среднее содержание хрома в земной коре 83 г/т, по массе содержание хрома в земной коре по разным источникам варьируется от 0,02% до 0,035%. Основной минерал, из которого промышленность получает хром, – это хромовая шпинель переменного состава с общей формулой (Mg,Fe)О·(Сr,Al,Fе)2O3. Хромовая руда носит название хромитов или хромистого железняка (потому, что почти всегда содержит и железо). Хромиты окрашены в темный или почти черный цвет, имеют металлический блеск и обычно залегают в виде сплошных массивов. Месторождения хромита имеют магматическое происхождение. Его выявленные ресурсы оценены в 47 странах мира и составляют 15 миллиардов тонн. Первое место по запасам хромита занимает ЮАР (76% от разведанных мировых запасов), где наибольшее значение имеет группа Бушвельдских месторождений, содержание хромовой руды в которых составляет 1 миллиард тонн [9,11]. 1.3 Области применения и токсичность соединений хрома Соединения хрома применяются в текстильной, кожевенной промышленностях, для производства красок, спичек, для хромирования металлических изделий, а также в химических лабораториях в качестве реактивов. Широко известна так называемая хромовая смесь, содержащая дихромат калия, концентрированную серную кислоту и немного воды. Хромовая смесь находит применение в лабораторной практике в качестве эффективного средства для мытья химического стекла, обращаться с ней нужно крайне осторожно. В медицине соединения хрома не применяются из-за высокой токсичности и канцерогенности. Наиболее токсичными соединениями хрома являются хроматы и дихроматы (более токсичны, чем хроматы). Соединения хрома обладают канцерогенным действием. Соединения хрома (VI) оказывают раздражающее и прижигающее действие на кожу и слизистые оболочки, вызывая изъязвления. Генотоксичность хрома связана с окислительными свойствами Cr(VI) и способностью Cr(III) образовывать комплексы с нуклеиновыми кислотами. При поступлении соединений хрома внутрь наблюдаются ожоги слизистых оболочек рта, пищевода, желудка; рвотные массы имеют желтую или зеленую окраску. Соединения хрома, поступающие в организм в виде пыли через верхние дыхательные пути, вызывают пневмонию. При острых отравлениях соединения хрома накапливаются в печени, почках, эндокринных железах. Выводятся соединения хрома из организма в основном с мочой, поражая при этом почки, слизистые оболочки мочевыводящих путей. Предельно допустимые концентрации оксидов хрома в разных средах представлены в таблице (таблица 1.1) [10].  Таблица 1.1: Предельно допустимые концентрации оксидов хрома Некоторые справочные данные о содержании хрома в организме человека представлены ниже (таблицы 1.2 и 1.3): 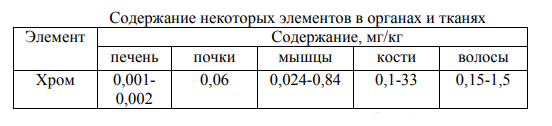 Таблица 1.2 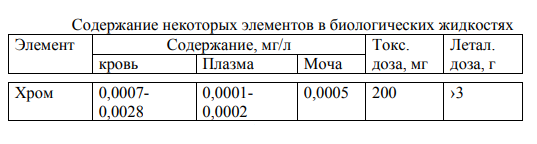 Таблица 1.3 ГЛАВА 2. ОБЗОР ИССЛЕДУЕМЫХ СОЕДИНЕНИЙ ХРОМА2.1 Разнообразие соединений хрома Хром образует множество соединений, в которых он может находиться во всех степенях окисления от 0 до +6. Соединения хрома очень разнообразны по цвету: белые, синие, зеленые, коричневые, красные, желтые, оранжевые, фиолетовые и черные. Соединения двухвалентного хрома малоустойчивы. Наиболее устойчивы производные хрома (III). Также довольно устойчивыми являются соединения Cr(VI), но они легко восстанавливаются до соединений трехвалентного хрома довольно слабыми восстановителями (иодоводород, сероводород, спирт). Диаграмма Латимера для хрома (рисунок 2.1): 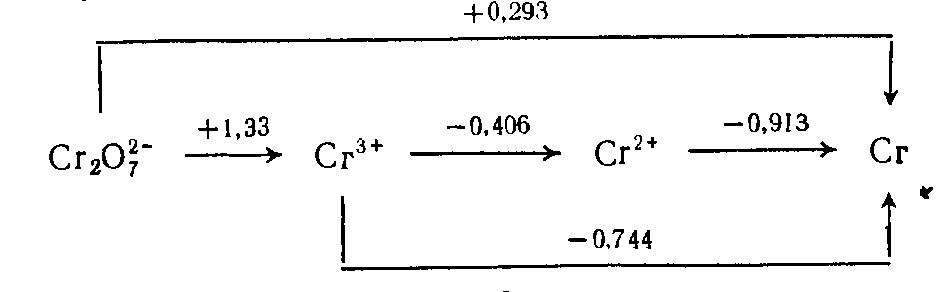 Рисунок 2.1 Диаграмма Латимера для хрома 2.2 Соединения Cr(V) Соединений хрома в степени окисления +5 известно немного. Известны CrF5, оксотетрафорохроматы(V) М+CrOF4 (M = K, Ag), оксопентахлорохроматы (V) М2+CrOCl5 (M = K, Rb, Cs), хроматы (5) M3+CrO4 (M = Li, NA, 1/2Ba) и пероксохроматы (V) M3+CrO8*nH2O (M = Li, Na, K, NH4), образующиеся при взаимодействии хроматов (IV) с H2O2. Ниже представлены ионы пероксосоединений хрома и их пространственная структура (таблица 2.2.1)  Таблица 2.2 Ионы хрома d1-конфигурации Пероксид CrO5, имеющий строение CrO(O)2. Это малоустойчивое соединение темно-синего цвета, существующие в растворах. Оно получается при обработке растворов хроматов или дихроматов диэтиловым эфиром и смесью H2O2 и H2SO4. Эфиром экстрагируют хорошо растворимый в нем пероксид CrO5 (эфирный слой принимает ярко-синюю окраску). Этой реакцией пользуются для обнаружения весьма малых количеств хрома (если хром находится в виде Cr3+, его надо предварительно окислить в щелочной среде с помощью H2O2). Из растворов CrO5 в эфире, пиридине и других растворителях можно выделить аддукты CrO5*L, где L – молекула эфира или другого донора электронной пары. К2Сr2O7 +4Н2O2 + H2SO4 + ру →(ру, эфир)→ 2CrO(O2)2(ру) + K2SO4 + 5H2O Известно два ряда пероксохроматов (представлены хроматами щелочных и щелочноземельных металлов с оттенками цвета от синего до черного и красно-коричневым тетрапероксохромат(V)-ионом): фиолетовые пероксохроматы состава M2[CrO6] и красно-коричневые пероксохроматы состава M3[CrO8] – соли надхромовой кислоты H3CrO8. Последние соединения парамагнитны и имеют один неспаренный электрон. Формула аниона - [Cr(O2)4]3- (КЧ 8 для Сr) (рисунок 2.2.1) [12]. 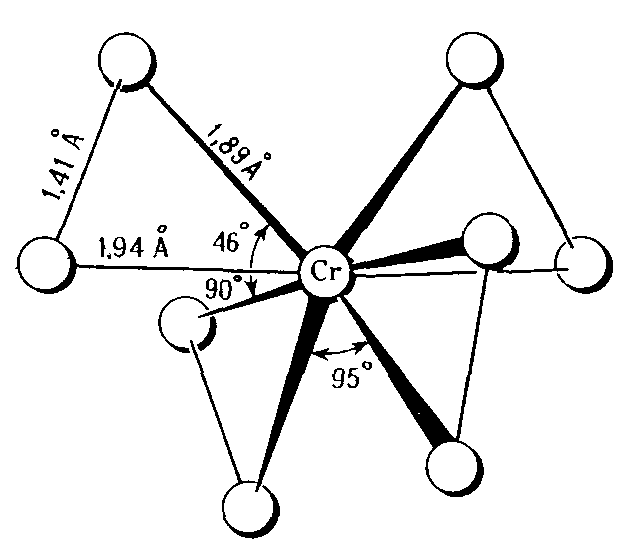 Рисунок 2.2.1: Пространственная структура [Cr(O2)4]3- Соль K3CrO8 довольно устойчива и разлагается (со взрывом) только при температуре выше 170°С. Из пентагалогенидов хром также образует только фторид, проявляющий сильные окислительные свойства. При нагревании порошка хрома с фтором до 400°С в Ni-бомбе под давлением 200 атм образуются значительные количества огненно-красного CrF5 и малые количества лимонно-желтого CrF6. Последний легко разлагается на CrF5 и F2 при высоком вакууме и низких температурах (около 100С). CrF5 – вещество красного цвета, температура плавления которого 34 °С, а температура кипения 117 °С. CrF5 + K2O → K[CrOF4] + KF Четыреокись хрома существует только в виде двойных соединений с аммиаком, цианидами щелочных металлов и некоторыми органическими соединениями. Пероксокомплексы также подтверждают способность кислорода координироваться с металлами в их высших степенях окисления. Качественным тестом на хром служит образование растворов синего цвета при действии Н2O2 на кислые растворы дихроматов. Цвет объясняется присутствием неустойчивого СrO5, который, однако, можно стабилизировать путем экстрагирования эфиром, при этом могут быть выделены твердые аддукты синего цвета, например, [СrO5(ру)]. Более правильно записывать его формулу как [СrО(O2)2(ру)]. Структура этого соединения приблизительно пентагонально-пирамидальная (рисунок 2.4, а). Бидентатные лиганды, такие как фенантролин и бипиридил, образуют пентагонально-бипирамидальные комплексы, в которых второй донорный атом N связан менее прочно в трансположении к = O. Кислотность имеет важное значение. В щелочном растворе образуется [CrO(O2)4]3-, а из нейтрального раствора выделяются взрывоопасные соли фиолетового цвета, возможно, содержащие [CrO(O2)2(OH)] [3]. 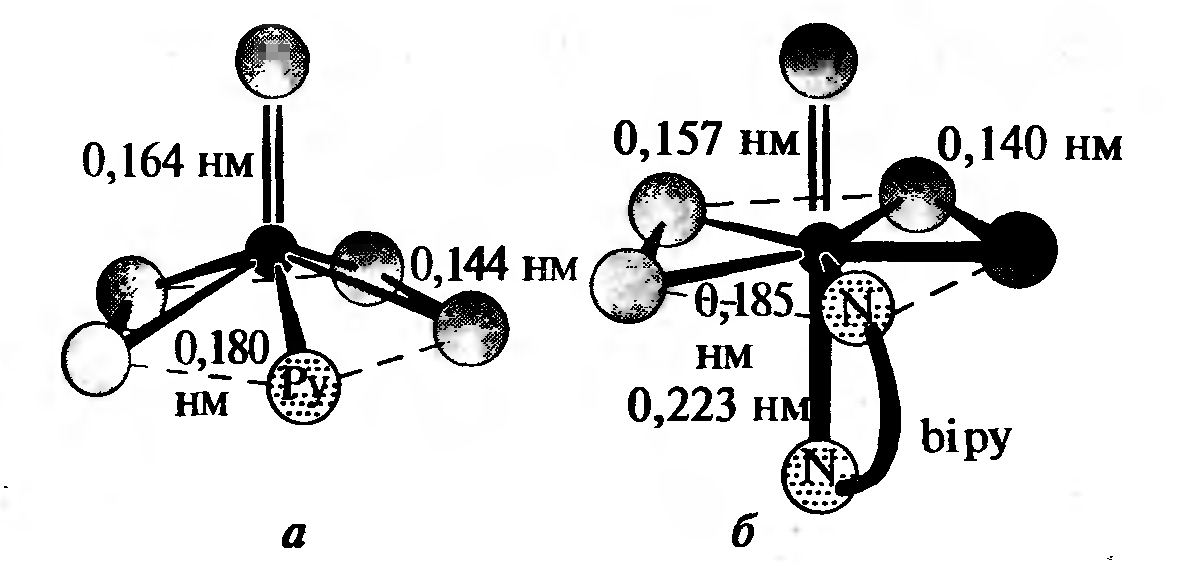 Рисунок 2.2.3: Строение молекул [CrO(O2)2(ру)] (а) и [СrО(O2)2 • bi ру)] (б) Дихромат калия при фторировании трифторидом или пентафторидом брома или трифторидом хлора дает окситетрафторхромат калия (V). Следовательно, опять же, даже самые активные фторирующие агенты не смогли полностью удалить кислород, и снова произошло восстановление до хромия (V). Соединение KCrOF4 легко гидролизуется на воздухе и разлагается в воде. 3KCrOF4 + 5H2O = 3KF + CrF3 + 2H2CrO4 + 6HF Из оксогалогенидов хрома (5+) известны CrOF3 и темно-красный CrOCl3. Реакция трифторида брома с триоксидом хрома и дихроматом калия дает CrOF3 · 0,25 BrF3 и KCrOF4 соответственно, в то время как реакции CrO3 с ClF3 и BrF5 дают CrOF3 * 0,30 ClF3 и CrOF3. Все аддукты CrOF3 представляют собой красные твердые вещества, тогда как KCrOF4 представлен в виде фиолетового порошка. Во всех случаях хром был восстановлен до пятивалентного состояния окисления, что было определено измерениями магнитной восприимчивости. Не обнаружено значительного количества других фторидов хрома или оксидных фторидов среди продуктов. Только очень небольшие количества CrO2F2 могут быть выделены. Получение CrOF3 снижало выход хромилфторида, но было обнаружено, что протекание реакции при 0 ° С сводит к минимуму количество полученного трифторида оксида, пока избегают большого избытка монофторида хлора. Первые полученные образцы CrOF3 представляли собой кирпично-красные твердые вещества, которые быстро темнели в сухом боксе до черного твердого вещества и легко осаждались на стекло. Этот продукт может быть получен в результате реакции либо CrO3, либо CrO2F2 и ClF от 25 до 100 ° С, причем выход увеличивается с ростом температуры. Когда триоксид хрома обрабатывали монофторидом хлора и нагревали до 285 °С, получали негигроскопичное известково-зеленое твердое вещество, которое, как было обнаружено, было очень похоже на соединение, полученное термическим разложением CrOF3. Как и в случае продукта термического разложения CrOF3, был получен плохой анализ и уникальная рентгенограмма порошка[14]. ClF + CrO3 →285°С→ CrOF3 →350°С→ CrF3 2.3 Соединения Cr(VI) Степень окисления хрома +6 проявляется в галогенидах, оксогалогенидах, оксидах и отвечающих им анионных комплексах. Для хрома (VI) характерно координационное число 4, что отвечает тетраэдрическому строению его анионных комплексов и структурных единиц. Оксогалогениды всех трех элементов сильно подвержены гидролизу, а их окислительные свойства ослабевают в следующем порядке: Сr > Мо > W. Они представляют собой жидкости или летучие твердые вещества с оттенками от желтого до красного. В таблице 1 представлены некоторые соединения хрома c галогенами и кислородом:
Таблица 2.3.1. Галогенид и оксогалогениды хрома(VI) Возможно, наиболее известна из них темно-красная легколетучая жидкость CrO2Cl2 — хлорид хромила. Растворяется в четыреххлористом углероде, сероуглероде, нитробензоле, пятихлористой сурьме. Чаще всего его упоминают как дистиллят в качественных тестах на присутствие хрома или хлорида. Его получают при нагревании дихромата и хлорида в концентрированной серной кислоте; он относится к крайне агрессивным окислителям. Его интенсивная окраска обусловлена полосой переноса заряда. При хранении на свету хлористый хромил разлагается, выделяя хлор. Являясь дихлорангидридом хромовой кислоты, он энергично взаимодействует с водой, превращаясь в смесь соляной и хромовой кислот: CrO2Cl2 + 2H2O = H2CrO4 + 2HCl Хлористый хромил — сильный окислитель. Он воспламеняется в атмосфере аммиака, превращаясь в смесь оксидов и нитридов хрома, со взрывом реагирует с белым фосфором, энергично окисляет серу, сероводород, фосфин и многие органические вещества, такие как резину, этиловый спирт. Хлористый хромил хорошо растворяет галогены: хлор, бром и иод. Из раствора иода кристаллизуются коричневые кристаллы Cr3O6Сl2 — хлорангидрида частично восстановленной трихромовой кислоты: 3CrO2Cl2 + 2I2 = Cr3O6Cl2 + 4ICl Получают хромистый хромил действием на смесь дихромата или хлорида концентрированной серной кислотой: K2Cr2O7 + 4KCl + 3H2SO4 = 2CrO2Cl2 + 3K2SO4 + 3H2O Либо пропусканием тока хлороводорода над хромовым ангидридом: CrO3 + 2HCl = CrO2Cl2 + H2O Хлористый хромил находит применение в органическом синтезе в качестве окислителя. При взаимодействии его с олефинами в зависимости от условий могут быть получены карбонильные соединения, хлорокетоны, эпоксиды, дихлоралканы [2]. Из высших монооксогалогенидов хрома описан лишь фторид CrOF4. Это тёмно-красные кристаллы, плавящиеся при температуре 55 °C. Он образуется при прямом фторировании хромового ангидрида или при взаимодействии CrO2F2 с дифторидом криптона в жидком фтороводороде. Являясь кислотой Льюиса, он образует соли, например Cs[CrOF5]. Оксохлорид хрома (5) СrОСl3 получают взаимодействием хромового ангидрида с хлористым тионилом. Все оксогалогениды проявляют кислотные свойства и гидролизуются: CrOF4 + 3H2O = H2CrO4 + 4HF Невозможность получения хлорида, бромида и иодида хрома (6) связана с неизбежностью окислительно-восстановительного взаимодействия хрома (6) с галогенид-ионами, а также является следствием стерических затруднений при размещении вокруг атома металла крупных атомов галогенов. Известен только фторид. Однако для образования желтого CrF6 необходимы нагревание до 400 °С и давление 200-300 атм. Снижение давления вызывает его диссоциацию на CrF5 и F2 даже при температуре -100 °С. Оксид хрома (VI) (хромовый ангидрид), CrO3, представляет собой расплывающиеся на воздухе красные кристаллы, легко растворимые в воде. Температура плавления – 197 °C, разложения - 250 °C. Оксид хрома (VI) очень ядовит (I класс опасности), смертельная доза для человека составляет 0,6 г. Легче всего CrO3 получается при добавлении концентрированной серной кислоты к раствору дихромата натрия или калия: К2Cr2O7 + H2SO4(конц.) → 2CrO3 + К2SO4 + H2O, При растворении в воде, в зависимости от концентрации, образует хромовые кислоты различного состава: CrO3 + H2O → H2CrO4 (желтый раствор) 2CrO3 + H2O → H2Cr2O7 (оранжевый раствор) 3CrO3 + H2O → H2Cr3O10 (красный раствор) При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода: 4CrO3 → 2Cr2O3 + 3O2. Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например, этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним. Окисляет серу, фосфор, иод, уголь, например: 4CrO3 + 3S = 2Cr2O3 + 3SO2 Реакции обнаружения ионов хрома основаны на окислении Cr3+ до Cr (VI), а затем проводят реакции с дифенилкарбазидом, образование надхромовых кислот. Окисление Cr3+ до Cr(VI) проводят персульфатом аммония в присутствии катализатора (AgNO3). 1. Дихромат-ионы взаимодействуют с дифенилкарбазидом, который при этом окисляется до дифенилкарбазона. 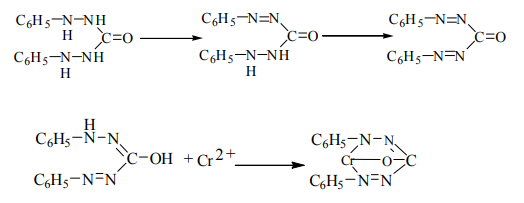 Рисунок 1.3.1 Механизм реакции обнаружения ионов хрома 2. Образование надхромовых кислот. Ионы Cr3+ окисляют до Cr(VI) персульфатом аммония в присутствии AgNO3, затем прибавляем H2O2 и органический растворитель (эфир, амиловый спирт). Наблюдается сине-голубое окрашивание. Предел обнаружения – 0,2 мкг/мл. Енольная форма дифенилкарбазона с ионами Cr2+ образует внутрикомплексную соль, имеющую красно-фиолетовую окраску. Область применения хромового ангидрида: отбеливание различных материалов, пигмент в производстве стекла, протрава при крашении тканей, компонент пассивирующих растворов для металлов, полупродукт в электролитическом получении хрома. Важными соединениями хрома являются хромат и дихромат калия. Рассмотрим строение этих ионов, они представлены ниже (CrO42- и Cr2O72- соответственно): 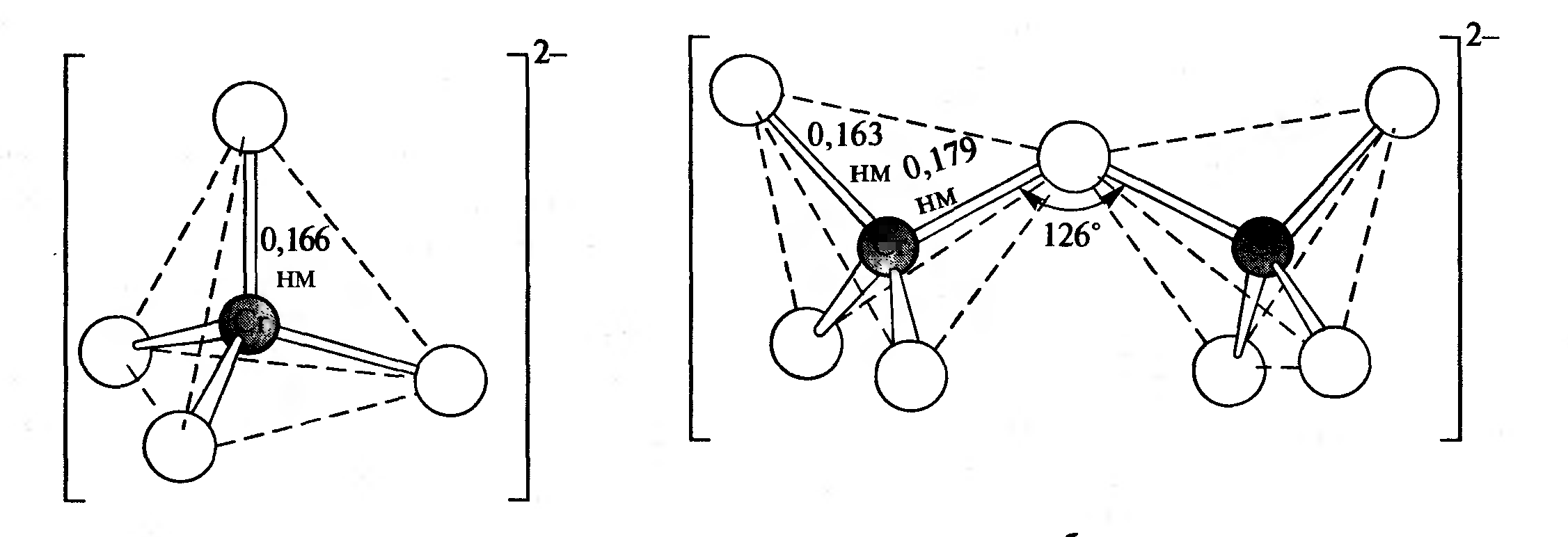 Рисунок 2.3.2 Строение ионов CrO42- и Cr2O72- Хромат калия K2CrO4. Светло-желтые кристаллы, хорошо растворимые в воде. Может быть получен при сплавлении Cr2O3 с KOH в присутствии окислителей: CrO3 + 2KOH → K2CrO4 + H2O окислением щелочных растворов Cr3+: 2K[Cr(OH)4] + 3Cl2 + 8KOH → 2K2CrO4 + 6KCl + 8H2O подщелачиванием раствора дихромата калия: K2Cr2O7 + 2KOH → 2K2CrO4 + H2O. Из химических свойств известны реакции хромата с растворами разбавленных и концентрированных кислот: 2K2CrO4 + 2HCl (разб.) = K2Cr2O7 + 2KCl + H2O K2CrO4 + 2HCl (конц.) = K[CrO3Cl] + KCl + H2O K2CrO4 + 16HCl (конц.) = 2CrCl3 + 3Cl2 + 4KCl + 8H2O (t= 90 °C) Известен редкий минерал – тарапакаит (хромат калия с примесями). Хромат калия, как и все соединения хрома (VI), – сильный окислитель. Применяется при дублении кож, отбеливании воска, как протрава в текстильной промышленности, в производстве красителей. ПДК 0,01 мг/м3 (в пересчете на CrO3). Дихромат калия (хромпик) K2Cr2O7 – это оранжевое кристаллическое вещество, умеренно растворимое в воде (13% при 25 °C). Сильный окислитель, ядовит. Получается при подкислении водного раствора хромата калия: 2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O И при других реакциях с участием CrO3: 2CrO3 + 2KOH → K2Cr2O7 + H2O 2CrO3 + K2CO3 → K2Cr2O7 + CO2. В кислой среде восстанавливается до солей хрома (3). Например, он окисляет галогенид-ионы галогеноводородных кислот до свободных галогенов: K2CrO7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O Также в кислой среде (pH 3,0-3,5) обладает способностью окислять металлическое серебро: 6Ag + Cr2O72- + 14H+ →(-6ȇ)→ 6Ag+ +2Cr3+ + 7H2O При нагревании с серой и углеродом, кристаллический дихромат калия восстанавливается до Cr2O3: S + K2Cr2O7 = Cr2O3 + K2SO4 C + K2Cr2O7 = K2CO3 + Cr2O3 + CO2 K2Cr2O7 – исходное вещество для получение хромокалиевых квасцов. Это темно-фиолетовые кристаллы, которые образуются в результате восстановления сернистым газом (или этиловым спиртом) раствора бихромата калия, подкисленного серной кислотой: K2Cr2O7 + 3SO2 + H2SO4 + 23H2O = 2KCr(SO4)2*12H2O K2Cr2O7 + 3C2H5OH + 4H2SO4 + 17H2O = 2KCr(SO4)2*12H2O + 3CH3COH Высокотоксичен, канцерогенен, аллерген, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. Среди соединений шестивалентного хрома наиболее токсичен. Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (или хромовая смесь) применяют для мытья стеклянной посуды в лабораториях [1]. ЗАКЛЮЧЕНИЕВ данной работе рассмотрены основные свойства хрома - химического элемента VI группы периодической системы Менделеева. В первых двух разделах работы кратко изложены факты открытия и дальнейшего использования хрома, указана особенность распространения хрома в природе: хром никогда не встречается в свободном состоянии. Также, отмечены малая химическая активность хрома, сильные окислительные свойства и высокая токсичность его соединений. ЛИТЕРАТУРАГринвуд, Н.Н. Химия элементов: в 2 т. /Н.Н. Гринвуд, А. Эрншо. – Т.2. – М.: 2008. – С. 337. Третьяков Ю.Д., Неорганическая химия: в 3 т. / под ред. Третьякова Ю.Д. Т. 2: Химия непереходных элементов: Учебник для студ. высш. учеб.заведений / А.А.Дроздов, В.П.Зломанов, Г.Н.Мазо, Ф.М.Спиридонов – М.: Издательский центр «Академия», 2004. – 306-319 с. Уилкинсон Дж., Коттон Ф., Основы неорганической химии. Пер. с англ. − Ю. А. Устынюк./ изд.: «Мир», Москва, 1979. – 553 с. Г. Реми, Курс неорганической химии: в 2 т./ А.В. Новоселовой, Г. Ремми, перевод с немецкого – А.И. Григорьева, А.Г. Рыкова, Н.С. Смирнова, Н.Я. Турова. Т. 2/ изд.: «Мир», Москва, 1966. – 142 с. Шрайвер Д., Эткинс П., Неорганическая химия. В 2-х т. Т. 1/Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм. — М.: Мир, 2004. − 465 с. Н.С. Ахметов, Общая и неорганическая химия. Учеб.для вузов/Н.С. Ахметов. – 5-е изд., испр. – М.: 2003. – 613 с. Хьюи Дж., Неорганическая химия. Строение вещества и реакционная способность. Пер. с англ./Под. Ред. Б. Д. Степина, Р. А. Лидина. – М.: 1987. – 388 с. Хром [электронный ресурс]. – Режим доступа: https://fractalhd.ru/hrom/, дата доступа: 19.04.20. ХРОМ ГЕОХИМИЯ [электронный ресурс]. – Режим доступа: https://studfile.net/preview/7524824/, дата доступа: 19.04.20. Токсикологическая химия (в 2 частях). Ч.1: учебное пособие / А.И. Жебентяев. – Витебск: ВГМУ,2014 – 115 с. Хром | Нахождение в природе [электронный ресурс]. – Режим доступа: https://www.allmetals.ru/metals/chrome/occurance/, дата доступа: 19.04.20. Лаврухина А.К., Юкина Л.В., Аналитическая химия хрома. Издательство: Наука. Дата публикации: 1979 – 15-27 с. Green, Patrick Jay, "The chemistry of chromium (VI) and chromium (V) oxide fluorides" (1976). Dissertations and Theses. Paper 4039 Davis, Harry Bennett, "High valent chromium (V) and chromium (VI) complexes" (1984). Dissertations and Theses. Paper 3394. |
