Курсовая Работа Кафедра Общей Химической Технологии Производство серной кислоты из серы
 Скачать 498.5 Kb. Скачать 498.5 Kb.
|
Москвский гонударственный университет тонкой химической технлогии им. М.В. Ломоносова. Курсовая Работа Кафедра Общей Химической Технологии Производство серной кислоты из серы. Преподаватель: Чабан Наталья Григорьевна Студент: Лугвищук Дмитрий Сергеевич Группа ХТ-406 Москва 2013 Содержание Введение. 3 Исходное сырье. 7 Характеристика целевого продукта. 8 Технологический процесс производства серной кислоты из серы 10 Химическая схема процесса 13 1.Сжигание серы. 13 2. Контактное окисление SO2 в SO3 14 3.Абсорбция триоксида серы. 15 Задание для расчета 17 Выполнение расчета. 18 1.Составляем блок-схему производства. 18 2. Составление уравнений по каждому узлу. 19 3.Материальный баланс. 22 Список литературы. 23 Введение.Серная кислота – наиболее сильная и самая дешевая кислота. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260 – 336,5*С) находится в жидком состоянии. Она широко используется в производстве минеральных удобрений, различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и т.д. Серная кислота находит разнообразное применение в нефтяной, металлургической, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности, используется в качестве водоотталкивающего и осушающего средства, применяется в процессах нейтрализации, травления и т.д. Наиболее важные области применения серной кислоты отражены на схеме. Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4 , поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы. В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид. Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2, высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2. Кроме олеума, концентрированной серной кислоты и аккумуляторной кислоты, отечественные заводы выпускают также более чистую контактную кислоту улучшенного качества (для производства искусственного волокна, титановых белил и др.), чистый олеум, химически чистую и реактивную серную кислоту. За последние годы в процессе производства серной кислоты внесены существенные улучшения. Широко применяется обжиг колчедана в кипящем слое и сжигание серы в циклонной печи, значительно увеличивается использование тепла, выделяющегося при обжиге сырья, и на других стадиях производства серной кислоты. Непрерывно повышается производительность башенных сернокислотных систем в результате поддержания оптимального технологического режима, разработанного на основе исследований; интенсивность башенных систем достигает 250 кг/м3 в сутки. Освоен контактно-башенный процесс производства серной кислоты, при котором расход HNO3 составляет 6 – 7 кг на 1 тонну H2SO4. В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства, себестоимость более чистой и высококонцентрированной контактной серной кислоты лишь незначительно выше, чем башенной. В настоящее время свыше 90% всей кислоты производится контактным способом. В качестве катализаторов контактного процесса теперь применяется термически стойкая ванадиевая контактная масса (в виде гранул и колец) с пониженной температурой зажигания. Проведены работы по освоению процесса окисления SO2 в кипящем слое катализатора. Важным усовершенствованием является двойное контактирование, при котором обеспечивается высокая степень окисления SO2 на катализаторе (до 99,8%) и потому исключается необходимость в дополнительной санитарной очистке отходящих газов. Внедряется процесс конденсации H2SO4, заменяющий абсорбцию серного ангидрида. Также для производства серной кислоты используют ангидрид или безводный сульфат кальция CaSO4, гипс или двуводную соль CaSO4*2H2O и фосфогипс, представляющий собой отход производства концентрированных фосфорных удобрений (смесь гипса, соединений фтора, окислов фосфора, SO2 и других примесей). В нитрозном способе катализатором служат оксиды азота. Окисление SO2 происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. Сущность нитрозного метода состоит в том, что обжиговый газ обрабатывается серной кислотой, в которой растворены окислы азота. Сернистый ангидрид обжигового газа поглощается нитрозой, и затем окисляется окислами азота по реакции: SO2 + N2O3 + H2O = H2SO4 + 2NO. Образующийся NO плохо растворим в нитрозе и выделяется, а затем частично окисляется кислородом до NO2. Смесь NO и NO2 вновь поглощается H2SO4. Промышленность выпускает три вида товарной серной кислоты: Башенная кислота: С=75%, tкрист= -29,5*С Контактная кислота: С=92,5%, tкрист= -22,0*С Олеум: С=20% своб. SO3, tкрист= +2*С Схема применения серной кислоты Na2SO3 Колчедан Сульфитная целлюлоза NaHSO3 Сера Газы цветной металлургии Газы агломерационных фабрик      Ca(HSO3)2   Хлористый сульфурил    Контактный способ  сероводород Отработанные кислоты    Фтор - и хлорсульфоновые к-ты Процессы сульфирования      гипс Минеральные удобрения Сульфат аммония (NH4)2SO4 Травление металлов Металлургия: Al, Mg, Cu, Hg, Co, Ni, Au и др. Минеральные кислоты HF, H3PO4, H3BO3 Минеральные пигменты Очистка нефтепродуктов и минеральных масел Химические волокна, текстильная промышленность Производство патоки и глюкозы Органические красители Получение спиртов, эфиров и др. органических веществ Взрывчатые вещества Производство K2Cr2O7 и Na2Cr2O7 Производство сульфатов Na, K, Fe, Cu, Zn, Al и др.   Нитрозный способ               Исходное сырье.Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты в СССР получали из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы. В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу. В атмосферу с отходящими газами тепловых электростанций и металлургических заводов выбрасывается диоксида серы значительно больше, чем употребляется для производства серной кислоты. Из-за низкой концентрации SO2 в таких отходящих газах их переработка пока еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов. Характеристика целевого продукта.Серная кислота может существовать как самостоятельное химическое соединение H2SO4, а также в виде соединений с водой H2SO4*2H2O, H2SO4*H2O, H2SO4*4H2O и с триоксидом серы H2SO4*SO3, H2SO4*2SO3. В технике серной кислотой называют и безводную H2SO4 и ее водные растворы (по сути дела, это смесь H2O, SO2 и соединений H2SO4 *nH2O) и растворы триоксида серы в безводной H2SO4 – олеум (смесь H2SO4 и соединений H2SO4*nSO3). Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава. Безводная 100%-ная кислота имеет сравнительно высокую температуру кристаллизации 10,7 *С. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты.
Серная кислота и вода образуют азеотропную смесь состава 98,3% H2SO4 и 1,7% H2O с максимальной температурой кипения (336,5*С). Состав находящихся в равновесии жидкой и паровой фаз для кислоты азеотропной концентрации одинаков; у более разбавленных растворов кислоты в паровой фазе преобладают пары воды, в паровой фазе над олеумом высока равновесная концентрация SO3. Серная кислота весьма активна. Она растворяет оксиды металлов и большинство чистых металлов, вытесняет при повышенной температуре все другие кислоты из солей. Особенно жадно серная кислота соединяется с водой благодаря способности давать гидраты. Она отнимает воду у других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов, которые содержат не воду как таковую, а водород и кислород в сочетании Н:О=2. Дерево и другие растительные и животные ткани, содержащие целлюлозу (С6Н10О5), крахмал и сахар, разрушаются в концентрированной серной кислоте; вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги. Технологический процесс производства серной кислоты из серыТехнологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей [1]: особая конструкция печей для получения печного газа; повышенное содержание оксида серы (IV) в печном газе; отсутствие стадии предварительной очистки печного газа. Производство серной кислоты из серы по методу двойного контактирования и двойной абсорбции (рис. 1) состоит из нескольких стадий: Воздух после очистки от пыли подается газодувкой в сушильную башню, где он осушается 93-98%-ной серной кислотой до содержания влаги 0,01% по объему; Осушенный воздух поступает в серную печь после предварительного подогрева в одном из теплообменников контактного узла. Сжигание (горение) серы представляет собой гомогенную экзотермическую реакцию, которой предшествуют переход твердой серы в жидкое состояние и ее последующее испарение: STB→ SЖ → SПАР Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением: S + О2 → SO2 + 297,028 кДж; Для сжигания серы используют печи форсуночного и циклонного типов. В форсуночных печах расплавленная сера распыляется в камере сгорания сжатым воздухом через форсунки, которые не могут обеспечить достаточно полного перемешивания паров серы с воздухом и необходимой скорости горения. В циклонных печах, работающих по принципу центробежных пылеуловителей (циклонов), достигается значительно лучшее смешивание компонентов и обеспечивается более высокая интенсивность горения серы, чем в форсуночных печах. Газ, содержащий 10-14% по объему SO2, охлаждается в котле и после разбавления воздухом до содержания SO2 9-10% по объему при 420°С поступает в контактный аппарат на первую стадию конверсии, которая протекает на трех слоях катализатора (SO2+V2O5→SO3+96,296 кДж), после чего газ охлаждается в теплообменниках; Затем газ, содержащий 8,5-9,5% SO3, при 200°С поступает на первую стадию абсорбции в абсорбер, орошаемый олеумом и 98%-ной серной кислотой: SO3 + Н2О→Н2SO4+130,56 кДж; Далее газ проходит очистку от брызг серной кислоты, нагревается до 420°С и поступает на вторую стадию конверсии, протекающую на двух слоях катализатора. Перед второй стадией абсорбции газ охлаждается в экономайзере и подается в абсорбер второй ступени, орошаемый 98%-ной серной кислотой, и затем после очистки от брызг выбрасывается в атмосферу. Печной газ при сжигании серы отличается более высоким содержанием оксида серы (IV) и не содержит большого количества пыли. При сжигании самородной серы в нем также полностью отсутствуют соединения мышьяка и селена, являющиеся каталитическими ядами. Эта схема отличается простотой и получила название «короткой схемы» (рис. 2). 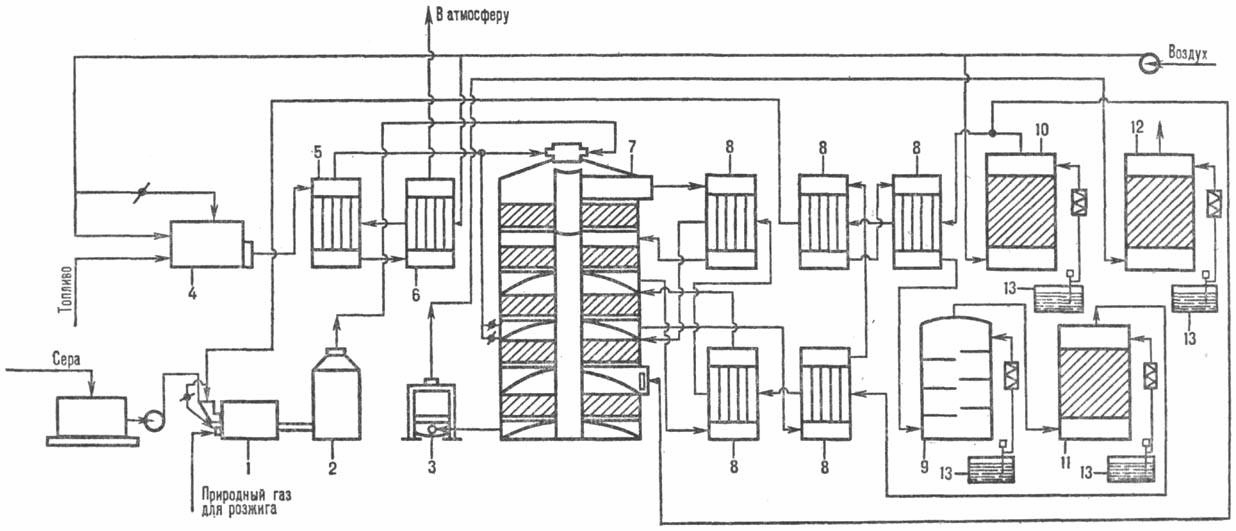 Рис. 1. Схема производства серной кислоты из серы по методу ДК—ДА [3]: 1-серная печь; 2-котел-утилизатор; 3 - экономайзер; 4-пусковая топка; 5, 6-теплообменники пусковой топки; 7-контактный аппарат; 8-теплообменники; 9-олеумный абсорбер; 10-сушильная башня; 11 и 12-соотв. первый и второй моногидратные абсорберы; 13-сборники кислоты. 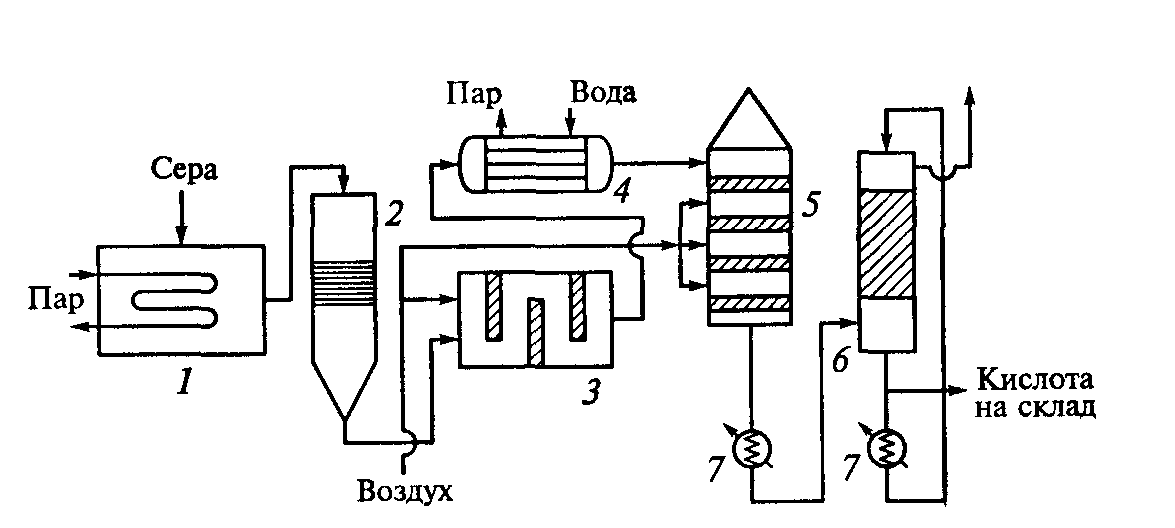 Рис.2. Производство серной кислоты из серы (короткая схема) [2]: 1 — плавильная камера для серы; 2 — фильтр жидкой серы; 3 — печь для сжигания серы; 4 — котел-утилизатор; 5 — контактный аппарат; 6 — система абсорбции оксида-серы (VI); 7— холодильники серной кислоты Существующие установки по производству серной кислоты из серы, снабженные печами циклонного типа, имеют производительность 100 т серы и более в сутки. Разрабатываются новые конструкции производительностью до 500 т/сут. Расход на 1 т моногидрата: серы 0,34 т, воды 70 м3, электроэнергии 85 кВт-ч. Химическая схема процесса1.Сжигание серы.При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию кислоты. При сжигании серы протекает необратимая экзотермическая реакция: S + O2 = SO2 (1) с выделением очень большого количества теплоты: изменение Н= -362,4 кДж/моль, или в пересчете на единицу массы 362,4/32=11,325 кДж/т = 11325 кДж/кг S. Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6 *С; теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция). Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа печей – форсуночные и циклонные. В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата. Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты. Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, подаваемых на сжигание. Если воздух берут в стехиометрическом количестве, т.е. на каждый моль серы 1 моль кислорода, то при полном сгорании серы концентрация будет равна объемной доле кислорода в воздухе Сso2.max=21%. Однако обычно воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура. При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составит 1500*С. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 1300*С быстро разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14% SO2. 2. Контактное окисление SO2 в SO3Контактное окисление диоксида серы является типичным примером гетерогенного окислительного экзотермического катализа. Это один из наиболее изученных каталитических синтезов. В СССР наиболее основательные работы по изучению окисления SO2 в SO3 и разработке катализаторов были проведены Г.К. Боресковым. Реакция окисления диоксида серы SO2 + 0,5 O2 = SO3 (2) характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора. В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2O5 (ванадиевая контактная масса). Кталитическая активность в этой реакции проявляют и другие соединения, прежде всего платина. Однако, платиновые катализаторы чрезвычайно чувствительны даже к следам мышьяка, селена, хлора и других примесей и поэтому постепенно были вытеснены ванадиевым катализатором. Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижним температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400 – 440*С. верхний температурный предел составляет 600 – 650*С и определяется тем, что выше этих температур происходит перестройка структуры катализатора, и он теряет свою активность. В диапазоне 400 – 600*С процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась. Чаще всего в промышленности используют полочные контактные аппараты с наружным теплообменом. Схема теплообмена предполагает максимальное использование теплоты реакции для подогрева исходного газа и одновременное охлаждение газа между полками. Одна из важнейших задач, стоящих перед сернокислотной промышленностью, - увеличение степени превращения диоксида серы и снижение его выбросов в атмосферу. Эта задача может быть решена несколькими методами. Один из наиболее рациональных методов решения этой задачи, повсеместно применяемой в сернокислотной промышленности, - метод двойного контактирования и двойной абсорбции (ДКДА). Для смещения равновесия вправо и увеличения выхода процесса, а также для увеличения скорости процесса процесс проводят по этому методу. Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3. В оставшемся реакционном газе соотношение O2:SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном-двух слоях катализатора достигают 95% степени превращения оставшегося SO2.суммарная степень превращения SO2 составляет в таком процессе 99,5% - 99,8 %. 3.Абсорбция триоксида серы.Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. nSO3 + H2O = H2SO4 + (n-1)SO3+Q………(3) если n>1, то получается олеум (раствор SO3 в H2SO4) если n=1 , то получается моногидрат (98,3% H2SO4) если n<1, то получается разбавленная серная кислота При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. Для полного извлечения SO3 необходимо, чтобы равновесное парциальное давление SO2 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. Однако, в качестве абсорбента нельзя использовать и такие растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде – азоте, т.е. с образованием сернокислотного тумана: S   O3(г) + H2O(г) H2SO4(г) H2SO4(туман) ; Q>0 O3(г) + H2O(г) H2SO4(г) H2SO4(туман) ; Q>0Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты. Высказанные соображения позволяют решить вопрос о выборе абсорбента. Оптимальным абсорбентом является 98,3%-ная серная кислота (техническое название – моногидрат), соответствующая азеотропному составу. Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3. Протекающий при этом процесс можно условно описать уравнением реакции: SO3 + nH2SO4 + H2O= (n+1) H2SO4 Использование в качестве поглотителя менее концентрированной серной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой или олеумом в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью. Однако если в качестве одного из продуктов процесса необходимо получить олеум, можно совместить абсорбцию олеумом (1-й абсорбер) и абсорбцию 98,3%-ной кислотой (2-й абсорбер). В принципе при высоких температурах над 98,3%-ной кислотой может быть значительным парциальное давление паров самой кислоты, что также будет снижать степень абсорбции SO3. Ниже 100*С равновесное давление паров H2SO4 очень мало и поэтому может быть достигнута практически 100%-ная степень абсорбции. Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100*С. Однако в процессе абсорбции SO3 происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация H2SO4 при однократном прохождении абсорбера повышалась только на 1-1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции. Задание для расчетаВариант №2 Стадии производства серной кислоты:
Исходные данные для расчета
Выполнение расчета.1.Составляем блок-схему производства.сера воздух    Сжигание серы  Контактное окисление SO2 в SO3  Вода Абсорбция SO3     Серная кислота Выхлопные газы   03     011 011 12 23 302 12 23 302   012 012  301 301011 - Сера жидкая 012 - Воздух
23 - SO3 содерж. газ
2. Составление уравнений по каждому узлу.1.Составляем уравнения по первому узлу: 0.94*N011=N12SO2 N12SO2=N12*0.088 N011=X1 0.94*N011=N12*0.088 N12=X3 0.94*X1=X3*0.088 (1) 2. Составляем уравнения по второму узлу: а) 0,995*N12SO2=N23SO3 0.995*N12*0.088=N23SO3 N23SO3=X4 0.995*X3*0.088=X4 (2) б) N12*(0.21-0.088)=2N23SO3 X3*(0.21-0.088)=2X4 (3) 3.Составляем уравнение по третьему узлу: а) G302*0.935=2500 базисное уравнение G302=X7 X7*0.935=2500 (4) б) 0.997*N23SO3=2500/Mr(H2SO4) 0.997*X4=2500/98 (5) в) N301=N301SO2 + N301N2 + N301SO3 + N301O2 N301SO2=N12SO2*(1-0.995)=N12SO2*0.005=N12*0.088*0.005 N301N2= 0.79*N012 N301SO3=N23SO3*(1-0.997)=0.003*N23SO3 N301O2=N12*(0.21-0.088)-1/2*N12*(0.21-0.088)=N12*0.122*(1- 1/2)=0.122/2*N12 N301=N12*0.088*0.005+0.79*N012+0.003*N23SO3+0.061*N12 N301=0.06144*N12+0.79*N012+0.003*N23SO3 X6=0.06144*X3+0.79*X2+0.003*X1 (6) N012=X2 N301=X6 Но надо учесть, что N12=N012, т.е. X2=X3 (7) 6 неизвестных и 7 уравнений. Выбрасываем уравнение (3) и получаем систему уравнений: 0  ,94*X1=0.088*X3 ,94*X1=0.088*X30.995*0.088*X3=X4 0.935*X7=2500 0.997*X4=25.51 X6=0.06144*X3+0.79*X2+0.003*X4 X3=X2 0  .94*X1-0.088*X3=0 .94*X1-0.088*X3=00.0876*X3-X4=0 X7=2673.8 X4=25.59 0.85144*X3+0.002*X4- X6=0 0  .94*X1-0.088*X3=0 .94*X1-0.088*X3=00.0876*X3-25.59=0 X7=2673.8 X4=25.59 0.85144*X3+0.002*25.59-X6=0  0.94*X1-0.088*X3=0 X3=292.12 X7=2673.8 X4=25.59 0.85144*X3+0.0512-X6=0 0  .94*X1=0.088*292.12 .94*X1=0.088*292.12X3=292.12 X7=2673.8 X4=25.59 0.8558*292.12+0.041-X6=0 X  1=27.35=N011 1=27.35=N011X3=292.12=X2=N12=N012 X7=2673.8=G301 X4=25.59=N23SO3 X6=250.04=N301 1.Количество целевого продукта: X7=G301=2673.8 кг 93.5% серной кислоты 2. Расход серы: X1=N011=27.35 кмоль ms=Ns*MS=27.35*32=875.2 кг GSнач=875.2/0.94=931.06 кг было введено в систему 3. Расход воздуха: X2=X3=N012=257.23 кмоль Gвозд=Nвозд*Mвозд=292.12*29=8471.48 кг 4.Определение расхода кислорода и азота GO2=8471.48*0.21=1779.01 кг GN2=8471.48*0.79=6692.47 кг
X3=N12=292.12 кмоль N12SO2=292.12*0.088=25.71 кмоль GSO2=NSO2*MSO2=25.71*64=1645.44 кг
X4=N23SO3=25.59 кмоль GSO3=NSO3*MSO3=25.59*80=2047.2 кг
G03=G301*MH2O/MH2SO4=2673.8*18/98=491.09 кг
X6=N301=250.04 кмоль G301=G301SO2+G301N2+G301SO3+G301O2=1645.44*0.005+6692.47+0.003*2047.2+0.061*8471.48=8.23+6692.47+6.14+516.76= 7223.6 кг 3.Материальный баланс.
Список литературы.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
