Курсовая работа. Каталитическая очистка хвостовых нитрозных газо. Курсовая работа Каталитическая очистка хвостовых нитрозных газов. Вариант Студент Карлов В. В. группа и41
 Скачать 292 Kb. Скачать 292 Kb.
|
|
Московский Государственный Университет Инженерной Экологии Курсовая работа Каталитическая очистка хвостовых нитрозных газов. Вариант № 5. Студент Карлов В.В. группа И-41 Преподаватель Василевская М.В. Москва 2005. РАСЧЁТ КАТАЛИТИЧЕСКОГО РЕАКТОРА ОЧИСТКИ ОТХОДЯЩИХ НИТРОЗНЫХ ГАЗОВ В ПРОИЗВОДСТВЕ АЗОТНОЙ КИСЛОТЫ ПОД ДАВЛЕНИЕМ Загрязнение атмосферы оксидами азота (NO)Х производствами различных отраслей промышленности составляет: -тепловые электростанции - 72,5%; -автотранспорт - 17,3%; -черная металлургия - 6,1; -производство строительных материалов - 1,8; -химическая промышленность - 1,7; -нефтеперерабатывающая промышленность – 0,6. Непрерывный рост производства азотной кислоты тесно связан с повышением объема отходящих газов, а, следовательно, с увеличением количества выбрасываемых в атмосферу оксидов азота, которые чрезвычайно опасны для любых живых организмов. Оксиды азота вызывают раздражение слизистой оболочки дыхательных путей, ухудшение снабжения кислородом и другие нежелательные последствия, в том числе, связанные с воздействием на нервную систему человека. Понятно, почему при проведении патентных исследований по процессам очистки газов особое внимание уделяется очистке отходящих газов именно от оксидов азота и оксидов серы. Отходящие газы производства азотной кислоты содержат после абсорбционных колонн от 0,05 до 0,2 % (об.) оксидов азота, которые по санитарным требованиям без дополнительной очистки запрещено выбрасывать в атмосферу. Одним из направлений снижения концентрации оксидов азота в отходящих газах является каталитическое восстановление оксидов азота горючими газами: водородом(Н2), природным газом(СН4), оксидом углерода(СО), аммиаком(NH3). Условия проведения процесса и тип используемого катализатора определяются видом применяемого газа. Рассмотрим подробнее процесс каталитического окисления нитрозных газов. 1. Основы процесса Процесс основан на сжигании оксидов азота на катализаторе с помощью горючих газов. В отличие от других способов очистки в данном случае оксиды азота не улавливаются, а разрушаются, восстанавливаются до элементарного азота. Себестоимость этого способа очистки зависит от стоимости катализатора и газа-восстановителя, механической прочности катализатора, а также сочетания узла каталитической очистки выхлопных газов с аппаратурой основного производства и аппаратурного оформления самого узла каталитической очистки. В качестве катализаторов наиболее широкое распространение получили металлы платиновой группы ( Pt, Pd, Ni, Ag) и некоторые оксиды(Cr2O3, V2O5, и др.), включая природные минералы, представляющие собой сложную комбинацию различных оксидов. В результате исследований установлено, что наиболее подходящим катализатором является таблетированный оксид алюминия (Al2O3), содержащий 2 % масс.палладия(Pd)- катализатор АПК-2. Опытно-промышленные испытания показали возможность полной очистки отходящих газов от оксидов азота при объемной скорости 8000 – 16000 ч-1, соотношения метана к кислороду 0,65 - 0,7 и температуре процесса 750 °С. Температура инициирования реакции на данном катализаторе при применении природного газа составляет 400 °С. Увеличение скорости реакции затруднено из-за отсутствия гибкого регулирования температуры на входе в реактор. Единственной возможностью увеличения скорости реакции остается повышение концентрации метана. Это приводит как к отложению сажи на катализаторе, так и увеличению содержания оксида углерода и не прореагировавшего метана в очищенных газах. Для достижения остаточной концентрации оксидов азота 0,002-0,008 % об. в процессе восстановления поддерживают 10 %-ный избыток природного газа против стехиометрии. В качестве второго слоя в каталитической системе используют оксид алюминия, что позволяет снизить расход палладия. Срок службы катализатора АПК-2 составляет 3 года; потери палладия - 2-5% в год. В течение этого времени содержание оксидов азота в очищенном газе повышается от 0,002 – 0,003 до 0,008 – 0,01 % NОХ при начальном содержании их в очищенном газе порядка 0,1 %. 2. Аппаратурное оформление очистки Принципиальная схема каталитической очистки включает в себя камеру подготовки газа (камера сгорания), камеру смешения и реактор. Конструктивно аппараты на установках каталитической очистки отходящих газов могут использоваться в вертикальном или горизонтальном исполнении. Для примера рассмотрим реактор каталитической очистки (полочного типа). Хвостовые нитрозные газы (рис. 4.1) входят сверху при температуре 400 – 520 °С. Чтобы исключить локальный прогрев корпуса, внутреннюю корзину футеруют слоем каолиновой ваты толщиной 70 – 100 мм. 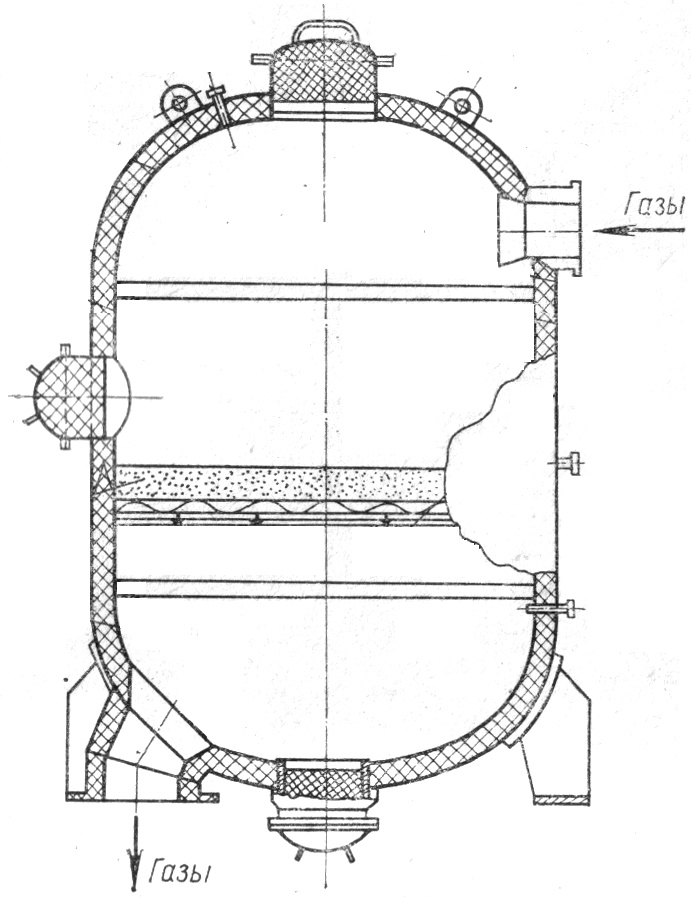 Рис. 4.1. Схема реактора каталитической очистки 3. Расчет реактора 3.1. Физико-химические основы процесса очистки. Процесс каталитической очистки хвостовых нитрозных газов можно описать двумя основными суммарными реакциями: СН4 + 2О2 CO2 + 2H2O + Q (1) СН4 + 4NO СО2 + 2H2O + 2N2+ Q (2) В адиабатических условиях в реакторе с неподвижным слоем катализатора процесс может быть описан системой уравнений [3]: где V- объемный расход газа; С - концентрация соответствующего компонента; F - площадь проходного сечения реактора; W - скорость соответствующей химической реакции; Ср - теплоемкость газовой смеси; H - тепловой эффект химической реакции; l - высота слоя контактной массы. Скорости реакций (1) и (2) выражают в виде зависимостей [3]: Результаты исследований показали, что: k01 = 2,47105; k02 = 1,63109; E1 = 11,8 кДж/моль; E2 = = 78,88 кДж/моль; H1 = 800 кДж; H2 = 956кДж; Ср = 31,2 кДж/(мольК); i= 1,3; m =n = j = 1,0 [5]. Тогда уравнения математической модели процесса можно записать следующим образом: 3.2 Метод решения. Для решения системы дифференциальных уравнений используем метод Рунге-Кутта 4-го порядка. Метод эффективен и реализуется программными средствами. i = 1, 2, 3,…,n 3.3. Исходные данные. ЗАДАНИЕ: - определить высоту слоя контактной массы в каталитическом реакторе для обеспечения концентрации оксида азота в отходящих из аппарата очищенных газах не болев ПДК; - составить материальный баланс для каталитического реактора. В соответствии со списком № 3086-84 [1] максимально разовая ПДК окислов азота в атмосферном воздухе населенных мест; ПДКNO = 0,6 мг/м3 = 0,44810-6 м3/м3 = 0,44810-4 % об. (ПДКNO2 = 0,085 мг/м3 = 0,63410-7 м3/м3 = 0,63410-5 % об.) (14) Исходные данные: диаметр аппарата - 3,6 м объемный расход газа н.у. - 82000 м3/ч, температура на входе в аппарат - 700K начальная концентрация (% об.): метана - 1,4 кислорода - 2,6 оксида азота - 0,13 начальная температура - 700 К шаг по высоте слоя - 0,1 м 3.4. Расчет высоты слоя контактной массы. Результаты расчета по программе для решения системы дифференциальных уравнений, реализующей метод Рунге-Кутта четвертого порядка, приведены далее. Счет по программе заканчивается, когда концентрация NO становится меньше ПДК. Результаты расчета: Высота слоя катализатора h= 0.6 м Концентрации: СО2 = 0,222 % об.; СNO = 2,250 % об.; ССН4 = 0,179 % об. Температура Т = 1014,81 К Таким образом, расчет показывает, что заданная концентрация NO достигается при высоте контактной массы 0,6 м. В этом случае при диаметре контактного аппарата 3,6 м требуется объем контактной массы в 6,107 м3: V=п * d^2 / 4 * h = 3.14 * 3.6^2 / 4 * 0.6 = 6.107 м3 3.5 Материальный баланс каталитического реактора. Известно, что О2 и NO поступают в аппарат с нитрозными газами, имеющими в своем составе также N2, пары воды, NO2, N2O4 и т.п. [3]. Примем для упрощения расчетов, что нитрозные газы состоят из азота и паров воды. Пусть последних после смешения нитрозных газов с метаном в смеси содержится 18 % об., а остальное – азот. Реакции (1)и (2) протекают без изменения объема, суммарные объемы на входе и на выходе из аппарата будут одинаковыми. Концентрация азота в газе на входе в аппарат: У = 100 - (18 + 2,6 + 0,13 + 1,4) = 77,87 % Количества реагентов на входе в аппарат: Объемные расходы: Полученные значения вносим в таблицу 1. Затем по этим величинам с учетом соотношения (8) [1] рассчитаем массовые расходы каждого компонента и определяем суммарный расход смеси. mCH4=1148*0,7143=820,00кг/ч mO2=2132*1,4289=3045,7кг/ч mNO=1,3401*106,6=142,8кг/ч mN2=63853,4*1,25=79816,75кг/ч mH2O=0,804*14760=11860,7кг/ч По вычисленным с помощью ЭВМ значениям концентраций находим объемные расходы газов на выходе из аппарата: По количеству прореагировавшего O2 по реакции (1) определяем количество образовавшихся водяных паров, СО2и израсходованного метана: VH2O=VO2=2132-182,04=1949,96 м3/ч VCO2=VO2 /2=1949,96/2=974,98м3/ч VCH4=VO2 /2=974,98м3/ч Аналогично рассчитаем количества реагентов по реакции(2):VNO=(106,6-0,01845)=106,58155 м3/ч VH2O= VN2= VNO/2=(106,6-0,01845)/2=53,29м3/ч VCO2=VH2O/2=53,29/2=26,645м3/ч VCH4=26,645м3/ч Количество метана на выходе из реактора может быть определено: VCH4=1148-(974,98+26,645)=146,375 м3/ч mCH4=146,375*0,7143=104,56 кг/ч mO2=1,4289*182,04=260,12кг/ч mNO=1,3401*0,01845=0,0247кг/ч Находим количество прореагировавших веществ: mNO=142,8-0,0247=142,743кг/ч mO2=3045,7-260,12=2785,58 кг/ч Находим количество образовавшихся веществ: 64 44 36 СН4 + 2О2 CO2 + 2H2O + Q 2785,58 Х1 У1 Х1=2785,58*44/64=1915,08 кг/ч У1=2785,58*36/64=1566,89кг/ч 120 44 36 56 СН4 + 4NO СО2 + 2H2O + 2N2+ Q 142,743 Х2 У2Z2 Х2=142,743*44/120=52,34 кг/ч У2=142,743*36/120=42,82кг/ч Z2=142,743*56/120=66,61кг/ч mCO2= Х1 + Х2 =1915,08+52,34=1967,42кг/ч mH2O=У1+У2+11860,7=1566,89+42,82+11860,7=13470,41кг/ч mN2= Z2+79816,75=66,61+79816,75=79883,36 кг/ч Объем катализатора V=*D2*h/4=3,14*3,62*0,6/4=6,107 м3. Таблица1.
Выводы. В ходе проделанной работы была определена высота слоя контактной массы в каталитическом реакторе для обеспечения концентрации оксида азота в отходящих из аппарата очищенных газах не более ПДК – 0,6м и составлен материальный баланс для каталитического реактора. Список литературы
4. Бондарева Т.И. Экология химических производств. М.: МИХМ, 1986. | ||||||||||||||||||||||||||||||||||||
