Курсовая работа методы обнаружения и количественного определения биологически активных веществ выполнил студент
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
ГЛАВА II. ПРИНЦИПЫ И МЕТОДЫ БИОХИМИЧЕСКОГО АНАЛИЗА БИОГЕННЫХ ВЕЩЕСТВ 2.1. Основные теоретические положения биохимического анализа Биохимические исследования имеют целью выяснение молекулярных основ функционирования клетки и всех протекающих в ней процессах. Так как речь идёт о сложных превращениях, связанных в том числе, и с изучаемыми нами БАВ, необходимо чётко планировать эксперимент на всех его этапах. Изучение экспериментального материала включает прохождение следующих этапов:
Идентификация исследуемого вещества проводится путём качественных реакций [21]. Определив основные действующие группы вещества можно предположить классовую принадлежность и основные физиологические свойства исследуемого материала. Качественные реакции на белки. Методы качественного обнаружения белков основаны на двух типах реакций: а) по пептидным связям белковой молекулы; б) по аминокислотным радикалам ее. Примером реакции первого типа служит биуретовая реакция. Примером реакций второго типа являются многочисленные цветные реакции на радикалы аминокислот (реакция Сакагучи — с α-нафтолом, реакция Паули - с нитритом калия, реакция Циммермана — с о-фталевым диальдегидом, нингидриновая реакция и др.) Биуретовая реакция. К 1-2 мл раствора белка прибавляют двойной объем 30%-ного раствора гидроксида натрия и хорошо перемешивают. Затем из капельницы добавляют несколько капель 1%-ного раствора сульфата меди и снова хорошо перемешивают. Развивается интенсивное красно - фиолетовое окрашивание, свидетельствующее о наличии пептидных, т.е. -СО-NH-, связей в молекуле белка. При малом содержании белка чувствительность реакции можно повысить, наслаивая на раствор белка в щелочи 1 мл 1%-ного раствора сульфата меди. При стоянии на границе двух слоев появляется фиолетовое кольцо. Для сравнения проводят ту же реакцию с биуретом, который легко может быть получен при нагревании мочевины: 2 H2N-CO-NH2 → +t → NH3 + H2N-CO-NH-CO-NH2 мочевина биурет Для этого несколько кристаллов мочевины помещают в пробирку и осторожно прокаливают в пламени газовой горелки. По охлаждении приливают в пробирку 10%-ный раствор гидроксида натрия и добавляют несколько капель 1%-ного раствора сульфата меди. После перемешивания развивается сине-фиолетовая окраска. Две молекулы диенольной формы биурета взаимодействуют с гидроксидом меди (II) и образуют комплексное соединение, в котором координационные связи образованы за счет электронных пар атомов азота иминных групп. Аналогично построено комплексное соединение меди с енолизированными пептидными группами полипептида. Комплексы такого типа обладают преимущественно красной окраской (максимум поглощения в пределах 520-530 нм). В случае образования медных комплексов при участии трех или двух атомов азота окраска их преимущественно фиолетовая и синяя (с максимумами поглощения в пределах 540-580 нм и 615-670 нм соответственно). Поэтому окраска растворов при проведении биуретовой реакции варьирирует от синей до красной с преобладанием фиолетовой. Нингидриновая реакция. К 1-2 мл разбавленного раствора белка приливают 3-4 капли 1%-ного раствора нингидрина в 95%-ном растворе ацетона. Раствор перемешивают и ставят в водяную баню при 70°С на несколько минут. Развивается сине-фиолетовое окрашивание. Эта реакция обнаруживает в растворе α-аминокислоты. Сначала в результате взаимодействия аминокислоты с нингидрином возникает Шиффово основание. Затем оно претерпевает перегруппировку, декарбоксилируется и расщепляется на альдегид и аминодикетогидринден. Аминодикетогидринден конденсируется еще с одной молекулой нингидрина, и образовавшееся соединение, енолизируясь, переходит в окрашенную форму, получившую название «сине-фиолетовый Руэмана», по имени исследователя, впервые в 1910 г. изучившего эту реакцию [15]. Ксантопротеиновая реакция. К 1 мл раствора белка добавляют 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свернувшегося белка. При нагревании раствор и осадок окрашиваются в ярко-желтый цвет. При этом осадок почти полностью растворяется. Охлаждают смесь и осторожно добавляют к раствору, имеющему кислую реакцию, не взбалтывая, по каплям избыток концентрированного раствора аммиака или щелочи до щелочной реакции. Выпадающий вначале осадок кислотного альбумината растворяется, и жидкость окрашивается в ярко-оранжевый цвет. Ксантопротеиновая реакция происходит только при наличии в белках остатков ароматических аминокислот (фенилаланина, тирозина, триптофана). Желатина, например, не содержит ароматических аминокислот и поэтому она не дает ксантопротеиновой реакции. В результате реакции нитрования по радикалам ароматических аминокислот образуются желтоокрашенные нитросоединения. Изменение желтой окраски в оранжевую в щелочной среде обусловлено появлением хромофорной группы. Реакция Сакагучи. Берут в пробирку 2-3 мл разбавленного раствора белка, добавляют 1 мл 10%-ного раствора гидроксида натрия и вслед за этим несколько капель 0,2%-ного спиртового раствора α-нафтола. Перемешивают, приливают 0,5 мл раствора гипобромида натрия и вновь перемешивают. Развивается оранжево-красное окрашивание. Появление окраски объясняется взаимодействием α-нафтола в присутствии окислителя с гуанидиновыми группировками радикалов аргинина, имеющимся в молекуле белка. Нитропруссидная реакция. К 3 мл разбавленного белка приливают равный объем насыщенного раствора сульфата аммония 2-3 капли 5%-ного раствора нитропруссида натрия. Затем раствор подщелачивают несколькими каплями крепкого раствора аммиака. Если в белке присутствует цистеин, то происходит реакция, в результате которой развивается пурпурное окрашивание. Реакция Паули. К 1 мл 1%-ного раствора сульфаниловой кислоты в 0,5%-ном растворе соляной кислоты приливают 2 мл 0,5%-ного раствора нитрита натрия, сильно встряхивают и немедленно добавляют сначала 2 мл разбавленного раствора белка, а затем, после перемешивания содержимого пробирки, 6 мл 10%-ного раствора карбоната натрия. После смешивания растворов развивается вишнево-красное окрашивание. Возникновение окраски обусловлено наличием в белковой молекуле остатков гистидина и тирозина. Качественные реакции на углеводы. Реакция Подобедова-Молиша с α-нафтолом. Чувствительной реакцией на углеводы является реакция с α-нафтолом. Испытуемое вещество в твердом виде или в растворе должно быть свободно от волокон фильтровальной бумаги. В пробирку берут 1 мл испытуемого раствора или крупинку твердого вещества, растворенного в 1 мл воды. Добавляют 2 капли 10%-ного спиртового раствора α-нафтола и по стенке пробирки приливают осторожно, без встряхивания, 2 мл концентрированной серной кислоты. Серная кислота опускается на дно пробирки, и на границе двух жидкостей образуется кольцо красно-фиолетового цвета. Фурфурол и 5-оксиметилфурфурол, образующиеся из углеводов под действием серной кислоты, конденсируясь с 2 моль сульфированного α-нафтола, дают триарилметановый хромоген, который окисляется серной кислотой в окрашенное хиноидное соединение. Нафторезорциновая проба Толленса. К 5-6 мл испытуемого раствора прибавляют 1 мл 1%-ного спиртового раствора нафторезорцина и такой же объем концентрированной соляной кислоты. Смесь осторожно нагревают до кипения и кипятят 1 мин. Затем охлаждают и взбалтывают с эфиром или бензолом. Эфирный (бензольный) слой окрашивается в различные цвета: глюкоза, манноза, галактоза дают сине-зеленую окраску; рамноза – фиолетовую; арабиноза и ксилоза – темно-синюю; уроновые кислоты, для обнаружения которых часто применяется эта реакция, окрашивает эфирный слой в фиолетовый цвет. Пробы на редуцирующие (восстанавливающие) сахара. Реакция Троммера. Моносахариды в щелочной среде восстанавливают гидроксид меди (II) до гидроксида меди(I), окисляясь при этом до альдоновых кислот. В пробирку наливают 1-2 мл раствора глюкозы и равный объем 10%-ного раствора гидроксида натрия. К смеси прибавляют при встряхивании по каплям 5%-ный раствор сульфата меди(II) до появления неисчезающей мути. Осторожно нагревают верхнюю часть содержимого пробирки. Появляется желтое окрашивание (гидроксид меди(I)), переходящее в оранжево-красное (оксид меди (I)), что указывает на положительную реакцию Троммера. Реакция с фелинговой жидкостью. Фелингова жидкость содержит ион меди(2+) в виде комплекного соединения с тартратами. Механизм реакции редуцирующих углеводов с фелинговой жидкостью такой же, как и реакции Троммера. Преимуществом фелинговой жидкости является то, что медь при избытке реактива не выпадает в виде оксида меди(II). К 1-2 мл раствора глюкозы приливают равный объем фелинговой жидкости и смесь нагревают до начинающегося кипения. Образуется красный осадок оксида меди(I). Приготовление Фелинговой жидкости: Готовят два раствора. А — 34,6 г медного мупороса в 500 мл раствора; И - 173 г сегнетовой соли и 70 г гидроксида натрия в 500 мл раствора. Растворы хранят раздельно. Перед употреблением смешивают равные объемы первого и второго раствора. Реакция Селиванова на кетозы. При нагревании фруктозы (и других кетогексоз) с соляной кислотой образуется оксиметилфурфурол, который с резорцином образует соединение, окрашенное в вишнево-красный цвет. Альдозы также дают эту реакцию, но реакция у них протекает медленнее и в особых условиях (температура и кислотность среды). В две пробирки наливают по 3 мл реактива Селиванова (0,05 г резорцина растворяют в 100 мл разбавленной (1:1) соляной кислоты), в одну из них добавляют 3 капли раствора фруктозы, в другую - 3 капли раствора глюкозы. Обе пробирки помещают в водяную баню, нагретую до 80ºС, и держат в ней 8 минут. За это время в пробирке с фруктозой появляется красное окрашивание. Реакция Барфеда (отличие восстанавливающих дисахаридов от моносахаридов. Проба Барфеда отличается тем, что окисление сахара протекает не в щелочной среде, а в среде, близкой к нейтральной. В этих условиях редуцирующие дисахариды в противоположность моносахаридам практически не окисляются, что позволяет отличить их от моносахаридов. К 5 мл раствора Барфеда прибавляют 1 мл раствора исследуемого сахара. Смесь нагревают на водяной бане в течение 10 мин. Моносахариды восстанавливают реактив до оксида меди(I), дисахариды реакции не дают. Следует избегать длительного кипячения, так как дисахариды в кислой среде могут гидролизоваться до моносахаридов, и в результате реакция Барфеда станет положительной. Приготовление реактива Барфеда. 13, 3 г ацетата меди растворяют в 200 мл горячей воды. Фильтруют и к фильтрату прибавляют 1,9 мл ледяной уксусной кислоты. Реакция крахмала и гликогена с иодом. К 2-3 мл раствора крахмала прибавляют 1-2 капли раствора Люголя. Раствор окрашивается в синий цвет. Содержимое пробирки делят на три части: к первой прибавляют 1-2 мл 10%-ного раствора гидроксида натрия, ко второй — 2 мл этилового спирта; третью часть нагревают. Во всех случаях окраска исчезает, причем в третьей пробе окраска вновь появляется при охлаждении. Реакция основана на образовании нестойкого адсорбционного соединения иода с амилозой. В пробирку наливают 2-3 мл раствора гликогена, добавляют 1-2 капли раствора Люголя, перемешивают, появляется красно-бурое окрашивание. Окраска усиливается при добавлении нескольких кристаллов хлорида натрия, но исчезает при добавлении раствора гидроксида натрия при нагревании. Раствор Люголя готовят растворением 1 г иода и 2,5 г иодида калия в 20 мл воды. по растворении объем раствора доводят до 100 мл. Микрохимическое определение сахаров путем окисления периодатом. Аналитическая ценность иодной кислоты заключается в том, что она окисляет все вторичные карбинольные группы в молекуле сахара до муравьиной кислоты, которая определяется титрованием, а первичные карбинольные группы — формальдегида, который может быть связан димедоном: СНO-(СНОН)4-СН2ОН + IO3- -- → 5 HCOOH + H2CO + 5 IO3- Пентозы и метилпентозы образуют по 4 моль муравьиной кислоты, гексозы — по 5 моль, фруктоза и сорбоза — по 3 моль. В пробирку с пришлифованной пробкой помещают около 3 мг сахара и растворяют его в 5 мл воды. К полученному раствору добавляют 1мл 0,25 М раствора периодата натрия.Смесь нагревают в течение 30 мин на кипящей водяной бане. После охлаждения пробирки добавляют 0,2 мл этиленгликоля для разложения избытка периодата. Одновременно ставят контрольный опыт, в котором присутствуют все реагенты, кроме сахара. Раствор титруют 0,01 н раствором гидроксида натрия, применяя в качестве индикатора метиловый красный. Качественные реакции на жиры. Методы выделения жиров. Обычно липиды извлекают из высушенных (обезвоженных) тканей соответствующими органическими растворителями (спирты, эфиры, бензол, толуол, бензин, ацетон, пиридин, хлороформ, четыреххлористый углерод, сероуглерод, петролейный эфир и др.). Для разделения липидов пользуются неодинаковой растворимостью их в различных растворителях: одни из них хорошо растворимы в эфире, но плохо в ацетоне (например, фосфолипиды), другие растворимы в бензоле, но не растворимы в спирте (холестерол, цереброзиды) и т.д. Резервный жир (масло) извлекается легко. Извлечь связанные липиды можно лишь после разрушения белково-липидных комплексов. Липиды из связанного состояния в свободное переводят либо путем применения гидролизующих средств, либо путем предварительного кипячения материала со спиртом. В последнем случае липиды выделяются в неизменном виде. Наиболее простым методом определения суммарных липидов в тканях является метод длительного настаивания навесок ткани в хлороформ - метанольной смеси. По разности масс образца до и после экстракции находят процентное содержание липидов. При выделении липидов из биологического материала происходит их окисление и деградация, приводящие к образованию побочных продуктов. Поэтому выделение липидов надо проводить быстро, в условиях, максимально исключающих влияние таких факторов, как повышенная температура, кислород воздуха, свет, загрязнение следами металлов и т.д. Для экстракции используют смесь метанола и хлороформа, которая разрушает липопротеидные комплексы и тем самым дает возможность достаточно полно извлечь липиды. Определение ионов железа в пищевых продуктах. Железо является одним из элементов человеческого организма. В случае большого недостатка железа в организме возникает заболевание – железодефицитная анемия (малокровие), так как основная часть входящего в состав организма железа сосредоточена в красных кровяных тельцах (эритроцитах), каждая из которых содержит 280 млн. молекул гемоглобина – дыхательного пигмента. Железо содержится в мышечном белке, во многих ферментах. Главное депо железа – печень: здесь у взрослого человека может быть запасено до 1 г железа. В организме взрослого человека всего 3,5 г железа. Избыточное количество железа приводит к образованию нерастворимого в воде железосодержащего белка. Этот белок уже не может быть использован организмом и, откладываясь в тканях и органах, вызывает нарушение их функций и приводит к заболеванию. Ионы железа были обнаружены в молоке, клубничном соке, соке красной смородины, соке черной смородины, соке крыжовника, яблочном соке, соке крапивы, в гречневой крупе, мясном соке, в шоколаде, в меде, кураге, изюме, говяжьей печени, фасоли. Для обнаружения иона железа в молоке 50 мл его упаривают до объема 5-7 мл. Мед и шоколад берут на кончике ножа и растворяют в 2 мл воды. Чайную ложку гречневой крупы размельчают в ступке, кипятят с 10 мл воды, отфильтровывают. Фильтрат упаривают до объема 2 мл. На хроматографическую бумагу, на расстоянии 1 см от края, на линию старта наносят капилляром каплю 1-3%-ного раствора хлорида железа(III) в качестве свидетеля. Диаметр пятен должен быть не более 5 мм. На расстоянии 1 - 1,5 см от этого пятна наносят на линию старта исследуемые вещества: каплю сока яблока, сока клубники, красной смородины, крыжовника и др. Для большего концентрирования ионов железа пробу сока наносят несколько раз, касаясь капилляром одного и того же места на стартовой линии и дожидаясь улетучивания растворителя из предварительной пробы. Опускают приготовленную хроматограмму с нанесенными пробами в прибор для бумажной хроматографии так, чтобы смесь растворителей (элюент), состоящая из этанола и разбавленной вдвое соляной кислоты в соотношении 1:4, касалась нижнего края бумаги, но была не выше стартовой линии. Наблюдают за подъемом элюента по бумаге. Вынимают хроматограмму из камеры, когда фронт элюента будет находиться на расстоянии 0,5 см от верхнего края хроматограммы. Слегка подсушивают ее и опрыскивают из пульверизатора 10%-ным раствором гексациано-(II)-феррата калия для обнаружения ионов Fe3+ вначале в том месте, куда должен был «пробежать» хлорид железа(III), а затем на этом же расстоянии от линии старта и остальные пробы. Появляется синее окрашивание – образование берлинской лазури. Хроматографическая подвижность ионов железа(III) – Rf =0,87 – близка к единице. Определение ионов железа как связанного с витамином С элемента важно для наших дальнейших исследований витаминоминеральной диеты при железодефицитной анемии (позволит проанализировать реакции витамина С с действующим препаратом трёхвалентного железа). 2.2. Физико-химические методы исследования структуры вещества Многие БАВ изучаются в растворённом виде. Молекулы, играющие важную роль в биохимических процессах, являются слабыми электролитами, т. е. кислотами или основаниями, которые в водных растворах ионизированы лишь частично. В качестве примеров можно назвать аминокислоты, пептиды, белки, нуклеозиды, нуклеотиды, нуклеиновые кислоты. Активность многих из перечисленных молекул находится в строгой зависимости от их состояния ионизации при том рН, которое имеет место внутри клетки или за ее пределами. Например, активные центры ферментов содержат функциональные группы — карбоксильные и аминогруппы боковых цепей аминокислот, из которых построены молекулы данного белка. Для осуществления каталитической функции ферментов эти функциональные группы должны находиться в строго определенном состоянии ионизации. Прежде чем перейти к детальному рассмотрению ионизации (диссоциации) сложных молекул, следует остановиться на диссоциации воды и сказать несколько слов о важности этого процесса [17]. Один из важнейших слабых электролитов — вода. Степень диссоциации воды незначительна, так что в ней присутствует очень небольшое количество ионов водорода и ионов гидроксила. На самом деле свободный ион водорода (протон) в водном растворе не существует, поскольку он взаимодействует с молекулой воды, образуя ион гидроксония (Н3О+): Н2О = Н+ + НО– Н+ + Н2О = Н3О+ Однако несмотря на то что свободных протонов в водном растворе нет, на практике принято говорить именно о ионах водорода, а не гидроксония. Для диссоциации воды при 24 °С константа равновесия составляет 1,8 · 10–16. Раствор с определённым устойчивым количеством водородных ионов называется буферным. Именно буферные растворы исследуются при анализе БАВ (Н.Ю.Громова, 2006). В качестве буферных смесей могут быть использованы системы:
СН3СООН = СН3СОО- + Н+
NH4OH = NH4+ +OH-
HCO3- = CO32- + H+ Значение pH буферных растворов можно рассчитать по формулам [18]: где НА – кислота, ВОН – основание, а ВА – соль. Работа со структурой в буферных системах даёт возможность проводить контролируемые качественные реакции, что важно для определения нахождения вещества в растворе и его выделения. При этом некоторые вещества, такие как витамин С в том числе можно исследовать и физическими методами [13] напрямую из сырья, представленными в таблице 3. Таблица 3 Физические и физико-химические методы определения структуры вещества и выделения из исследуемого материала
Прованализировав методы физико-химического определения структуры вещества, мы пришли к выводу, что метод центрифугирования эффективен для первичной обработки неизвестного образца. Если мы предполагаем наличие углеводных структур, то нецелесообразно применять методы электрофореза, являющиеся экономичными и информативными при работе с другими классами. Метод хроматографии является наиболее точным, но трудоёмким. Хроматографические методы рационально применять при изучении специфических групп, в том числе биологически активных веществ – витаминов. 2.3. Методы выделения биологически активных веществ белкового строения Получение индивидуальных белков и белковых структур из биологического материала (тканей, органов, клеточных культур) часто требует проведения последовательных операций, включающих физические, физико-химические и химические методы [17]. Для разрушения биологического материала используют методы: 1. Гомогенизация биологического материала. Ткань, находящуюся в буферном растворе с определённым значением рН и концентрацией солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда. 2.Метод замораживания и оттаивания ткани. В результате попеременного замораживания и оттаивания образующиеся кристаллы льда разрушают оболочки клеток. После разрушения ткани нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля клетки. Искомый белок будет содержаться в одной из этих фракций. Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты [10]; чаще всего используют тритон Х-100 или додецилсульфат натрия. При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протомерами в олигомерных белках. 3. Нуклеиновые кислоты, липиды и другие небелковые вещества можно удалить из раствора, используя их особенные физико-химические свойства. Так, липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина [12]. Методы очистки белков и белковых структур - наиболее трудоёмкий этап получения индивидуальных белков - их очистка от других белков, находящихся в растворе, полученном из данной ткани. Часто изучаемый белок присутствует в небольших количествах, составляющих доли процента от всех белков раствора. На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка. Большинство белков денатурирует и выпадает в осадок уже при кратковременном нагревании раствора до 50-70 °С или подкислении раствора до рН 5. Если выделяемый белок выдерживает эти условия, то с помощью избирательной денатурации можно удалить большую часть посторонних белков, отфильтровав выпавшие в осадок-белки, или осадить их центрифугированием. Основные методы очистки белка и белковых структур: 1. Высаливание - метод очистки белков и белковых структур, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства. Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания. 2. Гель-фильтрация, или метод молекулярных сит (рис. 5). 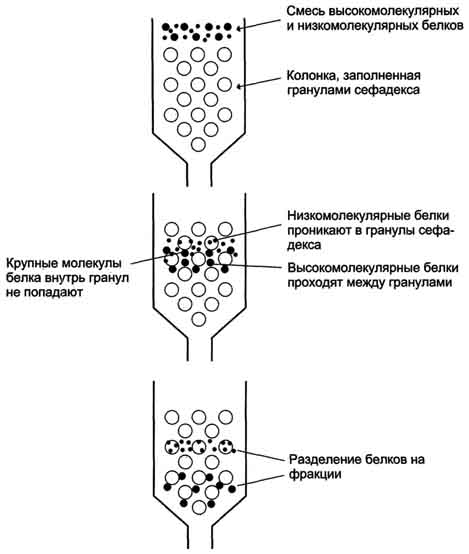 Рисунок 5. Принцип работы молекулярных сит Для разделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического [3]. Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор". Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы. Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул. 3. Ультрацентрифугирование – это метод разделения также основан на различии в молекулярных массах белков и белковых структур. Скорость седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает 100 000-500 000 g, пропорционально их молекулярной массе. На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой. После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки. Проанализировав данные, мы пришли к выводу, что при работе со структурой витаминов, в числе которых исследуемый нами витамин С, из физический методов подходит разновидность хроматографических методов – гель-фильтрация, при которой разделение на белковые фракции через молекулярные сита позволяет получить максимально точные образцы. |
