|
|
Курсовая работа на тему Производство Метанола Вариант студент Рудакова Е. В. группа м32
3. Характеристика целевого продукта. СВОЙСТВА МЕТАНОЛА И ЕГО ВОДНЫХ РАСТВОРОВ.
Метиловый спирт, метанол СНзОН является простейшим представителем предельных одноатомных спиртов. В свободном состоянии в природе встречается редко и в очень небольших количествах (например, в эфирных маслах). Его производные, наоборот, содержатся во многих растительных маслах (сложные эфиры), природных красителях, алкалоидах (простые эфиры) и т. д. При обычных условиях это бесцветная, легколетучая, горючая жидкость,. иногда с запахом, напоминающим запах этилового спирта. На организм человека метанол действует опьяняющим образом и является сильным ядом, вызывающим потерю зрения и, в зависимости от дозы, смерть.
Физические характеристики метанола при нормальных условиях. следующие:
Молекулярный вес ............ 32,04
Плотность, г/см8 ............. 0,8100
Вязкость, мПа-с ............. 0,817
Температура кипения, °С ......... 64,7
Температура плавления, °С ........ —97,68
Теплота парообразования, ккал/моль .... 8,94
Теплота сгорания, ккал/моль
жидкого ............... 173,65
газообразного............. 177,40
/
Плотность и вязкость метанола уменьшаются при повышении? температуры таким образом:
—40 °С —20 °С О °С 20 °С 40 °С 60 °С
Плотность, г/см3 ....... 0,8470 0,8290 0,8100 0,7915 0,7740 0,7555.
Вязкость, мПа.с. ...... 1,750 1,160 0,817 0,597 0,450 0,350
Метанол при стандартных условиях имеет незначительное давление насыщенных паров. При повышении температуры давление насыщенных паров резко увеличивается".' Так, при увеличении температуры с 10 до 60 °С давление насыщенных паров повышается от 54,1 до 629,8 мм рт. ст., а при 100 °С оно составляет 2640 мм рт. ст. углеводородами. Он хорошо поглощает пары воды, двуокись углерода и некоторые другие вещества.
Следует указать на способность метанола хорошо растворять большинство известных газов и паров. Так, растворимость гелия, неона, аргона, кислорода в метаноле при стандартных условиях выше, чем растворимость их в ацетоне, бензоле, этиловом спирте, циклогексане и т. д. Растворимость всех этих газов при разбавлении метанола водой уменьшается/ Высокой растворимостью газов широко пользуются в промышленной практике, применяя метанол и его растворы в качестве поглотителя для извлечения примесей из технологических газов.
Свойства растворов метанола в смеси с другими веществами значительно отличаются от свойств чистого метилового спирта. Интересно рассмотреть изменение свойств системы метанол—вода. Температура кипения водных растворов метанола закономерно увеличивается при повышении концентрации воды и давления (см. Приложение, стр. 114). Температура затвердевания растворов по мере увеличения концентрации метанола понижается: —54 °С при содержании 40% СНзОН и —132°С при 95% СНзОН.
Плотность водных растворов метанола увеличивается при понижении температуры и почти равномерно уменьшается с увеличением концентрации метанола от плотности воды до плотности ''спирта при измеряемой температуре (см. Приложение, стр. 114). Зависимость вязкости от концентрации метанола имеет при всех исследованных температурах максимум при содержании СНзОН около 40%. В точке максимума вязкость раствора больше вязкости чистого метанола.
! Метанол смешивается во всех отношениях со значительным числом органических соединений. Со многими из них он образует азеотропные смеси — растворы, перегоняющиеся без изменения состава и температуры кипения, т. е. без разделения; К настоящему времени известно свыше 100 веществ, в числе которых имеются и соединения, обычно присутствующие в метаноле-сырце. К этим веществам, например, относятся ацетон, метилацетат, метилэтилкетон, метилпропионат и некоторые другие. Необходимо отметить, что азеотропные смеси с содержанием таких соединений, как ме-тилэтилкетон, метилпропионат, пропилформиат, изобутилформиат и ряд других имеют температуру кипения, близкую к температуре кипения чистого метанола (62—64,6 °С).
'Метанол сочетает свойства очень слабого основания и еще более слабой кислоты, что обусловлено наличием алкильной и гидро-ксильной групп. При окислении метанола кислородом в присутствии катализатора образуется формальдегид:
СНзОН + 0,5СО2 ——»- НСНО + Н2О
На этой реакции основан широко применяемый в промышленности метод получения формальдегида, который используют в производстве пластических масс. При действии щелочей металловводород гидроксильной группы метанола замещается с образованием алкоголята
2СНзОН + 2Na ——> 2CH3ONa + 2Н2
который стоек только в отсутствие воды, так как вода омыляет его до метанола и щелочи:
СНэОNa + Н2О ——»- СНзОН + NaOH
С аммиаком метанол образует метиламины:
СНзОН + NH3 ——> CH3NH2 + Н2О
СНзОН + СНзNН2 ——> (CH3)2NH2 + Н2О
CH3OH + (СНз)2NH2 ——> (СН3)3NH2 + Н2О
Эти реакции протекают в паровой фазе в присутствии катализаторов при 370—400 °С и повышенных давлениях..
Дегидратацией на катализаторе при повышенных температурах получают диметиловый эфир:
2СН3ОН ——> (СНз)2О + Н2О
При взаимодействии метанола и минеральных кислот образуются сложные эфиры. .Этот процесс называется этерификацией, и его широко используют в промышленной практике для получения различных метиловых эфиров — метилхлоридов, метилбромидов, метилнитратов, метилсульфатов и др.:
СНзОН + H2SO4 ——>- СНзSОзОН + Н2О
Органические кислоты также реагируют с метанолом с образованием сложных эфиров:
СНзОН + СНзСООН ——> СНзСООСНз + Н2О
4. Физико-химическое обоснование основных процессов производства целевого продукта.
.
Равновесие реакции образования метанола. Процесс получения метанола основан на взаимодействии водорода и окиси углерода:
2Н2 + СО СНзОН + 21,67 ккал
Реакция может протекать как в прямом, так и в обратном направлениях.
В соответствии с законом действующих масс скорость любой химической реакции пропорциональна произведению концентраций
реагирующих веществ. Тогда скорости прямой и обратной реакций выразятся уравнениями
1 = k1 [Н2]2 [СО] 2 = к2 [СНзОН]
где [Hz], [СО] и [СНзОН]—концентрации водорода, окиси углерода и метанола; k1, kz—константы скорости прямой и обратной реакций, значения которых зависят от температуры/
При условии равновесия скорости прямой и обратной реакций становятся равными
k1 [Н2]2 [СО] = к2 [СНзОН] откуда:
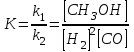
где К—константа равновесия реакции.
Значение константы равновесия необходимо для расчета равновесного выхода метанола. Равновесный выход—это теоретический максимальный выход метанола, который может быть получен из водорода и окиси углерода, .взятых при данных концентрациях, температуре и давлении процесса. Константу равновесия можно определить как теоретическим, так и экспериментальным путем.
Константа равновесия может быть представлена в различных единицах измерения.
Давление. В технических расчетах обычно пользуются выражением константы равновесия через парциальное давление компонентов.
.
При повышении давления и понижении температуры равновесие сдвигается в сторону увеличения выхода метанола. В промышленных условиях синтез метанола осуществляется из газовой смеси, содержащей кроме водорода и окиси углерода также двуокись углерода. Поэтому при расчете равновесия синтеза метанола из смеси газов Н2—СО—COz необходимо учитывать следующую реакцию:
СО2 + Н2( г)—> СО + Н2О — 9,8 ккал ;
Равновесный выход метанола, степень превращения окиси и двуокиси углерода в значительной мере меняются в зависимости от давления, температуры, отношения Н2: СО и содержания двуокиси углерода в газе. Влияние давления и температуры на равновесный выход метанола определено для следующего состава газа: 1,25 объемн.% СОа; 10,6 объемн.% СО; 74,2 объемн.% Нд;-13,95 объемн.% (CH4+Nz).
Давление. При повышении давления выход метанола почти прямо пропорционально увеличивается и резко возрастает степень превращения окиси/и двуокиси углерода (при 380°С):
Давление, кгс/см2 .......... 50 100 200 300 400
Выход СНэОН, объемн. %...... 0,37 1,56 5,54 9,31 11,68
Следует заметить, что с увеличением давления более резкий рост равновесного выхода метанола наблюдается при повышенных температурах. Так, при изменении давления от 50 до 300 кгс/см5 равновесный выход метанола при 280 °С увеличивается в 2,4 раза а дри 380 °С — в 2,3 раза (отношение Hz : СО =4 : 1).
Температура. С повышением температуры равновесный выход
метанола понижается. Наиболее резкое понижение наблюдается при температурах выше 340°С. В этих условиях (при 300 кгс/см2) начинает снижаться степень превращения окиси и двуокиси угле рода в метанол, причем более резко окиси углерода:
Температура, °С ....... 250 300 340 360 380 400
Выход метанола, объемн. %. . 15,44 14,81 12,88 11,37 9,31 7,40 Степень превращения, %
СО ........... 99,75 97,20 87,52 78,96- 66,19 53,29
СОз ........... 98,00 89,80 77,00 71,50 66,61 64,00
При давлении 50 кгс/см2 и повышении температуры от 180 дс 300 °С равновесный выход метанола снижается более чем в 7 pa;
(отношение Н2 :СО=3,6, содержание двуокиси углерода 6,0 объемн. %). При этом степень превращения окиси и двуокиси углерода в метанол уменьшается с 75,3 до 14,6%.
При повышении отношения На: СО степени превращения окиси и двуокиси углерода возрастают, причем степень превращения СО2 в большей мере, а равновесный выход метанола снижается. Влияние отношения На : СО на равновесны? выход метанола определено для такого состава газа: 1,25 объемн.% С02; 84,8 объемн. %); 13,95 объемн. % (CI^+Nz). При 300 кгс/см2 и 380 °С равновесный выход метанола и степень превращения окислов углерода в зависимости от отношения Нг: СО меняются следующим образом:
Отношение На:СО . ......... 2 4 8 10 14
Выход СНдОН, объемн. %,..... 17,25 13,80 8,39 7,05 5,40
Степень превращения, %
СО ............... 44,50 60,39 66,85 67,80 67,97
СОа .............. 19,50 45,71 70,52 76,15 82,39
\При увеличении содержания окиси углерода в газе, т. е. уменьшении отношения На: СО, равновесный выход метанола возрастает пропорционально при 50 кгс/см2 и 6 объемн. % СОз). Так, при 8 объемн. % СО, равновесный выход метанола составляет 5,71 объемн. %, при 16 объемн. % СО—11,41 объемн. %, а при 24 объемн, % СО—16,82 объемн. % СНзОН.
Двуокись углерода. Реакция восстановления двуокиси углерода водородом до окиси углерода в промышленных условиях синтеза метанола протекает практически до равновесного состояния, и пренебрегать ею при расчете равновесных выходов метанола нельзя. 'При повышении содержания двуокиси углерода в газе равновесный выход метанола меняется незначительно. Степень превращения
окислов углерода в метанол при этом снижается с 42,2% при 6 обьемн.% СО2 до 32,7% при 12 объемн.% СО2.
Инертные компоненты. В промышленных условиях синтез метанола протекает в присутствии инертных к данному процессу газов (метан, азот). Они в реакции не участвуют и не оказывают прямого влияния на равновесие реакции образования метанола. Однако наличие их в газе снижает парциальное (эффективное) давление реагирующих веществ, что ведет к уменьшению равновесного выхода метанола. Поэтому концентрацию инертных компонентов необходимо поддерживать на минимальном уровне.
На основании изложенного следует отметить, что синтез метанола на цинк-хромовом катализаторе, который работает при 360—380 °С, целесообразно проводить только при давлениях выше 200 кгс/см2. На низкотемпературных катализаторах, эксплуатируемых в температурном интервале 220—280°С, возможна работа при давлениях ниже 100 кгс/см2, причем, чем ниже температура, тем ниже может быть и давления синтеза.
Кинетика синтеза метанола. В гомогенных условиях (без катализатора) скорость взаимодействия окиси углерода и водорода ничтожно мала, и получить метанол в больших количествах невозможно. Для увеличения скорости реакции взаимодействия исходных компонентов используют вещества, которые, способствуя ускорению процесса, сами к концу реакций остаются химически неизменными. Для оценки этого ускорения, или иначе активности катализатора, необходимо знать скорость химического взаимодействия реагирующих компонентов. Если реакция протекает в гомогенных условиях, то скорость ее зависит от температуры, давления и концентрации реагирующих веществ. В гетерогенном, каталитическом процессе скорость реакции будет определяться также типом катализатора и состоянием его поверхности. Синтез метанола является гетерогенным каталитическим процессом, протекающим на границе раздела твердой (поверхность катализатора) и газообразной (смесь окиси углерода и водорода) фаз. До начала реакции окись углерода и водород концентрируются на поверхности катализатора (происходит адсорбция СО и Hz). Суммарный процесс синтеза метанола состоит из следующих стадий: диффузия исходных веществ к поверхности катализатора;
, /адсорбция этих веществ да поверхности катализатора; химическое ^взаимодействие адсорбированных молекул СО и Н2 до метанола;
/ удаление (десорбция) образовавшегося метанола с поверхности катализатора. Скорость процесса образования метанола будет равна скорости реакции в зависимости от начальных условии (температуры, давления, концентрации веществ, времени контакта газа с катализатором) позволило вывести кинетическое уравнение. Последнее используют при моделировании процесса и разработке промышленных реакторов.
В результате изучения скорости химического взаимодействия окиси углерода и водорода на медьсодержащем катализаторе СНМ-1 получено кинетическое уравнение:
„0,34
рсн^он
О) == k 1
где w— скорость реакции, кгс/(см2 • с); ^-—константа скорости прямой реакции; Кр—константа равновесия реакции синтеза метанола; рсо, /?На, JOcHgOH—парциальные давления СО, На и СНзОН, кгс/см2. ;
Проведенные на электронно-вычислительной машине расчеты по кинетическому уравнению показали, что оно хорошо описывает процесс образования метанола.
На катализаторе СНМ-1 и может быть использовано для расчета промышленных реакторов, работающих при 50 Krc/CM'^.Qlo рас- «^ W считанным зависимостям можно определить оптимальные параметры процесса и равновесные условия. Наибольший выход метанола наблюдается при 255— 270° С, что согласуется с экспериментальными данными. С уменьшением парциального давления окиси углерода (повышение отношения Н2:СО) максимум активности катализатора смещается в сторону более низких температур.
Катализаторы синтеза метанола
При взаимодействии окиси углерода и водорода качественный состав продуктов реакции определяется видом используемого катализатора. Так, в зависимости от состава катализатора из окна углерода и водорода при соответствующих условиях (температура, давление и концентрация) можно получить метанол, высшие спирты, углеводороды, альдегиды и кислоты.
При синтезе метанола, кроме основных реакций, протекают следующие процессы:
СО + ЗНг ч—»- СН^ + НдО 2СО + 2Нз •<—>- СН< + СОа 2СО + 4На ^==fc (CHg)20 + НаО 4СО + 8Нг у—^ СДОН + ЗНзО
Метанол может также реагировать с окисью углерода и водородом, образуя ряд побочных веществ.
Основные требования, предъявляемые к катализатору синтеза метанола: высокая активность и селективность (направлять процесс в сторону преимущественного образования метанола), стабильность в работе, стойкость к колебаниям температуры и большая механическая прочность. Катализаторы для синтеза метанола подразделяются на две группы: цинк-хромовые и медьсодержащие (цинк-медь-алюминиевые и цинк-медь-хромовые). На отечественных производствах метанола в основном используют активный / цинк-хромовый катализатор при 250—400 кгс/см2 и 380—400 °С. ' Цинк-хромовый катализатор состоит из окиси цинка и хромита цинка. Химический состав .его следующий: ZnO-ZnCrzO, 3ZnO-ZnCr204, 3,3ZnO-ZnCr20.
В настоящее время внедряется катализатор CMC-4 (Северодонецкий метанольный среднетемпературный). Этот катализатор более активен, чем обычный промышленный цинк-хромовый катализатор; технико-экономические показатели работы на нем предпочтительнее: снижается • расход исходного газа, увеличивается степень превращения окиси и двуокиси углерода, на 5—10 °С снижается температура процесса синтеза.
В последнее время в связи с изменением сырьевой базы (переход на природный газ), совершенствованием методов очистки газа и развитием техники в ряде стран используют цинк-медь-алюминиевые и цинк-медные катализаторы. Катализаторы, имеющие в своем составе медь, более активны, чем цинк-хромовые, причем максимальная активность их наблюдается при 220—260 °С. В силу этой особенности катализаторы на основе меди обычно называют низкотемпературными. Высокая активность их при низких температурах позволяет проводить процесс при давлении ниже 200 кгс/см2, что значительно упрощает аппаратурное оформление. Разработан и освоен в промышленном масштабе катализатор СНМ-1 (Северодонецкий низкотемпературный метанольный). Химический состав невосстановленного образца следующий: 52—54% CuO, 26—28% ZnO, 5—6% AlaOs, насыпная масса* 1,3—1,5 кг/м3, удельная поверхность 80—90 м^г, пористость
50%.
Необходимо отметить, что медьсодержащие катализаторы по сравнению с цинк-хромовыми обладают малой термостойкостью и более чувствительны к каталитическим ядам. Медьсодержащий катализатор быстро снижает активность при перегревах, а в присутствии сернистых соединений образуется неактивный сульфид меди.
Сырье, используемое для производства низкотемпературных катализаторов, должно содержать минимальное количество примесей, поскольку наличие последних снижает селективность контакта и ухудшает качество метанола-сырца (особенно жесткие требования предъявляют к содержанию мышьяка, серы и железа). Поэтому при использовании сырья, загрязненного различными примесями, в том числе и сернистыми соединениями, медьсодержащие катализаторы практически не могут быть применены.
Производство катализаторов состоит из двух основных стадий:
приготовление катализатора и восстановление его до активного состояния. В промышленности цинк-хромовые катализаторы могут быть приготовлены «сухим» и «мокрым» методами.
При «сухом» методе приготовления предварительно измельченные окись цинка и хромовый ангидрид, взятые в определенном соотношении, тщательно перемешивают на бегунах сначала в сухом виде, затем с увлажнением дистиллированной водой. В полученную смесь вводят до 1% мелкодисперсного графита и формуют таблетки размером 5х5 или 9Х9 мм. По так называемому «мокрому» способу к суспензии окиси цинка добавляют раствор хромового ангидрида. Процесс проводят в специальных аппаратах-смесителях с последующим отделением воды. Полученную пасту последовательно сушат, смешивают с графитом и таблетируют. Приготовленный «мокрым» способом катализатор более однороден по химическому составу, более пористый, а также имеет высокую механическую прочность. Активность катализатора, приготовленного по «мокрому» способу, на 10—15% выше полученного «сухим» способом.
Цинк-хромовый катализатор получают также соосаждением из азотнокислых солей цинка и хрома. В растворе при взаимодействии этих солей с карбонатом аммония в осадок выпадают основные углекислые соли. При прокаливании осадка в атмосфере водорода получающиеся окислы цинка и хрома взаимодействуют с образованием хромита цинка. Полученную контактную массу после измельчения смешивают с графитом и таблетируют. Приготовленные катализаторы имеют высокоразвитую внутреннюю поверхность (более 100 м2), меньшую на 30—36% насыпную массу и более высокую активность, чем катализаторы, полученные по «сухому» способу.
Катализатор марки СМС-4 получают по так называемому «полумокрому» методу. Причем его можно приготовить на оборудовании, предназначенном для производства по «сухому» способу, без существенного усложнения технологии процесса приготовления.
Приготовление катализаторной массы в любом случае сопровождается взаимодействием хромового ангидрида с окисью цинка:
2ZnO + СгОд + Н^О •;—>• 2п2(ОН)аСг04
По техническим условиям невосстановленные образцы катализаторов должны содержать 55±1,5% ZnO, 34±1,0% СгОз, не более 1,3% графита, не более 2,0% воды гигроскопической (остальное — вода кристаллизационная). Невосстановленный катализатор представляет собой малопористое вещество с небольшой удельной поверхностью 10—15 м^г.
Активная форма цинк-хромового катализатора образуется в процессе его восстановления различными газами-восстановителями, например водородом. Удельная поверхность восстановленного катализатора 100—120 м^г (по «сухому» методу) и 196 м^г (по «мокрому» методу). Восстановление цинк-хромового катализатора сопровождается большим выделением тепла. Обычно восстановление проводят при медленном подъеме температуры до 190—210 °С. При неосторожном ведении процесса возможны самопроизвольные, в отдельных случаях местные, перегревы катализатора, которые приводят к потере его активности в результате спекания.
При восстановлении катализатора окисью углерода интенсивность восстановления замедляется выделяющейся двуокисью углерода. При местных перегревах катализатора возможно образование метана и как результат резкое повышение температуры. При восстановлении же водородом тормозящее действие на процесс оказывают пары воды. Для снижения скорости восстановления газ-восстановитель разбавляют инертным газом (обычно азотом).
В промышленных условиях цинк-хромовый катализатор можно восстанавливать непосредственно в колонне синтеза продувочным газом* при 100—150 кгс/см2 и 190—210 °С. Содержание водорода в газе обычно поддерживают не выше 70 объемн.%. Процесс контролируют по количеству сливаемой воды, образующейся в результате восстановления: не более 5—8 л/ч с 1 м3 катализатора.
При восстановлении цинк-хромового катализатора вне колонны синтеза в кипящем слое перед таблетированием обеспечивается хороший контакт газа с катализатором и интенсивный отвод тепла. • В последнее время внедрен в промышленность способ восстановления цинк-хромового катализатора (СМС-4) парами метанола при 170—230 °С и атмосферном или повышенном давлении. Продолжительность восстановления 8—36 ч. При использовании в качестве восстановителя паров метанола уменьшается опасность перегрева катализатора, кроме того, процесс восстановления можно вести без циркуляционных компрессоров.
Пробег промышленного цинк-хромового катализатора в значительной степени определяется условиями восстановления катализатора и процесса синтеза метанола на нем. В начальной стадии развития производств метанола, когда в качестве сырья использовали водяной газ со значительным количеством примесей и процесс проводили при отношениях На : СО не выше 4. пробег катализатора не превышал 4—5 месяцев. При использовании природного газа и отношении Н2: СО в цикле выше 6 цинк-хромовый катализатор практически не снижает активность в течение года. Обычно
* Исходным газом называют очищенный конвертированный газ, поступающий при высоком давлении в агрегат синтеза.
** Т. е. время эксплуатации катализатора, в течение которого выход метанола соответствует средним величинам по проекту. отработанный цинк-хромовый катализатор не регенерируют. Для стабилизации работы цинк-хромового катализатора во времени в него вводит окислы металлов VI группы периодической системы, например окислы молибдена, вольфрама и др. -
Низкотемпературные катализаторы могут быть получены разнообразными способами и из различного сырья. При приготовлении катализаторов предпочтение отдается методу соосаждения. Выпускают такие катализаторы в таблетках размером 5х5 мм.
Восстановление низкотемпературных катализаторов сложнее, чем цинк-хромовых и требует большой осторожности. Катализаторы восстанавливают в узком интервале температур (110—115°С), при этом выделяется большое количество тепла. Восстановление можно проводить при атмосферном и повышенном давлениях — важно обеспечить отвод тепла от катализатора. Необходимо заметить, что низкотемпературный катализатор обладает пирофорными свойствами, и при выгрузке из колонн синтеза возможен его сильный разогрев и даже воспламенение. Поэтому до выгрузки катализатор пассивируют, т. е. обрабатывают паром или азотом,' содержащим до 5 объемн.% Oz. !
Доля установок, работающих на низкотемпературных катализаторах, в производстве метанола пока незначительна. Однако перевод производств на природный газ, разработка методов очистки газа от сернистых соединений и простота конструкции аппаратуры синтеза при низком давлении расширяет перспективу использования этих катализаторов в промышленности,
Влияние различных параметров на процесс синтеза метанола.
В процессе синтеза метанола с течением времени активность катализатора снижается. Чтобы обеспечить нормальные условия
синтеза метанола и достичь оптимальных технико-экономических показателей производства, корректируются технологические параметры процесса—температура, давление, отношение На: СО, объемная скорость и содержание инертных компонентов в газе. Производительность катализатора является показателем, который может быть применен для оценки активности катализатора и эффективности его работы. Производительность катализатора— это количество продукта (метанола), получаемого с единицы объема катализатора за единицу времени, например т СНзОН/м3 с катализатора в сутки. Кроме температуры, давления, объемной скорости и состава исходного газа на производительность влияет также и размер зерна катализатора.
Условия проведения процесса. Исходя из термодинамики и кинетики процесса выбирают условия его проведения на соответствующих катализаторах.
Так, в промышленных условиях на цинк-хромовых катализаторах процесс ведут под давлением 25—70 мПа, при температуре 370—420 °С, объемной скорости подачи газовой смеси-lOOOO—35000-i и мольном соотношении Н2:СО=(1,5—2,5):1. Обычно исходный газ содержит 10—15% инертных примесей. В связи с этим требуется непрерывный вывод части рецикла газовой смеси (»10%) из системы. В этих условиях конверсия СО за один проход составляет 5—20% при выходе метанола 85—87% от стехиометрического. Непревращенный газ возвращается в реактор после конденсации метанола и воды. Одновременно с метанолом образуется ряд побочных продуктов: диметиловый эфир, высшие спирты и др.
При работе на низкотемпературных медьсодержащих катализаторах давление поддерживается в пределах 3—5 мПа, температура—230—280 °С, объемная скорость 8000—12000 ч-', мольное соотношение Н2:СО==(5—7) : 1. Обязательным условием успешной работы низкотемпературных катализаторов является присутствие в газовой смеси 4—5% (об.) диоксида углерода. Он необходим для поддержания активности таких катализаторов. Срок службы катализатора при выполнении этого условия достигает 3—4 лет.
|
|
|
 Скачать 119.23 Kb.
Скачать 119.23 Kb.