ФХПТ Курсовая. Курсовая работа по дисциплине Физикохимические процессы в атмосфере
 Скачать 259.57 Kb. Скачать 259.57 Kb.
|
1.4 Загрязнение воздуха отработавшими газами автомобилей.Основная причина загрязнения воздуха заключается в неполном и неравномерном сгорании топлива. Всего 15% его расходуется на движение автомобиля, а 85% «летит на ветер». К тому же камеры сгорания автомобильного двигателя – это своеобразный химический реактор, синтезирующий ядовитые вещества и выбрасывающий их в атмосферу. Двигаясь со скоростью 80-90 км/ч в среднем автомобиль превращает в углекислоту столько же кислорода, сколько 300-350 человек. Но дело не только в углекислоте. Годовой выхлоп одного автомобиля – это 800 кг окиси углерода, 40 кг окислов азота и более 200 кг различных углеводородов. В этом наборе весьма коварна окись углерода. Из-за высокой токсичности её допустимая концентрация в атмосферном воздухе не должна превышать 1 мг/м3. Известны случаи трагической гибели людей, запускавших двигатели автомобилей при закрытых воротах гаража. В одноместном гараже смертельная концентрация окиси углерода возникает уже через 2-3 минуты после включения стартера. В холодное время года, остановившись для ночлега на обочине дороги, неопытные водители иногда включают двигатель для обогрева машины. Из-за проникновения окиси углерода в кабину такой ночлег может оказаться последним. Уровень загазованности магистралей и примагистральных территорий зависит о Выводы по первой главеСамые мощные источники загрязнения атмосферы территории Оренбургской области расположены в городах Оренбурге (Каргалинская и Сакмарская Тэц), Новотроицке и Орске, что позволяет ожидать в этих городах более высокую экологическую нагрузку через атмосферу на население города. Самыми сильнодействующими веществами-токсикантами в атмосфере промышленных городов Оренбургской области (г.Оренбург, Орск, Новотроицк) являются оксиды азота. В последние годы отмечается рост заболеваемости болезнями органов дыхания как у детей, так и у взрослых, что связано с выраженным антропогенным загрязнением атмосферного воздуха. Основными факторами, формирующими неудовлетворительную санитарно-гигиеническую обстановку в отдельных районах г.Оренбурга и по городу в целом, являются поллютанты атмосферного воздуха и их накопление в почве селитебных территорий. В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в крупных городах. Выбросы от автомобильного транспорта в г.Оренбурге превышают 63% от общего количества по массе и достигают 95% по категории опасности предприятия. Следовательно, в г.Оренбурге возникает необходимость в тщательной оценке роли автомобильного транспорта в формировании загрязнения в атмосферном воздухе. 2. Исследование процессов формирования пылегазовых примесей в атмосфере придорожных территорий улиц города Оренбурга (на примере улицы Монтажников)2.1 Характеристика объекта исследования и применяемых методик2.1.1 Характеристика объекта исследования 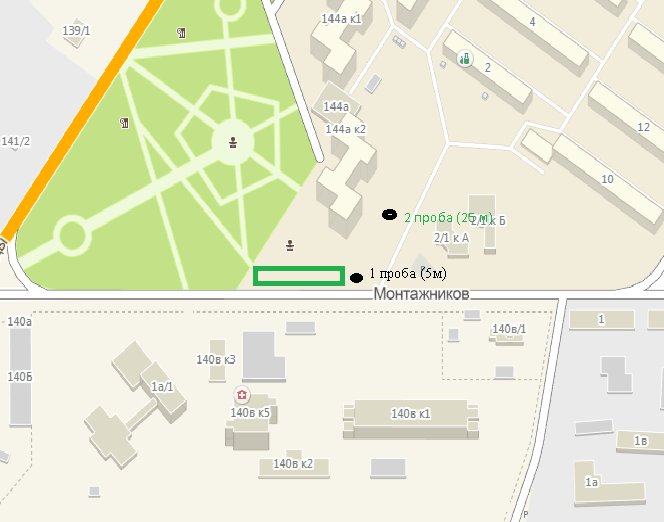 Рисунок Карта-схема расположения точек пробы 2.1.2 Характеристика применяемых методик Определение содержания взвешенных веществ. Произвести отбор снега (дождя) специальным пробоотборником. Если производится отбор снега, то его необходимо поместить в комнатные условия (18-20ºС) до полного таяния. Собранные осадки фильтруются через широкопористые фильтры (белая лента), предварительно взвешенный на аналитических весах. Для фильтрования берутся три конические колбы, три воронки, в которые вставляются фильтры. Через каждый из них пропускается фильтрат объёмом 300 мл. Если после фильтрования фильтрат получается мутным, то его фильтруют через узкопористый фильтр (синяя лента), вышеуказанным способом. После фильтрования фильтры высушиваются в эксикаторах и вновь взвешиваются на аналитических весах. По разности масс фильтров до и после фильтрования вычисляется масса взвешенных частиц 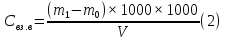 Определения pH 1. Пронумерованные пробы подносят к прибору 2. Включают прибор и прогревают его 15 минут 3. Опускают электроды в стаканчик с раствором 4. Нажимают на кнопку pX и «-1,19», по нижней шкале прибора определить значение раствора 5. На панели переключения пределов измерения нажимают кнопку (3) 6. После каждого определения вымывают электроды в дистиллированной воде и высушивают фильтровальной бумагой 7. После работы электроды помещают в стакан с дистиллированной водой Определение содержания хлорид-ионов в атмосферных осадках 1. Установить титр AgNO3, для этого в коническую колбу на 200 мл вносят 10 мл раствора NaCl и 90 мл дистиллированной воды. Прибавить 5 капель K2CrO4 2. Содержимое колбы титруют раствором AgNO3 до перехода лимонно-жёлтой окраски мутного раствора в оранжево-красную 3. При содержании хлоридов менее 250 мг/л берут 100 мл фильтруемой испытуемой воды. При большем содержании берут 10-50 мл. 4. Испытуемую воду наливают в 2 конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора K2CrO4 5. Раствор в колбе титруют AgNO3, 2 колба необходима для контроля Содержание хлор-иона в воде рассчитывается по формуле: X=V×35,5 (3) где Х-содержание хлор-иона в мг/л 35,5-эквивалентное количество хлора, соответствующее 1 мл 0,01 н раствора AgNO3, мг V-объём исследуемой пробы. Определение содержания гидрокарбонат-иона в атмосферных осадках 1. В колбу наливают 10 мл воды 2. Добавляют пипеткой 1-2 капли раствора метилового оранжевого 3. Титруют раствором соляной кислоты (0,05н) до перехода жёлтой окраски в розовую 4. Массовая концентрация гидрокарбонат-иона рассчитывается по формуле: Х = 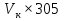 (4) (4) где 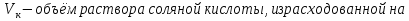 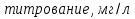 Определение содержания кальция и магния в атмосферных осадках 1. Пипеткой на 50 мл отбирают фильтрат и переносят его в колбу для титрования 2. Приливают 5 мл аммонийной буферной смеси, 25-30 мг хромогена чёрного и титруют раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до перехода вишнёво-красной окраски раствора в синюю 3. Титрование необходимо повторять 2-3 раза и взять среднее значение Содержание 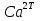 и и 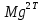 вместе взятых можно найти по формуле: вместе взятых можно найти по формуле: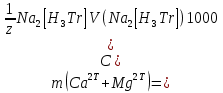 , , где 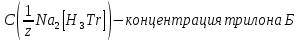 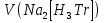 - объём рабочего раствора трилона Б, затраченного на титрование, мл - объём рабочего раствора трилона Б, затраченного на титрование, мл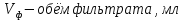 Определение содержания кальция: 1. 50 мл фильтрата перенести в колбу для титрования 2. Прилить 2,5 мл раствора NaOHмолекулярной концентрацией 2 моль/л и 30-40 мл смеси мурексида с хлоридом натрия, приступить к титрованию раствором трилона Б с молекулярной концентрацией эквивалента 0,05 моль/л до появления сине-фиолетовой окраски, не исчезающей в течение 2-3 минут 3. Титрование необходимо повторить 2-3 раза и взять среднее значение Содержание кальция вычисляют по формуле, как суммарное содержание 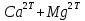 . Количество . Количество 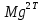 находят: находят: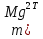 ) = m( ) = m(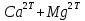 )-m( )-m(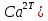 (5) (5)Определение содержания аммония в снежном покрове 1. К 100 мл пробы воды добавить 0,2 мл раствора сегнетовой соли и 0,2 мл реактива Неслера 2. Перемещать и через 10 минут измеряют оптическую плотность раствора 3 Из полученного значения оптической плотности вычитают оптическую плотность золотой пробы 4. Концентрацию ионов аммония в пробе определяют по калибровочному графику Определение содержания сульфидов и гидросульфидов в снежном покрове. Вследствие летучести свободного сероводорода проводят два определения: ориентировочное и точное. Ориентировочное определение: 1. В коническую колбу добавляю 20 мл фильтрата, добавляют 0,2 г иодида калия и перемешивают круговыми движениями, чтобы растворились все кристаллы 2. Затем прибавляют 2-3 капли 0,5%-ного раствора крахмала и титруют 0,01н раствором йода до появления голубой окраски, не исчезающей при энергичном встряхивании Точное определение: 1. В коническую колбу добавляю 20 мл фильтрата, 0,2г иодида калия, отмеряют из бюретки 0,01н раствора йода на 1 мл больше, чем было израсходовано на ориентировочное титрование 2. Затем прибавляют 2-3 капли 0,5%-ного раствора крахмала, тщательно взбалтывают и оттитровывают избыток йода 0,01 н раствором тиосульфата натрия Общее содержание соединений серы Х (в мг/л), окисляемых йодом выраженное в форме сероводорода, вычисляют по формуле: 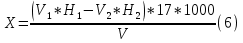 где 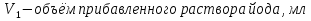 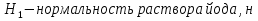 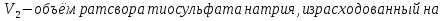 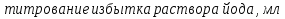 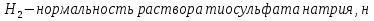 17-эквивалентный вес сероводорода, г/моль 1000-коэффициент перевода мл в л V-объём исследуемой пробы, мл Определение содержания сульфат-ионов в снежном покрове Приготовление рабочего раствора сульфата натрия: 1) Раствор сульфата натрия с концентрацией 0,2 мг/мл готовится растворением 0,8872 г прокаленного сульфата натрия в 100 мл дважды перегнанной дистиллированной водой 2) Рабочий раствор сульфата натрия, содержащий 10 мкг в 1000 мл готовят разбавлением полученного раствора в 20 раз Приготовление раствора электролита: 1) 240 г химически чистого хлорида натрия помещают в мерную колбу на 1000 мл, добавляют небольшое количество бидистиллята 2) Затем приливают 20,5 мл концентрированной соляной кислоты и доводят бидистиллятом до метки Снег привести в жидкую фазу, затем к 10 мл талой воды прибавить 20 мл электролита, 20 мл билистиллята. Раствор перемешать и добавить 7,5 мл раствора хлорида бария. В колбе на 100 мл раствор доводят до метки и колориметрируют |
