Курсовая работа По дисциплине Ветеринарная микробиология и микология На тему Лептоспиры. Бактериологическая и серологическая диагностика. Биопрепараты.
 Скачать 1.81 Mb. Скачать 1.81 Mb.
|
|
ФГБОУ ВО Нижегородская государственная сельскохозяйственная академия Кафедра «Микробиология, вирусология, биотехнология, радиобиология и безопасность жизнедеятельности» Курсовая работа По дисциплине «Ветеринарная микробиология и микология» На тему «Лептоспиры. Бактериологическая и серологическая диагностика. Биопрепараты.» Выполнила студентка 3 курса ветеринарного факультета группы 61 Б Новикова Алина Анатольевна Проверила: Каткова А.Н. Нижний Новгород, 2019 СодержаниеВведение 3 Характеристика возбудителя 4 Морфология 5 Культуральные свойства 6 Биохимические свойства 7 Токсинообразование 7 Антигенная структура 8 Устойчивость 8 Патогенность 9 Патогенез 11 Течение и симптомы болезни 12 Лабораторная диагностика 15 Материалы для исследования 15 Бактериальная диагностика 17 Бактериоскопический метод 17 Выделение чистой культуры 19 Биопроба 21 Серологическая диагностика 22 Аллергическая диагностика 27 Биопрепараты 27 Заключение 28 Список литературы 30 Список сокращений 32 Антиплагиат 33 Введение Лептоспироз (болезнь Вейля, тиф собак, штутгардская болезнь) – острая инфекционная природно – очаговая болезнь бактериальной природы. Она относится к антропозоонозам. Проявляется анемией, лихорадкой, гемоглобинурией, желухой, геморрагическим диатезом, некрозом слизистых оболочек и кожи, атонией органов пищеварительного тракта, абортами. А также может проходить и бессимптомно. Первый шаг в выделении лептоспироза в качестве самостоятельной нозологической формы был сделан в конце 19 века А. Вейлем и Н.П. Васильевым, которые представили подробное описание клинической картины так называемой инфекционной желтухи человека. Возбудитель же был найден позже, в 1914 г. японскими учеными Инадо и Идо, которым удалось выделить спирохеты из печени зараженных морских свинок. Они назвали их Spirochaeta icterohaemorrhagiae. Вторым шагом стало выделение еще одного типа лептоспир, которые вызывали заболевания, протекающие в более легкой форме и без желтушной окраски покровов тела больных. Это открытие было сделано в конце прошлого – начале нашего века группой советских ученых: В. А. Башениным, С. И. Тарасовым, Г. В. Эпштейном. Данный тип был назван L. grippotyphosa. После этого в 1972 году предложено разделить лептоспироз на две группы: желтушный и безжелтушный лептоспироз. Первую в СССР вакцину предложил С.Я. Любашенко (1940). По его же методике готовят поливалентную противолептоспирозную сыворотку с 1947 г. На сегодняшний день эта болезнь встречается на всех континентах и занимает около 2% случаев из всех инфекционных заболеваний. На территории СНГ особенно часто его регистрируют на Северном Кавказе, Дагестане, Армении, Украине (в Крыму), Поволжье, а также в Сибири. Кроме симптомов, в лептоспирозе есть еще одна неприятная сторона — это высокий экономический ущерб. Падеж крупного рогатого скота и свиней (25-45%), снижение удоя (на 22-37%), потеря массы тела (на 18-28%), гибель потомства (до 90%), аборты (у 15-20% коров и 100% свиноматок), снижение товарных качеств кож переболевших животных, выбраковка продуктов животноводства на мясокомбинатах. А также большие затраты на: диагностические, профилактические, лечебные, карантинно-ограничительные мероприятия. Характеристика возбудителя 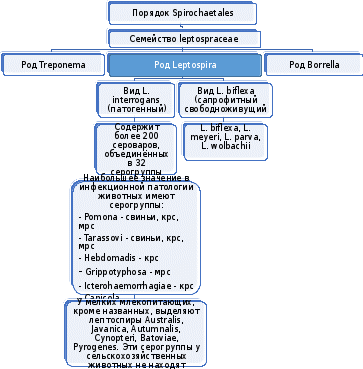 Схема.1 - Классификация лептоспир Морфология лептоспир Тело ЛС состоит из 12-18 завитков спирали, которые тесно прилегают друг к другу, почти всегда загнуты под углом и имеют пуговчатые утолщения. Такая особенность при темнопольной микроскопии (рис.1) делает лептоспир похожими на нитку жемчуга, или они могут выглядеть как цепочки мелких кокков. Их длина 7-15 мкм, но может варьировать и от 3 до 30 мкм. А диаметр 0,07-0,14 мкм и постепенно утончается к концам.  Рисунок 1 - Лептоспира под электронным микроскопом Лептоспиры состоят из протоплазматического цилиндра, который окружен наружной мембраной из 3-5 слоев, гибким пептидогликановым слоем с цитоплазматической мембраной и аксиальной нитью (аксостиль). (рис.2). 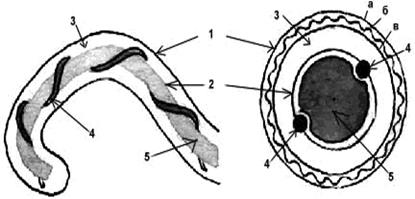 Рисунок 2 - Схема строения лептоспиры. Условные обозначения: 1-наружная мембрана; 2-периплазматический цилиндр; 3-жгутик: - 1-наружная мембрана (а, б, в-ее слои); - 2-внутренняя мембрана; 3-периплазматическое пространство; 4-жгутики; 5-цитозоль Эта нить находится в переплазматическом пространстве между наружной мембраной и пептидогликановым слоем оболочки. Она одним концом прикреплена крючками к базальному тельцу на противоположном конце протоплазматического цилиндра, идет вдоль ости клетки приблизительно до ее центра, а другим свободным концом располагается внутриклеточно. Аксостиль как бы закручивается вокруг протоплазматического цилиндра спирохеты. Поэтому последний приобретает винтообразную форму, при этом образуются первичные завитки. Аксиальные нити не перекрываются между собой как у других спирохет. Структура базальных телец жгутиков такая же, как и у других грамотрицательных бактерий. Подвижность лептоспир является их диагностическим отличительным признаком. Движение может быть вращательное, сгибательное, поступательное или иметь змеевидный характер. При этом они образуют петли, завитки, изгибы, которые получили название вторичных завитков. Спор и капсул не образуют. 1.2 Культуральные свойства ЛС – хемоорганотрофные факультативно-аэробные бактерии. Их культивируют в аэробных условиях на средах слабощелочной реакции (рН 7,2–7,4) при оптимальной температуре 24 – 28 °С. Рост на питательных средах замедленный. Наиболее интенсивно лептоспиры растут на жидких и полужидких питательных средах с 5–10% сыворотки крови кролика или барана (вместо сыворотки часто применяют сывороточный альбумин), дистиллированную, водопроводную, колодезную воду или фосфатный буфер (pH 7,2…7,6): среды Уленгута, Терских, Ферворт – Вольфа, Любашенко и др. Максимальный рост наблюдают через 7–20 суток, а иногда и через 1-2 месяца. Среда при этом не изменяется. На плотных средах (Кокса, ВГНКИ) образуют колонии S-, O-, R- форм. S- форма – типичная вирулентная, ее колони прозрачные, в виде диска диаметром 2-4 мм с тонкой периферической каймой. 1.3 Биохимические свойства Лептоспиры – хемоорганотрофы с дыхательным типом метаболизма. В их дыхании участвует цитохромная система. Об этом свидетельствуют результаты спектрографических исследований, а также повышенная чувствительность ЛС к солям синильной кислоты. Для получения энергии они окисляют длинноцепочечные (не менее 14 атомов углерода) жирные кислоты. Аминокислоты и углеводы ЛС использовать не могут. Лептоспиры оксидазонегативны, но каталазо- и / или пероксидазопозитивны. Основной источник азота для них — это соли аммония. Лептоспиры способны утилизировать азот из мочевины, креатинина и саркозина, что протекает под контролем ферментов микроорганизмов – аланиндегидрогеназы, глютаматдегидрогеназы и глютаматпируват трансаминазы. 1.4. Токсинообразование ЛС не синтезируют истинный экзотоксин, но обладают эндотоксином и ферментами патогенности (гемолизины, фибринолизин, плазмокоагулаза, гиалуронидаза, липаза, лецитиназа), которые выделяются в результате лизиса и вызывают общую интоксикацию и кровоизлияния. При культивировании ЛС на питательных средах вирулентность быстро теряется. 1.5 Антигенная структура У ЛС очень сложный антигенный состав. Белковый соматический АГ, определяющий их видовую специфичность, липополисахарид наружной оболочки, жгутика, служащий критерием групповой и серовариантной дифференциации, а также экскреторные АГ являются наиболее важными антигенами. Трипсинизация ведет к выделению из ЛС антигена, который состоит из протеина (4,2 мг/мл), карбогидрата (0,39 мг/мл) и гексозамина (0,025 мг/мл). Он инактивируется при 80°С за 10 мин. Обработка тиомерсалом и нагревание до 50-56°C не сильно влияют на АГ свойства ЛС. При повышении температуры до 80-100°C отделяются высокомолекулярные компоненты. А при 121°C, а также при обработке фенолом и формалином АГ структура бактерий разрушается. АГ свойства лептоспир изучают в реакции микроагглютинации и методом иммуноадсорбционного анализа. 1.5. Устойчивость Патогенные ЛС чувствительны к повышенной температуре (при 45°С они погибают в воде за 45 минут, при 56°С за 30 минут, при 70°С - менее, чем за 1 минуту, а при кипячении - моментально). А вот низкую температуру, включая заморозку они выдерживают хорошо. Быстро гибнут при высушивании и под воздействием прямых солнечных лучей за 30-120 минут. Защелачивание среды до рН 9,8 для них не губительно. При рН 10 утрачивают подвижность. Кислая среда для них опасна. Например, в кислой почве (рН 5,5) лептоспиры сохраняются до 6 недель, но при этом их титр снижается приблизительно в 2500 раз. В тоже время в земле с рН 6,7-7,2 и влажностью 15,2-31,4% они выживают в течение 2,5 месяцев. ЛС являются типичными гидрофилами, поэтому в воде открытых водоемов патогенные лептоспиры сохраняются от 7 до 30 дн и более; в почве, перенасыщенной водой, выживают до 280 дней. В свежем молоке — 8-24 ч; в почках убойных животных при температуре 0-4 °С — до 28 дней; в замороженном мясе погибают через 10 дней. Чувствительны к действию поваренной соли; в засоленном (4,8 % NaCl) мясе КРС погибают через 10 дней; в гипертоническом растворе поваренной соли (2,8 %) — через 15 минут. Лептоспиры очень чувствительны к многим антибиотикам, например стрептомицину, левомицетину, тетрациклинам, фторхинолонам, макролидам и лактамовым антибиотикам, кроме хлорамфеникола и рифампицина, к которым они невосприимчивы. Обычно используемые дезинфектанты довольно быстро инактивируют этих микроорганизмов: 0,25% р-р формалина за 5 минут, 0,5% р-р NaOH - за 10 минут, 1% р-р карболовой к-ты за 30 минут. Р-ры (0,1 % соляной кислоты, 0,5 % фенола) инактивируют ЛС за 20 минут. ЛС погибают при P = 2 кбар в течение 1ч. 1.6. Патогенность У более ста видов различных животных может быть выявлено бессимптомное лептоспироосительство. Его срок довольно продолжительный: у крс 1,5–6 мес; у овец, коз – 6–9 мес; у свиней – от 15 дн до 2 лет; у собак – от 110 дн до 3 лет; у кошек – от 4 до 119 дн; у кур, уток, гусей – от 108 до 158 дн. Однако круг основных (резервуарных) хозяев значительно уже и представлен в дикой природе мышевидными грызунами (серые полевки, мыши, крысы и др.) и насекомоядными животными (ежи, землеройки). В хозяйственных очагах эту роль играют свиньи, которые бывают поголовно инфицированы серогруппами L. Pomna и L. Tarassovi, КРС (L. Pomna и L. Hebdomadis), овцы, собаки, кошки (+лисы и песцы). Менее часто – лошади, козы, буйволы, верблюды, олени, ослы, куры. Болеет и человек. К экспериментальному заражению более чувствительны золотистые хомяки, крольчата-сосуны и молодые морские свинки. Лептоспироз распространяется следующим образом (рис.3): лептоспиры, которые выделяются из организма зараженных животных инфицируют воду, корма, пастбища, почву, подстилку, и другие объекты, через которые заражаются здоровые животные. Наиболее часто заражение происходит при водопое, поедании грызунов – лептоспироносителей или кормов, инфицированных мочой этих грызунов. Так же лептоспироз может быть передан и половым путем или внутриутробно. Болезнь наблюдается в любое время года, но у животных с пастбищным содержанием – преимущественно в летне-осенний период. Лептоспироз проявляется в виде небольших эпизоотий и спорадических случаев. Сначала (в течение 5–10 дней) начинает болеть небольшая группа животных, затем вспышка, которая примерно равна инкубационному периоду, ненадолго притухает. За это время возбудители накопятся во внешней среде и «болезнь вернется». 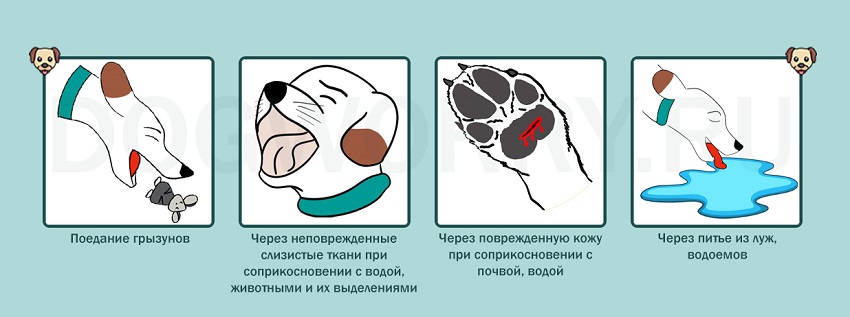 Рисунок 3 – Распространение лептоспироза Патогенез 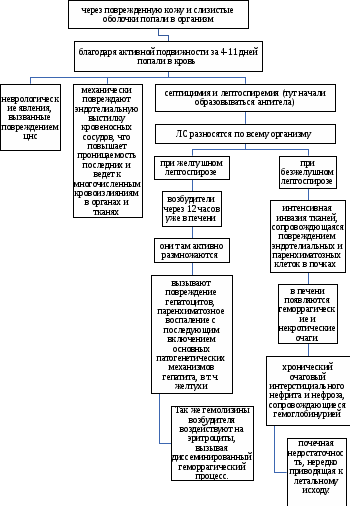 Схема 2 - Патогенез лептоспир Гуморальный иммунный ответ постепенно разрушает и выводит ЛС из крови и паренхиматозных органов зараженного животного. Не считая проксимальных канальцев и клубочков почек, головного мозга, передней камеры глаз и органов воспроизводства, в которых ЛС не только сохраняются, но и медленно размножаются. Такие очаги инфекции в организме обусловливают феномен носительства и иногда становятся причиной рецидивов болезни. 1.8 Течение болезни. Симптомы болезни В зависимости от серогруппы возбудителя, степени его вирулентности, величины заразительной дозы, а также состояния специфического иммунитета и резистентности организма лептоспироз может протекать в различных формах (табл.1) Таблица 1 Формы лептоспирозов
Продолжение таблицы 1
Основными показателями тяжести болезни являются степень выраженности геморрагического синдрома, поражения почек и печени (интенсивность желтухи). В связи с этим большинство авторов выделяют следующие формы ЛС: Геморрагическая. Она отмечается в основном у старых животных. Протекает в острой или подострой форме, начинается внезапно. Температура тела повышается до 40-41,5 °С, наблюдается очень сильное исхудание, повышенная жажда, гиперемия слизистых оболочек ротовой и носовой полости, конъюнктивы, депрессия. На 2-3-й день температура тела понижается до 37-38°С, и развивается резко выраженный геморрагический синдром: патологическая кровоточивость слизистых оболочек организма, наружные и внутренние кровотечения и кровоизлияния, выраженная болезненность при пальпации в области почек, печени, желудка, кишечника и мышечной ткани. Так же данная форма может проявляться резким обезвоживанием организма, язвенным и некротическим стоматитом, острым геморрагическим гастроэнтеритом, острой почечной недостаточностью. Данные клинические признаки развиваются очень быстро, часто наступают клонические судороги, а затем животное умирает в глубоком коматозном состоянии. Желтушость при геморрагической форме лептоспироза, как правило, не отмечают. Желтушная - проявление желтушности связано с высокой вирулентностью возбудителя и степенью тяжести поражения печени. Встречается в основном у молодых животных. Болезнь может протекать остро, подостро и хронически. Симптомы те же, что и при геморрагической форме + диспепсический, геморрагический, и гепатолиенальный синдром. Но главной особенностью является конкретная локализация и колонизация лептоспирами печени, что вызывает тяжелые гепатопатии и глубокие нарушения важнейших ее функций (рис.4). 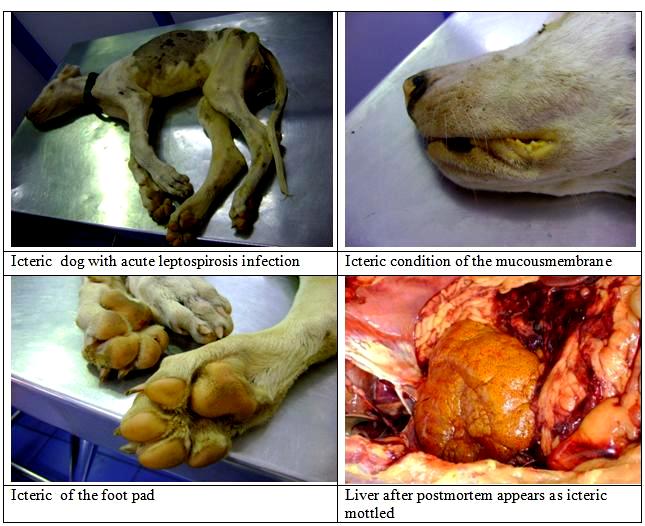 Рисунок 4 - Поражение печени у собаки при лептоспирозе Из-за этого и проявляется ярко выраженное желтушное окрашивание носовой полости, влагалища, а также кожи живота, промежности, внутренней поверхности ушей и др. (рис.5) 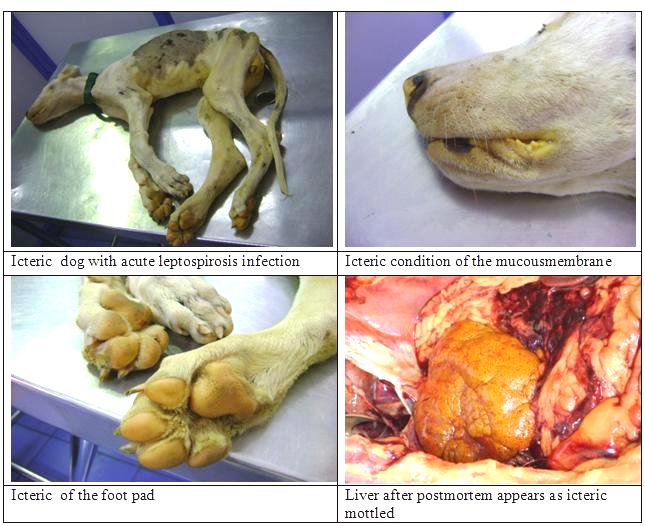 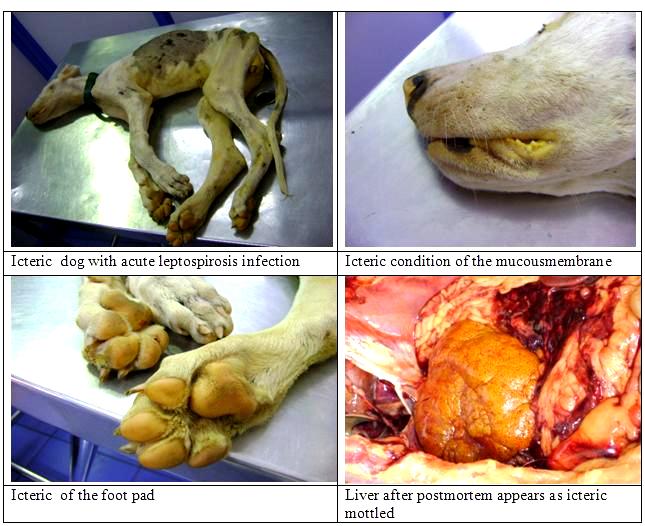 Рисунок 5 - Желтушное окрашивание слизистых а также кожи живота, промежности, внутренней поверхности ушей и других участков собаки В результате комбинированного поражения важнейших внутренних органов (печени, почек, селезенки и др.) у больных животных развивается инфекционно-токсический шок, который часто является причиной их гибели. L.icterohaemorrhagiae вызывает, как правило, желтушную форму, L.pomona - в основном геморрагическую, редко - желтушную, a L.canicola, как правило, геморрагическую форму без желтухи. 2. Лабораторная диагностика 2.1 Материалы для исследования Для прижизненного исследования берут кровь из вены. Для серологического исследования через 5-7 суток после проявления клинических признаков болезни, а для бактериологического исследования в период лихорадки на 1-7 сут болезни. Обязательно нужно взять пробу крови от абортировшего животного. Так же можно взять мочу. Ее собирают при мочеиспускании в чистые пробирки утром во время кормления, при этом можно использовать катетер. Мочу микроскопируют непосредственно в хозяйствах. Перед этим ее подготавливают: центрифугируют (при 10–15 тыс. об/мин 30 мин) и исследуют осадок и надосадочную жидкость. Микроскопия должна быть завершена при t: 30-40 С в течение 3 ч, 25-30 С - 4-5 ч, 20-25 С - 6-8 ч, 16-20 С - 10-12 ч с момента взятия. Для посмертной диагностики отрезают кусочки паренхиматозных органов объемом не более 1 см, полые органы ,такие как мочевой пузырь и желудок, извлекают целиком, накладывают лигатуры на сосуды и сфинктеры и берут их вместе с содержимым, почку извлекают в невскрытой капсуле, но для исследования используют только кусочки коркового вещества. Если животное было маленьким, то можно взять его целиком, так же, как и абортированный плод (рис.6)  рисунок 6 - Желтуха у плода Каждый орган или кусочек органа заворачивают в целлофановый пакет, а жидкие субстраты, такие как ликвор, транссудат, спинномозговая жидкость насасывают стерильным шприцем или пипеткой в стерильные пробирки. Далее упаковывают материал в чистые, широкогорлые стеклянные банки, которые плотно закрываются. Поверх пробки банку обертывают чистой бумагой, обвязывают тонким шпагатом и опечатывают. На каждую банку наклеивают этикетку, на которой записывают какие органы, и в каком количестве помещены в банку, дату падежа. После направляют в лабораторию курьером. В сопроводительном документе к пробам патологического материала указывают время гибели животного или время взятия проб при жизни. Пробы должны быть исследованы в течение 6 часов с момента взятия в летнее время и 10-12 часов при хранении его в охлажденном состоянии. В лаборатории готовят из проб органов суспензию в стерильном физрастворе, исследуют в нативном состоянии или после центрифугирования. Консервировать материал животного происхождения можно только в том случае, если он будет доставлен в лабораторию не ранее чем через 3-4 дня после взятия. Для этого используют спирт-ректификт. 2.2 Бактериологическая диагностика 2.2.1 Микроскопия Основной способ микроскопии ЛС – метод раздавленной капли в темном поле (рис.7). Наличие в препарате тонких, гибких, подвижных серебристых нитей с изогнутыми концами свидетельствует о присутствии в исследуемых образцах живых лептоспир.  Рисунок 7 - Лептоспиры при темнопольной микроскопии Лептоспир редко удается обнаружить микроскопией препаратов крови (так как концентрация их мала) и, как правило, только в первые 1-3 дня болезни. Поэтому применяют различные методы концентрирования возбудителя из обработанной гепарином крови, такие как отстаивание (исследуют верхний прозрачный слой) или центрифугирование (исследуют осадок) в течение 1 часа. Частота обнаружения ЛС в моче максимальна в период ее потемнения. Обнаружение ЛС в моче имеет наибольшее значение для выявления лептоспироносителей с хронической формой инфекции. Легче всего обнаружить ЛС в печени и почках (поверхностном слое). Материал для исследования берут в кратчайшие сроки после гибели животного, поскольку трупное обсеменение вызывает быструю гибель этих бактерий. Если результаты бактериоскопии получились отрицательными, то это еще не значит, что диагноз не верен, так как довольно часто отбор проб для лабораторного исследования проводится на фоне приема антибиотиков, в связи с чем диагностическая эффективность этого метода сильно падает. Нельзя исключать и возможность ошибок. Они могут быть связаны с дефектами покровного стекла, плохим освещением препарата, наличием в препарате отдаленно напоминающих лептоспир, - нитей фибрина, стром эритроцитов или других извитых форм микроорганизмов, например спирилл, особенно часто обнаруживаемых при исследовании несвежего патологического материала. Для повышения диагностической эффективности прямой бактериоскопии, ее необходимо совмещать с такими серологическими методами, как метод флюоресцирующих антител, люминесцентная микроскопия. Лептоспиры плохо окрашиваются анилиновыми красителями, поэтому для их обнаружения используют окраску мазков-отпечатков по Романовскому – Гимзе (ЛС окрашиваются в розово-фиолетовый цвет), импрегнацию серебром гистологических срезов печени и почек по Левадити или Вартину – Стерри (ЛС окрашиваются в темно-коричневый цвет и хорошо видны на фоне золотистых тканей при просмотре в светлом поле под иммерсией), окрашивание риванолом или аурамином по В.С. Киктенко (ЛС приобретают зеленоватый оттенок (риванол) или золотистый (аурамин) цвет), импрегнация серебром по Б. Бабудиери (ЛС имеют черный цвет на светло-коричневом фоне). Бактриоскопический позволяет поставить диагноз в течение 1-1,5 ч, а также позволяет обнаружить возбудители в органах и тканях, и оценить клеточную реакцию на их присутствие. 2.2.2. Выделение чистой культуры Исследуемый материал (кровь, спинномозговая жидкость – СМЖ, моча) в количестве 5 капель засевают в 3–5 пробирок с питательной средой и инкубируют при 28-30 °C в течение 3 месяцев. ЛС начинают размножаться через 7-20 суток, иногда через 1-2 и очень редко – 3 месяца. Эту процедуру желательно проводить «у постели больного», потому что ЛС быстро погибают во внешней среде. Так как ЛС очень требовательны к составу питательной среды, необходимо использовать лабораторную посуду из нейтрального или химического стекла. Новые и бывшие в употреблении пробирки обрабатываются 1–2%-м раствором HCl по специальной методике. Для культивирования лептоспир используют специальные питательные среды. В зависимости от состава их подразделяют на: 1. Среды с нормальной кроличьей сывороткой (Ферворта – Вольфа, Стюарта, Кортхофа, Флетчера, Терских (рис.8), ВГНКИ). В них содержатся высокие концентрации биологического витамина В12, что способствует росту лептоспир. Эти среды могут использоваться для изолирования возбудителя из клинических образцов и объектов внешней среды, а т.ж. для хранения ЛС и получения АГ для постановки РМА.  Рисунок 8 - Среда Тельских (рост до 30 дней) 2. Среды, содержащие жирные кислоты и альбумин (Эллингхаузена – МакКалоха – Джонсона – Харриса (EMJH) (рис.9), Эллиса, альбуминовая среда ГНКИ). В них длинноцепочечные жирные кислоты используются в качестве источника питания, а сывороточный альбумин – как детоксикант. Среды используются для изоляции культур и получения биомассы для проведения молекулярно-биологических исследований.  Рисунок 9 - Культивирование L.interrogans на средеЭллингхаузена – МакКалоха – Джонсона – Харриса (EMJH) 3. Среды, свободные от белка (Шенберга, синтетическая безбелковая среда). В этих средах длинноцепочечные жирные кислоты для детоксикации подвергают воздействию древесного угля. Для лабораторных исследований чаще используют жидкие питательные среды. Культуры ЛС в них бесцветны, не имеют запаха, при обильном росте в пробирке наблюдаются опалесцирующие «муаровые» волны. Поэтому для выявления роста лептоспир через 10 дней от момента посева из каждой пробирки готовят мазок «раздавленная капля» и исследуют методом темнопольной микроскопии. Наибольший рост отмечается у поверхности среды. При посевах ЛС в полужидкий агар на 1–3 см ниже его поверхности образуются плоские диски роста или отдельно расположенные колонии. На полужидких средах культуры сохраняются дольше, однако для реакции агглютинации такие культуры не пригодны. Плотные среды применяют для культивирования штаммов лептоспир, используемых в различных тестах, а также с целью клонирования лептоспир из смешанных культур. В зависимости от объема посевного материала рост может быть диффузным (в толще агара) или в виде субповерхностных колоний. Из многочисленных плотных питательных сред для культивирования лептоспир наиболее эффективны среды Кокса, В.С. Киктенко, С.Н. Канарейкиной и др. Приготовленные среды должны отвечать определенным требованиям: • в сыворотке крови животных – доноров не должно быть специфических АТ к лептоспирам; • использование химических веществ только марки «химически чистые», дистиллированной, бидистиллированной или деминерализованной воды; • готовая среда обязательно должна быть стерильна и полностью прозрачна без посторонних частиц, кристаллов солей и т. д.; • pH = 7,2–7,6 (хотя имеются и серогрупповые особенности); • для роста и сохранения основных свойств лептоспир в среде необходимо содержание всех необходимых компонентов. Для сохранения живых культур рекомендуется производить пересевы не реже 1 раза в месяц на свежеприготовленные питательные среды. Рост отдельных серогрупп (Hebdomadis, Javanica) на обычных сывороточных средах скудный. Это связано с «индивидуальными требованиями» отдельных серогрупп к составу питательных сред. Если ЛС активно двигаются, то это признак нормального развития. Причем короткие особи более подвижны, чем длинные. И чем больше мелких и подвижных лептоспир в определенном объеме среды, тем вирулентнее штамм. При культивировании лептоспир нельзя допустить загрязнение среды посторонней микрофлорой, поскольку продукты жизнедеятельности других микроорганизмов изменяют рН среды и, как следствие, подавляют рост и приводят к гибели микроорганизмов 2.2.3. Биопроба Этот способ более чувствительный, чем культуральный. Он проводится с целью выделения и очистки культур ЛС, определения их вирулентности, а также для того, чтобы отличить их от сапрофитов. Восприимчивость животных к заражению ЛС разных серогрупп зависит от их видовой принадлежности и возраста (молодое поколение особей более восприимчиво к инфекции, чем взрослое). Заражают 20-30 суточных золотистых хомяков, морских свинок и крольчат-сосунов в возрасте 10-20 суток, а также сусликов и щенков в возрасте до 4 недель, хлопковых крыс, крысовидных хомяков, песчанок, шиншилл. Но они уже могут быть заражены лептоспирами либо возбудителями иных болезней, имеют высокую стоимость и малую доступность, поэтому исползование их ограничено. Гепаринизированную кровь, мочу, спиномозговую жидкость или суспензию гомогената внутренних органов подозреваемой в заражении ЛС собаки, а также тестируемые корма и воду вводят лабораторным животным подкожно, внутривенно, внутрибрюшинно, через скарифицированную кожу и слизистые оболочки, закапыванием в глаза, интракардиально и перорально. Каждую пробу испытывают на 2 животных; на 4-5 сутки убивают 1, на 14-16 сутки – 2, если оно не погибло раньше. Из сердца, печени и почек убитых или павших животных проводят посевы. Сыворотку крови убитого через 14-16 суток животного исследуют в реакции микроагглютинации (РМА) с лептоспирами 13 серогрупп. Положительная РМА в разведении 1:10 и выше указывает на наличие лептоспир в исследуемом материале. При недостаточной вирулентности лептоспир прибегают к пересеву культуры микроорганизмов от животного к животному. Для обнаружения патогенных ЛС в воде и иле водоемов испольуют метод Аппельмана-ван Тиля, сущность которого состоит в купании в течение 1 ч морских свинок со скарифицированной на площади в 10–20 см2 кожей брюшка. За животными ведут наблюдение по общим правилам. 2.2.4 Серологическая диагностика Серологическая диагностика – это важнейший метод в диагностике лептоспирозов. С их помощью выявляют специфические АТ в крови больных и переболевших, а также обнаруживают антигены лептоспир в биологических жидкостях. «Золотым стандартом» серологической диагностики лептоспироза считается реакция агглютинации-лизиса (рис.10) с живыми культурами лептоспир, которую Мартин и Петтит разработали в 1918 г. Сегодня, по рекомендации всемирной организации здравоохранения, применяют ее модификацию – реакцию микроагглютинации (РМА) с набором эталонных культур. 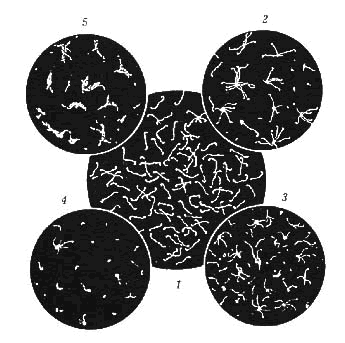 Рисунок 10 - Реакция агглютинации-лизиса. Условные обозначения: 1-отрицательная реакция; 2-5 - положительная реакция: различная степень агглютинации и лизиса. На территории РФ используется стандартный набор типовых диагностических штаммов, который включает 15 представителей 10 серогрупп патогенных лептоспир. Международный набор дополнительно содержит штаммы серогрупп лептоспир, ранее не выделявшихся в России. Берут чистую культуру 6–14-дневных культур лептоспир с хорошей подвижностью, без спонтанной агглютинации и посторонних примесей, с концентрацией, соответствующей 50–100 клеток в поле зрения микроскопа. На территории РФ используется стандартный набор типовых диагностических штаммов, который включает 15 представителей 10 серогрупп патогенных лептоспир. Международный набор дополнительно содержит штаммы серогрупп лептоспир, ранее не выделявшихся в России. Культуру исследуют с групповыми агглютинирующими лептоспирозными сыворотками, заранее разведенными стерильным физиологическим раствором в соотношении 1 : 50, 1 : 500, 1 : 1000, 1 : 2000, 1 : 4000, 1 : 8000, 1 : 16 000 и 1 : 32 000. Реакцию ставят в агглютинационных пластинах (или в пробирках). 0,1мл сыворотки каждого разведения смешивают с 0,1мл выделенной (типируемой) 5-, 7-, 10-суточной культуры лептоспир с накоплением 70...100 подвижных микробных клеток. Разведения сыворотки последовательно удваиваются. Дальше пластины (пробирки) выдерживают в термостате при 37 °С 1 ч, затем из каждой лунки (начиная с большего разведения) готовят препараты «раздавленная капля», которые исследуют полуколичестенным методом микроскопии в темном поле. Реакцию оценивают в крестах: (++++) — 100%-я агглютинация: склеивание лептоспир с образованием конгломератов в виде «паучков»», «бантиков», «кос», содержащих от нескольких клеток до нескольких десятков и даже сотен; свободные концы ЛС сохраняют подвижность; (+++) — агглютинировано 75% лептоспир; (++) —50%; (+) — агглютинировано 25%; (-) —агглютинации нет. Если РМА выражена на четыре, три и два креста, то ее считают положительной. Исследуемую культуру относят к той серологической группе лептоспир, с сывороткой которой она дает реакцию на два...четыре креста до 50...100 % ее титра, указанного на этикетке. В РМА также можно исследовать пробы крови больных людей или животных, высушенные на фильтровальной бумаге. В этом случае кровь в количестве 2 капель наносят на фильтровальную бумагу (1,5 × 1,5 см) и высушивают на воздухе при комнатной температуре. Для постановки реакции фильтровальную бумагу расстригают и опускают на дно лунки полистиролового планшета, добавляют 1,0 мл физиологического раствора. Полученный раствор служит основным разведением 1 : 10. РМА обладает высокой чувствительностью и специфичностью. Важнейшими факторами, определяющими специфичность РМА, являются чистота и идентичность антигенов. Последнюю контролируют в лабораториях минимум 2 раза в год с применением гипериммунных кроличьих антисывороток или моноклональных антител. РМА ретроспективна; по полученным результатам невозможно дифференцировать острое заболевание от перенесенного несколько лет назад. Однако РМА позволяет определить серогруппу возбудителя, что важно для проведения эпидемиологического расследования и целенаправленного поиска источника инфекции. Основными недостатками РМА при лептоспирозе являются: • весомые затраты времени и труда на ее постановку; • необходимость использования большого количества антигенов лептоспир разных серогрупп; • неоднородность качеств используемых живых лептоспирозных антигенов; • специалисты, проводящие серологическое исследование, имеют потенциальную опасность заражения; • субъективность оценки результатов; возможность перекрестных реакций; • при одномоментном исследовании большого количества образцов имеются небольшие технические сложности. Реакция макроагглютинации на стекле (слайдагглютинация) – это простая методика, которая может быть использована в лабораториях даже с небольшим оснащением. Она проводится для предварительного тестирования сывороток больных с подозрением на лептоспирозную инфекцию и массового скрининга. Для постановки применяют родоспецифические антигены, например, слайд-антиген Лепто БАСА (ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи). Реакция агглютинации латексных или полимерных частиц по чувствительности уступает РМА, но проще в постановке и позволяет получить результат в более короткий срок. Кроме того, агглютинины выявляются в более ранние сроки и в более высоком титре, чем в РМА. В качестве носителя наружных мембранных антигенов лептоспир используют латексные частицы или частицы полиDL-лактид-полиэтиленгликоля. Реакцию связывания комплемента (РСК) довольно редко используют для серологической диагностики лептоспироза. Комплементсвязывающие АТ появляются у инфицированных серогруппами Icterohaemorrhagiae и Canicola животных через 4 дня после заражения, а через 9–10 недель они исчезают. Тест не позволяет дифференцировать серовары лептоспир. Иммуноферментный анализ, метод флуоресцирующих АТ и непрямой метод флуоресцирующих антител – более простые тесты с родоспецифическими антигенами лептоспир, использующиеся с целью ранней диагностики лептоспирозов и серологического скрининга. Иммуноферментный анализ (ИФА) – метод, в котором в качестве маркера используют ферменты. Из-за простоты и высокой чувствительности, твердофазные иммуноферментные системы удобны для выявления иммунных комплексов. Применение в ИФА моноклональных антител позволяет повысить качество исследований, поскольку моноклоны обладают высокой специфичностью и одинаковой аффинностью. Плюс этого теста в том, что он позволяет различить свежий и давний случаи инфекции за счет обнаружения типов антител (IgM и IgG). А также позволяет одномоментно исследовать большое количество образцов. Основной недостаток ИФА в том, что он требует местной стандартизации для выяснения обрыва титра, поскольку у инфицированных лиц IgM могут поддерживаться на низких уровнях в течение ряда лет. Метод флуоресцирующих антител (МФА) (рис.11) предназначен для выявления лептоспир независимо от серогрупповой принадлежности в различном патологическом материале (кровь, паренхиматозные органы, транссудат, СМЖ, моча больных и павших животных) и объектов окружающей среды (вода, почва). Лептоспирозные сыворотки в комплексе с антивидовой флуоресцирующей сывороткой (мазок) просматривают на люминесцентном микроскопе. Вся поверхность ЛС, окрашенных флуоресцирующим глобулином, светится зеленоватым цветом в отличие от других видов микроорганизмов, у которых светится только контур. Диагноз устанавливают по морфологии лептоспир и интенсивности свечения, оцениваемого по системе трех крестов. Наряду с МФА в индикации лептоспир применяется и непрямой метод флуоресцирующих антител (НМФА), при постановке которого используются антивидовой лептоспирозный флуоресцирующий глобулин. 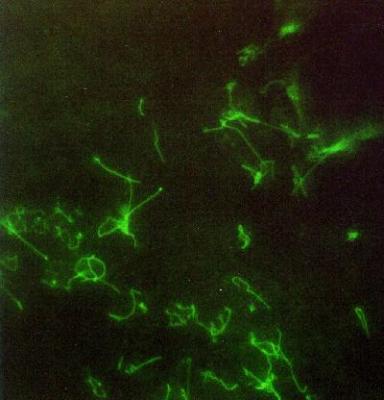 Рисунок 11 - Метод флуоресцирующих антител 2.2.5. Аллергическая диагностика Метод не используется в отношении данного возбудителя. 3. Биопрепараты Для активной иммунизации следует применять вакцины, состав которых обеспечивает защиту животных от заболевания лептоспирозом с учетом возбудителей, циркулирующих в данном регионе, для чего проводится мониторинг этиологической структуры лептоспироза в каждой стране. В РФ для этого используют депонированную поливалентную вакцину. Вакцину выпускают в двух вариантах: первый – из штаммов ЛС – Pomona, Tarassovi, Icterohaemorrhagiae, Canicola, второй – из серогрупп Pomona, Tarassovi, Grippotyphosa, и чертирех сероваров группы Hebdomadis. КРС, верблюдов, лошадей, ослов, мулов вакцинируют в возрасте от 1,5 месяцев и старше, а животных других видов – одного месяца и старше. Животных в последний месяц беременности и в первую неделю после родов, а также в течение 7 дней после дегельминтизации и 14 дней после обработки хлор-фосфорсодержащими препаратами вакцинировать нельзя. Необходимо помнить, что иммунный статус животных должен быть высоким независимо от времени года, это связано с особенностями биологии возбудителя и эпизоотической ситуацией в стране. В регионах, эндемично неблагополучных по лептоспирозу, рекомендовано вводить третью дозу вакцины через 3 месяца после второй вакцинации, что создает напряженный иммунитет продолжительностью не менее 1 года. Эффект от вакцины можно повысить если применять их совместно с иммуностимуляторами. Для пассивной иммунизации и лечения больных животных используют гипериммунную сыворотку, которую получают из крови волов-продуцентов, иммунизированных культурами лептоспир. Заключение Таким образом, проблема лептоспироза является очень актуальной не только в нашей стране, а по всему миру. Это заболевание важно вовремя диагностировать и проводить профилактику, так как оно является очень заразным, а также представляет большую угрозу в экономическом плане. Переболевание лептоспирозом сопровождается формированием вначале нестерильного, а затем стерильного (по окончании срока лептоспироносительства) иммунитета высокой специфичности, напряженности и значительной продолжительности. В целях предотвращения лептоспироза у животных владельцы скота и ветеринарные врачи должны выполнять следующие требования: -контролировать клиническое состояние животных и количество абортов; -комплектование племенных хозяйств, предприятий, станций искусственного осеменения из благополучных по лептоспирозу хозяйств; -проверять всех поступающих в хозяйство животных в период 30-дневного карантина на предмет лептоспироза в РМА в разведении 1:25; -обязательно вакцинацинировать животных их против лептоспироза в период карантинирования; -не допускать контактирования здоровых животных с зараженными; -не выпасать невакцинированных животных на территории природных очагов лептоспироза и на берегах открытых водоемов; -периодически уничтожать грызунов в местах пребывания животных и хранения кормов. А если заболевание все таки случилось, то в хозяйствах необходимо ввести ограничения: запретить вывоз животных для племенных и пользовательных целей, ввоз животных у которых отсутствует вакцина против лептоспироза, перегруппировку скота без ведома ветеринарных врачей, продажу продуктов от вынужденно убитых животных, использование воды открытых водоемов для поения животных, содержание здоровых невакцинированных животных на пастбищах, где раньше выпасали больных лептоспирозом животных. Больных и подозрительных по заболеванию животных изолируют, уточняют диагноз и лечат; клинически здоровых - вакцинируют. Затем необходимо провести дезинфекцию животноводческих помещений (после каждого зарегистрированного случая заболевания, а в последующем через каждые 10 дней до снятия ограничений). При этом применяют осветленный раствор хлорной извести с содержанием 2 % активного хлора, 2 %-ный горячий раствор серно-карболовой смеси, 5 %-ную эмульсию фенольного креолина и др. Как только эти требования будут выполнены, ограничения снимают. Список литературы Александров Павел Андреевич. Лептоспироз – симптомы и лечение [Электронный ресурс] / Александров П.А. – режим доступа: https://probolezny.ru/leptospiroz/ (дата обращения:14.10.19). Болезни собак, болезни кошек/Лептоспироз// Московский ветеринарный веб – центр [Электронный ресурс]. Режим доступа: http://webmvc.com/bolezn/catdog1/leptospi.php (дата обращения: 23.10.19) Инфекционные болезни животных / Б.Ф. Бессарабов, А.А. Вашунин, Е.С. Воронин и др.; под ред. А.А. Сидорчука. – М.: КолосС, 2007.- 671 с., [18] л. ил.: ил. – (Учебник и учеб. Пособия для студентов высш. учеб. заведений). Колычев Н.М, Госманов Р.Г. Ветеринарная микробиология и иммунология – 3-е изд., перераб. и доп. – М.: КолосС, 2003. – 432с.: ил (Учебники и учеб. пособия для студентов высш. учеб.заведений) Лабораторная диагностика опасных инфекционных болезней: Практическое руководство; изд. 2-е, перераб. и доп. / Под ред. Г.Г. Онищенко, В.В. Кутырева. – М.: ЗАО «Шико», 2013. – 360 с. Лебедев В.В., Авдеев М.Г., Шубич М.Г., Ананьина Ю.В., ТурьяновИ.Х., Лучшев В.И. Иктерогеморрагический лептоспироз / Под ред. В.В. Лебедева. – Краснодар: Советская Кубань, 2001. – 208 с. Лептоспироз // Медицинская энциклопедия [Электронный ресурс]. Режим доступа: https://gufo.me/dict/medical_encyclopedia/%D0%9B%D0%B5%D0%BF%D1%82%D0%BE%D1%81%D0%BF%D0%B8%D1%80%D0%BE%D0%B7 (дата обращения:1.10.19). Лечение и профилактика болезней/ Лептоспироз// Ветеринарная служба Владимирской области [Электронный ресурс]. Режим доступа: https://vetvo.ru/leptospiroz.html (дата обращения: 5.10.19) Медицинская микробиология, иммунология и вирусология: учеб. пособие для мед. вузов Коротяев А.И. / А.И. Коротяев, С.А. Бабичев. – 3-е изд., испр. и доп. – СПб.: СпецЛит, 2002. – 580 с. Медицинская микробиология: учеб. пособие для студентов мед. вузов Поздеев О.К. / О.К. Поздеев; ред. В.И. Покровский; УМО по мед. и фармац. образованию вузов России. – 3-е изд., стер. – М.: Гэотар-Медиа, 2005. – 768 с. Методы лабораторной диагностики лептоспирозов: особенности постановки, преимущества и недостатки/ Е.Ю. Киселева, Н.В. Бренева, А.К. Носков, М.Б. Шаракшанов, С.В. Балахонов, Н.Г. Гефан// Журнал Acta Biomedica Scientifica. -2015. - №3 (103). – с. 85-93. Основы клинической иммунологии Чепель Э., Хейни М., Мисбах С.: уч. Пособие / пер. С англ. Под ред. Р.М. Хаитова. – М., 2008. – 416 с. Самсонова А.П., Петров Е.М., Ананьина Ю.В. Применение ПЦР-анализа при исследовании лептоспирозов в Европейской части России // Национальные приоритеты России. – 2009. – № 2. – С. 166–167. Самсонова А.П., Петров Е.М., Лебедев В.В., Ананьина Ю.В. Индикация лептоспир в сыворотках крови больных лептоспирозом Icterohaemorrhagiae методом nested-ПЦР // Клин. лаб. диагн. – 2008. – № 9. – 46 с Соболева Г.Л. Актуальные вопросы лептоспироза людей и животных / Г.Л. Соболева, Ю.В. Ананьина, И.В. Непоклонова // Российский ветеринарный журнал. —2017. — № 8. — С. 13-17. Шуляк Б.Ф. Лептоспироз [Электронный ресурс] / Шуляк Б.Ф. – режим доступа: http://www.petsinform.com/veterinary/statia/infekcia/bakteria/07.html (дата обращения:13.10.19). Список сокращений ЛС – лептоспиры АГ – антиген АТ – антитело КРС – крупный рогатый скот  |
