Курсовая работа по теме Производство аммиака
 Скачать 339.83 Kb. Скачать 339.83 Kb.
|
36,5 СО. Введение Характеристика исходного сырья Характеристика целевого продукта Физико-химическое обоснование основных процессов производства аммиака Экологическая безопасность производства Описание технологической схемы процесса Расчет материального баланса Расчет основных технологических показателей процесса Список использованной литературы Для дальнейшего использования в производстве водяной газ необходимо очистить от сернистых соединений и провести конверсию оксида углерода по реакции: CO+H2O↔CO2+H2; ΔH<0 а затем полностью удалить диоксид углерода в случае его применения для синтеза аммиака. Недостатками процесса являются его периодичность, низкая единичная производительность газогенератора, а также высокие требования к сырью по количеству и температуре плавления золы, его гранулометрическому составу и другим характеристикам. Другим направлением является газификация топлива в виде пыли. Этот процесс позволяет использовать практически любые виды топлива. Его особенностями является высокая турболизация в зоне реакции за счет подачи встречных потоков топливной смеси и хорошее смешение парокислородной смеси с топливной пылью. Синтез - газ из жидких углеводородов. По технологическим схемам переработки в синтез – газ, жидкие топлива можно разделить на две группы. Первая группа включает топлива, перерабатываемые высокотемпературной кислородной конверсией. Сюда относятся тяжелые жидкие топлива - мазут, крекинг - остатки и т.п. Вторая группа - легкие прямоточные дистилляты (нафта), имеющие конечную температуру кипения не выше 200-220°С; она включает бензин, лигроины, смеси светлых дистиллятов. Вторая группа жидких топлив перерабатывается в синтез - газ каталитической конверсией водяным паром в трубчатых печах. Достоинством этого метода является возможность получения синтез - газа под давлением, легкость регулирования состава синтез - газа, малый расход электроэнергии. К недостаткам можно отнести высокие требования к углеводородному составу исходного сырья по содержанию в нем непредельных и циклических углеводородов, серы и других примесей, большой удельный расход углеводородов. Синтез-газ из природного газа. Синтез - газ из углеводородных газов (природного, попутного, газов переработки других топлив) в настоящее время является основным источником получения аммиака. По использованию окислителя и технологическому оформлению можно выделить следующие варианты процесса получения водородосодержащих газов: высокотемпературная кислородная конверсия, каталитическая парокислородная конверсия в шахтных реакторах, каталитическая паро-углекислотная конверсия в трубчатых печах. Окисление метана (основного компонента углеводородных газов) при получении синтез - газа протекает по следующим основным суммарным реакциям: CH4+0,5O2 = CO+2H2; ΔH=-35,6 кДж CH4+H2O = CO+3H2; ΔH=206,4 кДж CH4+CO2 = 2CO+2H2; ΔH=248,3 кДж Аналогичным образом осуществляются реакции окисления гомологов метана. Характеристика целевого продукта Аммиак (NH3) – бесцветный газ с резким запахом с температурой кипения -33,35 0С и температурой плавления -77,75 0С. Аномально высокие температуры кипения и плавления аммиака объясняются ассоциацией его молекул вследствие высокой их полярности и образования водородных связей. Критическая температура аммиака равна 132,4 0С. Аммиак хорошо растворим в воде (750 литров в литре воды), ограниченно растворим в органических растворителях. В водных растворах аммиака содержаться его гидраты состава NH3*H2O и 2NH3*H2O, образующие эвтектики, а также незначительное количество ионизированных молекул в результате реакции: NH3 + H2O = NH4++OH- Жидкий аммиак растворяет щелочные и щелочно-земельные металлы, фосфор, серу, йод и многие неорганические и органические соединения. При температурах выше 1300 0С аммиак диссоциирует на азот и водород: 2NH3 = N2 + 3H2 + ΔH Cухой аммиак образует с воздухом взрывчатые смеси, пределы взрываемости которых зависят от температуры. С повышение температуры границы взрываемости аммиачно-воздушных смесей расширяются и взрыв происходит при более низкой концентрации аммиака. (стр. 187-188 [1]) В промышленности выпускаются два сорта жидкого аммиака. Согласно ГОСТ 6221- 75 аммиак первого сорта должен содержать не менее 99,9 % и второго сорта 99,6 % аммиака. Физические постоянные аммиака.
Содержание примесей в жидком аммиаке регламентируется ГОСТ 6221-82. Наиболее типичными примесями являются вода, смазочные масла, катализаторная пыль, окалина, карбонат аммония, растворенные газы, (водород, азот, метан). Аммиак жидкий синтетический должен соответствовать следующим требованиям (ГОСТ 6221 - 82);
Физико-химические основы процесса 4.1 Равновесие и скорость процесса в системе Синтез аммиака из элементов осуществляется по уравнению реакции 1/2N2+3/2H2 = NH3; ΔH<0 Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (ΔH298 = -91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (ΔH725 = -112,86 кДж/моль). По принципу Ле Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае имеет тоже отрицательное значение (ΔS298 = -198,13 кДж/(моль*К), поэтому повышение температуры уменьшает вероятность протекания реакции. Реакция синтеза аммиака протекает с уменьшением объема. По принципу Ле Шателье в условиях равновесия содержание аммиака в смеси будет больше при высоком давлении, чем при низком. Для реакции синтеза константа равновесия имеет вид: Kp = P(NH3)/(P^(1/2)N2*P^(3/2)H2) И может быть рассчитана по уравнению: lg(1/Kp) = -A/T+B*lgT+aT-C*T2-b, где А,В,С – постоянные величины; коэффициенты а и b зависят от давления и возрастают с его увеличением. Качественная и количественная оценки условий термодинамического равновесия позволяют сделать вывод, что максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низких температурах. Синтез аммиака протекает с заметной скоростью только в присутствии катализатора, причем катализаторами данной реакции служат твердые вещества. Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм, который может быть описан следующими стадиями: 1. Диффузия молекул азота и водорода к поверхности катализатора. 2. Хемосорбция молекул реагентов (адсорбатов) на поверхности катализатора. 3. Поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействие между ними. 4. Десорбция продукта. 5. Диффузия продукта реакции (аммиака) от поверхности катализатора в газовую фазу. Исследование кинетики и механизма реакции синтеза позволило сделать вывод, что лимитирующей стадией процесса является хемосорбция азота. Этот вывод можно описать механизмом синтеза аммиака сокращенной схемой: N2+Z = ZN2 ZN2+3H2 = 2NH3 + Z N2+3H2 = 2NH3, где Z – свободный центр поверхности катализатора; ZN2 – хемосорбированная частица (адсорбат). Скорость обратимой реакции получения аммиака из элементов на большинстве известных катализаторов описывается уравнением Темкина-Пыжева: wгNH3 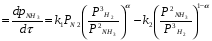 где k1 и k2 – константы скоростей соответственно образования и разложения аммиака; PN2,PH2,PNH3 – парциальные давления соответственно азота, водорода, аммиака, а – постоянная, удовлетворяющая неравенству 0<а<1 и характеризующая степень покрытия поверхности катализатора азотом. При проведении процесса при атмосферном давлении и температуре от 400 до 500 0С для промышленных катализаторов величина а = 0,5. 4.2 Выбор оптимальных условий процесса Скорость реакции синтеза аммиака зависит от температуры, давления и состава реакционной смеси. Оптимальными считаются такие значения параметров, при которых скорость процесса максимальна. 4.2.1 Давление и температура С ростом давления наблюдаемая скорость процесса увеличивается. И термодинамические, и кинетические факторы свидетельствуют в пользу проведения процесса при высоких давлениях (увеличивается равновесный выход, повышается скорость синтеза). Конденсация аммиака также улучшается при высоком давлении. Вместе с тем рост давления увеличивает расход электроэнергии на компрессию, повышает требования к машинам и аппаратам. При понижении давления упрощается аппаратурное оформление процесса, снижается расход энергии, но при этом увеличиваются размеры аппаратов, возрастают энергозатраты на циркуляцию газа и выделение аммиака, повышаются требования к чистоте синтез-газа. Для определения оптимального давления синтеза была использована комплексная математическая модель агрегата синтеза аммиака. В качестве критерия оптимизации в ней приняты приведенные затраты (руб./т): З = С + Е*К/П, где С – себестоимость аммиака (руб./т), Е – нормативный коэффициент эффективности (год-1), К – капитальные затраты (руб.), П – производительность агрегата по аммиаку (т/год). Опытные данные показали, что приведенные удельные и капитальные затраты с повышением давления уменьшаются. На основании проведенного анализа определено, что для современных схем наиболее эффективным является давление приблизительно 30 МПа (системы среднего давления). Поскольку присутствие инертных примесей равносильно снижению общего давления, то с увеличением содержания метана, аргона и гелия в смеси скорость реакции синтеза уменьшается. Оптимальная температура синтеза Топт рассчитывается: 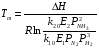 Из уравнения следует, что с увеличением содержания в циркуляционном газе аммиака и уменьшением содержания азотоводородной смеси оптимальная температура падает. 4.2.2 Состав азотоводородной смеси Состав АВС выбирается, возможно, более близким к стехиометрическому, что обеспечивает максимальную степень превращения компонентов в аммиак. Так как степень превращения не превышает 0,14 – 0,20 дол. един., то процесс синтеза аммиака строится по циркуляционной схеме с отделением образующегося аммиака от непрореагировавшей АВС и возращением оставшейся части ее в реактор. Так как синтез аммиака идет с сокращением объема, то в циркулирующей АВС накапливаются инертные примеси (аргон, метан), что приводит к снижению выхода аммиака вследствие уменьшения концентраций азота и водорода в ней. Для устранения этого часть циркулирующей АВС периодически выводится из цикла в виде продувочного газа (отдувка). Для выделения образовавшегося аммиака из АВС ее охлаждают до температуры сжижения аммиака. При этом часть аммиака остается в АВС. Концентрация его зависит от температуры и изменяется от 0,015 об. доли при -20 0С до 0,073 об. дол. при +20 0С при давлении около 30 МПа. При использовании водяного и аммиачного охлаждения это обеспечивает остаточное содержание аммиака в циркулирующей АВС 0,03 - 0,05 об. дол. 4.2.3 Катализатор Высокую каталитическую активность в синтезе аммиака проявляют металлы VI, VII и VIII групп периодической системы. Наибольшей активностью обладают Fe, Ru, Re, Os. В промышленности нашли применение железные катализаторы, получаемые сплавлением оксидов железа с активаторами (промоторами) и последующими восстановлением оксидов железа. В качестве активаторов применяются оксиды кислотного и амфотерного характера - Al2О3,SiО2,TiО2 и др., а также оксиды щелочных и щелочноземельных металлов - К2О, Na2О, CaO, MgO и др. Процесс восстановления катализатора можно описать суммарным уравнением: Fe3O4 + 4H2 → 3Fe + 4H2O; ΔH>0 Катализаторы синтеза аммиака необратимо отравляются сернистыми соединениями и хлором. Их концентрация в газе в сумме не должна превышать 5*10^(-5)%. Кислородосодержащие соединения (H2O, СО, СО2) и кислород, присутствующие в азотоводородной смеси, являются сильными каталитическими ядами, снижающими активность катализатора обратимо. Их отравляющее действие пропорционально содержанию в них кислорода. Если в составе свежего газа имеются кислородосодержащие примеси или масло, газ следует вводить в цикл перед вторичной конденсацией для удаления вредных соединений конденсирующимся NH3. В промышленности используется катализатор ГИАП состава: Fe + Al2O3 + K2O + CaO + SiO2 Катализатор Промотор Он дешев, достаточно активен при температуре 450-500 0С, менее остальных катализаторов чувствителен к каталитическим ядам. Контактную массу готовят сплавлением в атмосфере азота смеси оксидов железа Fe3O4, алюминия Al2O3, калия K2O, кальция CaO и кремния SiO2, или порошков металлических железа и алюминия с оксидами кальция и кремния и карбоната калия с последующим измельчением массы до размеров зерен катализатора (5 мм) и восстановлением их водородом в колонне синтеза аммиака. 4.3 Совершенствование аммиачного производства Совершенствование промышленного производства аммиака идет по следующим основным направлениям: - кооперация производства аммиака с производствами основного органического синтеза на базе использования природного газа и газов нефтепереработки. - создание агрегатов большой единичной мощности. - применение колонн синтеза с кипящим слоем катализатора. - разработка новых катализаторов, устойчивых к ядам с низкой температурой зажигания, позволяющих вести процесс синтеза без снижения выхода аммиака при низких давлениях. 4.4 Охрана окружающей среды в производстве аммиака Крупнотоннажное производство аммиака характеризуют следующие выбросы в окружающую среду: 1) газовые, содержащие в своем составе аммиак, оксиды азота и углерода и другие примеси 2) сточные воды, состоящие из конденсата, продуктов промывки реакторов и систем охлаждения; 3) низкопотенциальную теплоту. Относительная концентрация токсичных примесей производства аммиака в виде оксида углерода и оксидов азота в отходящих газах невысока, но когда происходит восстановление оксидов азота до элементного азота, для устранения даже незначительных выбросов разрабатываются специальные мероприятия. Полное исключение токсичных выбросов возможно при использовании каталитической очистки в присутствии газа-восстановителя. В результате воздушного охлаждения и замены поршневых компрессоров турбокомпрессорами значительно уменьшилось потребление воды на 1 т NН3, что привело к существенному снижению количества сточных вод (примерно в 50 раз). Низкопотенциальную теплоту удается утилизировать повышением ее потенциала: это достигается вводом некоторого количества высокопотенциальной теплоты. Но этот путь получения механической энергии связан с увеличением загрязненности воздушного бассейна дымовыми газами. Одним из способов уменьшения выбросов и повышения эффективности производства аммиака является применение энерготехнологической схемы с парогазовым циклом, в котором в качестве рабочей теплоты используется не только теплота водяного пара, но и продуктов сгорания топлива. Описание технологической схемы процесса  Технологическая схема процесса 1 - Подогреватель газа.2 - Колонна синтеза аммиака.3 - Подогреватель воды. 4 - Выносной теплообменник.5 – Циркуляционное колесо компрессора. 6 – Сепаратор жидкого аммиака.7 – Блок аппарата воздушного охлаждения. 8 – Конденсационная колонна.9 - Конденсационная колонна продувочных газов.10 – испаритель жидкого аммиака на линии продувочных газов. 11 – Сборник жидкого аммиака.12 – Испаритель жидкого аммиака на линии танковых газов.13 – Сепаратор.14 – Промежуточная дренажая ёмкость. 15 – Испарители житкого аммиака.16 – Магнитный фильтр. Свежая АВС, после очистки метанированием, поступает в центробежный компрессор, где сжимается до давления 32 МПа и после охлаждения в воздушном холодильнике (не показано на схеме) поступает в нижнюю часть конденсаторной колонны 8 для очистки от остаточных примесей СО2, H2O и следов масла. Свежий газ барботирует через слой сконденсировавшегося жидкого аммиака, освобождается при этом от водяных паров, следов СО и масла, насыщается аммиаком до 3-4 % и смешивается с циркуляционным газом. Полученная смесь по трубам теплообменника конденсационной колонны направляется в межтрубное пространство выносного теплообменника 4, где нагревается до 185-195 0С за счет теплоты газа, выходящего из колонны синтеза. Затем циркуляционный газ поступает в колонну синтеза 2. В колонне синтеза 2 газ проходит снизу вверх по кольцевой щели между корпусом колонны и кожухом насадки и поступает в межтрубное пространство внутреннего теплообменника, размещенного в горловине корпуса Колонны синтеза. В теплообменнике циркуляционный газ нагревается до температуры начала реакции 400-440 0С за счет теплоты конвертированного газа и, затем, последовательно проходит четыре слоя катализатора, в результате чего концентрация аммиака в газе повышается до 15 %. Пройдя через центральную трубу, при температуре 500-515 0С, азотоводородная смесь направляется во внутренний теплообменник, где охлаждается до 330 0С. Дальнейшее охлаждение газовой смеси до 215 0С осуществляется в трубном пространстве подогревателя питательной воды 3, в трубном пространстве выносного теплообменника 4 до 65 0С за счет холодного циркуляционного газа, идущего по межтрубному пространству, и затем в аппаратах воздушного охлаждения 7 до 40 0С, при этом часть аммиака конденсируется. Жидкий аммиак, сконденсировавшийся при охлаждении, отделяется в сепараторе 6, а затем смесь, содержащая 10-12 % NH3, идет на циркуляционное колесо компрессора 5, где сжимается до 32 МПа. Циркуляционный газ при температуре 50 0С поступает а систему вторичной конденсации, включающую конденсационную колонну 8 и испарители жидкого аммиака 15. В конденсационной колонне газ охлаждается до 18 0С и в испарителях за счет кипения аммиака в межтрубном пространстве до -5 0С. Из трубного пространства испарителей смесь охлажденного циркуляционного газа и сконденсировавшегося аммиака поступает в сепарационную часть конденсационной колонны, где происходит отделение жидкого аммиака от газа и смешение свежей АВС с циркуляционным газом. Далее газовая смесь проходит корзину с фарфоровыми кольцами Рашига, где отделяется от капель жидкого аммиака, поднимается по трубам теплообменника и направляется в выносной теплообменник 4, а затем в колонну синтеза 2. Жидкий аммиак из первичного сепаратора проходит магнитный фильтр 16, где из него выделяется катализаторная пыль, и смешивается с жидким аммиаком из конденсационной колонны 8. Затем его дросселируют до давления 4 МПа. и отводят в сборник жидкого аммиака 11. В результате дросселирования жидкого аммиака до 4 МПа происходит выделение растворенных в нем газов H2, N2, O2, CH4. Эти газы, называемые танковыми, содержат 16-18 % NH3. Поэтому таковые газы направляют в испаритель 12 с целью утилизации аммиака путем его конденсации при -25 0С. Из испарителя танковые газы и сконденсировавшийся аммиак поступают в сепаратор 13 для отделения жидкого аммиака, направляемого в сборник жидкого аммиака 11. Для поддержания в циркуляционном газе постоянного содержания инертных газов, не превышающего 10 %, производится продувка газа после первичной конденсации аммиака (после сепаратора 6). Продувочные газы содержат 8-9% NH3, который выделяется при температуре -25-(-30) 0С в конденсационной колонне 9 и испарителе 10 продувочных газов. Смесь танковых и продувочных газов после выделения аммиака используют как топливный газ. NH3(ж) 1 2 3 4 5 6 7 Операторная схема 1 2 3 4 31 12 23 24 402 401 34 03 Материальный баланс Состав потоков: 1) Колонна синтеза 2) Сепаратор 1 ступени (водяное и воздушное охлаждение 3) Сепаратор 2 ступени (аммиачный холодильник) 4) Танк 03 – поток свежей АВС: N2, H2, CH4 31 – поток газа в колонну синтеза: N2, H2, CH4, NH3 12 – поток газа после колонны синтеза: N2, H2, CH4, NH3 20 – поток продувочных газов 23 – поток газа после сепаратора 1 ступени 24 – поток жидкого NH3 после сепаратора 1 ступени 34 – поток жидкого NH3 после сепаратора 2 ступени 401 – поток жидкого NH3 402 – поток танковых газов: N2, H2, NH3 При охлаждении газа происходит частичная конденсация NH3, устанавливается равновесие между жидкостью и газом, причем концентрация аммиака после конденсации в газе, является функцией температуры и давления и определяется по формуле: 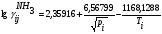 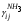 - концентрация аммиака в потоке% (по объему) - концентрация аммиака в потоке% (по объему) pi и Ti давление, ат. и температура, К газа В сепараторе 1 ступени: lgY(NH3 23)=2,35916+6,56799/(28*10,2)^(1/2)-1168,1288/(273+28)= -1,1330 , В сепараторе 2 ступени: lgY(NH3 31)=2,35916+6,56799/(30*10,2)^(1/2)-1168,1288/(273-5)= -1,6240 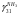 =0,0238 =0,0238Исходные данные для расчета
Материальный баланс По колонне синтеза: По азотоводороднои смеси 1) 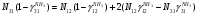 По сепаратору I ступени: По азотоводороднои смеси 2) 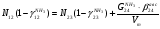 По аммиаку 3) 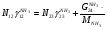 По сепаратору II ступени: По азотоводородной смеси 4) 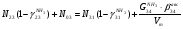 По аммиаку 5) 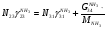 По танку: По азотоводородной смеси 6) 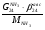 + +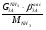 = =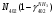 По аммиаку 7) 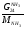 + +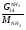 = =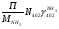 П - расчетное количество аммиака. b - растворимость авс в жидком аммиаке Соответствие переменных потокам:
Получаем уравнения 1) 1,02387X1-1,14X2=0 2) 0,86X2-0,9264X3-0,00125X6=0 3) 0,14X2-0,0736X3-0,0588X6=0 4) - 0,9762X1+0,9264X3+X4-0,00076X7=0 5) - 0,0238X1+0,0736X3-0,0588X7=0 6) - 0,6X5+0,00165X6+0,001X7=0 7) - 0,40X5+0,0588X6+0,0588X7=147,06 Составим матрицу коэффициентов при Х и столбец свободных членов:
Решаем систему уравнений матричным методом в программе Excel, умножая матрицу, обратную матрице коэффициентов на вектор свободных членов. Заполняем таблицу потоков. 1. Расчет количеств азота и водорода в АВС. N03=X4=301,622 кмоль 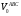 =N03×Vm=301,622×22,4 = 6756,33 м3 =N03×Vm=301,622×22,4 = 6756,33 м3Отношение H2: N2 =3: 1Wоб(H2) =0,75Wоб(N2) =0,25 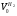 =0,75 × 6756,33 = 5067,25 м3 =0,75 × 6756,33 = 5067,25 м3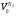 =0,25 × 6756,33 = 1689,08 м3 =0,25 × 6756,33 = 1689,08 м3m(H2) =V0(H2)*M(H2)/22,4=5067,25 *2/22,4=452,43 кг m(N2) = V0(N2)*M(N2)/22,4=1689,08 *28/22,4=2111,35 кг Общая масса АВС m(АВС) =m(H2) +m(N2) =452,43 +2111,35 =2563,78 кг Массовые доли азота и водорода: Wмас(H2) =m(H2)/m(ABC)*100%=452,43/2563,78=17,65% Wмас(N2)= m(H2)/m(ABC)*100%=2111,35/2563,78=82,35% 2. Расчет количеств водорода, азота и аммиака в танковых газах. 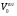 =N402×Vm=5,978×22,4 = 133,9 м3 =N402×Vm=5,978×22,4 = 133,9 м3Количество водорода и азота: NАВС=N402(1- 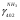 ) =5,978×(1-0,40) =3,5868 кмоль ) =5,978×(1-0,40) =3,5868 кмоль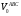 =NАВС×Vm=3,5868×22,4 = 80,34 м3 =NАВС×Vm=3,5868×22,4 = 80,34 м3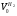 =0,75 × 80,34 = 60,255 м3 =0,75 × 80,34 = 60,255 м3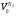 =0,25 × 80,34 = 20,085 м3 =0,25 × 80,34 = 20,085 м3m(H2) = V0(H2)*M(H2)/22,4=60,255*2/22,4=5,38 Wмас( 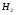 ) = m(H2)/m(ABC)*100%=5,38/2563,78=0,21% ) = m(H2)/m(ABC)*100%=5,38/2563,78=0,21%m(N2) = V0(N2)*M(N2)/22,4=20,085*28/22,4=25,12 кг Wмас( 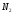 ) = m(Т2)/m(ABC)*100%=25,12/2563,78=0,98% ) = m(Т2)/m(ABC)*100%=25,12/2563,78=0,98%Количество аммиака в танковых газах. NNH3=N402× 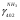 =5,978×0,40=2,39кмоль =5,978×0,40=2,39кмольV(NH3) =NNH3×Vm=2,39×22,4=53,56 м3 m(NH3) = V(NH3)*M(NH3)/22,4=53,56*17/22,4=40,65 кг Wмас( 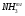 ) = m(NH3)/m(ABC)*100%=40,65/2563,78=1,58% ) = m(NH3)/m(ABC)*100%=40,65/2563,78=1,58%Количество жидкого аммиака. m(NH3) =2500 кг Wмас( 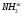 )= m(NH3)/m(ABC)*100%=2500/2563,78=97,5% )= m(NH3)/m(ABC)*100%=2500/2563,78=97,5%N(NH3) =147,06 кмоль V(NH3) =N(NH3) ×Vm=147,06 ×22,4=3294,14 м3 Общая расходная масса Må= 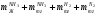 =2500+40,65+5,38+25,12=2571,15 кг =2500+40,65+5,38+25,12=2571,15 кгМасса танковых газов mтг= Må-  =2571,15-2500=71,15 кг =2571,15-2500=71,15 кгWмас(т. г) = m(т.г.)/m(ABC)*100%=71,15/2563,78=2,77% Невязка D=mавс - Må=2563,78-2571,15=7,37 Wмас(невязки) @0 Общий расходный объем(при н. у) Vå= 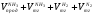 =3294,14 +53,56 +60,255 +20,085 =3428,04 м3 =3294,14 +53,56 +60,255 +20,085 =3428,04 м3Материальный баланс системы Базис расчета 2500 кг NH3
Расчет основных технологических показателей Выход аммиака n(NH3)= (1/2)*m(NH3)*M(N2)/(M(NH3)*m(N2))*100% = 1*2500*28/(2*17*2111,35)*100%=97,5% Расходные коэффициенты по сырью. По азоту а) теоретический 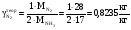 б) практический Y(N2)практ=m(N2)/m(NH3)= 2111,35/2500=0,8445 Поточная диаграмма По водороду а) теоретический 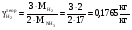 б) практический Y(H2)практ=m(H2)/m(NH3)=452,43/2500=0,1809 Список использованной литературы1.А.М. Кутепов, Т. И - Бондарева, М.Г. Беренгартен, Общая химическая технология, М., Высшая школа, 1990 2.Справочник азотчика, М., Химия, 1987 3.Ф.А. Андреев, С.И. Карган, Л.И. Козлов, В.Ф. Приставко, Технология связанного азота, М., Химия, 1966 4.Г.Н. Кононова, В.В. Сафонов, Е.В. Егорова, Расчёт материального баланса химико-технологических систем интегральным методом, М., МИТХТ, 1999 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 МОСКОВСКОВСКИЙ
МОСКОВСКОВСКИЙ