Производство метилового спирта вр 2. Курсовая работа ОХТ. Курсовая работа Производство метилового спирта Вариант 2 Студент Группа Преподаватель
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
Москва, 2020 ОглавлениеВведение 3 Исходное сырье 4 Характеристики целевого продукта 6 Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства 8 Технологические схемы производства метанола. 12 Расчет материального баланса ХТС 17 Материальный баланс 20 Выводы 23 Литература 24 ВведениеМетанол по значению и масштабам производства является одним из важнейших многотоннажных продуктов, выпускаемых современной химической промышленностью. Впервые метанол был обнаружен Боулем в 1661 г. в продуктах сухой перегонки древесины, метанол в чистом виде был выделен лишь через два столетия, в 1834 г., Думасом и Пелиготом. В это же время была установлена и его химическая формула. А в 1857 г. Бертло синтезировал метанол омылением метилхлорида. Известно несколько способов получения метанола: сухая перегонка древесины и лигнина; термическое разложение солей муравьиной кислоты; синтез из метана через метилхлорид с последующим омылением, и, наконец, неполное окисление метана на катализаторах или без катализаторов под давлением. Из перечисленных способов промышленностью освоено лишь получение метанола сухой перегонкой древесины. Интенсивное развитие производства метанола обусловливается постоянно расширяющимися многообразными сферами его применения. В народном хозяйстве едва ли найдется другой органический продукт, имеющий столь широкий круг потребителей. Метанол — это сырье для производства формальдегида, диметилтерефталата, метилметакрилата, пентаэритрита, синтетического изопренового каучука. Он используется в производстве фотопленки, различных аминов, поливинилхлоридных, карбамидных и ионообменных смол, в производстве красителей и полупродуктов, как растворитель, в том числе в лакокрасочной промышленности. Большие объемы метанола расходуются для получения химикатов, например, хлорофоса, фталофоса, карбофоса, метилхлорида и метилбромида, ацеталей и других веществ. Производство метанола из оксидов углерода и водорода впервые было осуществлено в Германии в 1923 г. Процесс проводился под давлением 25—35 МПа на цинк-хромовом катализаторе при температурах 320—380 °С. Благодаря ряду экономических и технических преимуществ метод получил быстрое повсеместное развитие и непрерывно совершенствовался на всех стадиях процесса. [1] К настоящему времени увеличились масштабы производства, изменилась структура сырьевой базы, резко расширился круг потребителей метанола. В 2013-2017 гг мировой импорт метанола вырос на 6,9%: с 28,3 до 30,2 млн т. Крупнейшим импортером является Китай. В 2017 г он ввез 7,7 млн т метанола, что составило 25,5% общего объема мирового импорта. Второе место по объему импорта метанола принадлежит США: в 2017 г они ввезли 2,5 млн т продукции, или 8,4% от совокупной величины импорта. В России по статистике на 2019 год было произведено 4.46 млн тонн метанола, что составляет примерно 5% от мирового объема производства. Это почти на 5% выше уровня 2018 года и на четверть больше объема спирта, произведенного в РФ пять лет назад. Исходное сырьеСинтетический метанол получают взаимодействием оксидов углерода и водорода на катализаторе при повышенных температурах и давлениях. Промышленные процессы, основанные на использовании оксидов углерода и водорода, широко распространены как в органической, так и в неорганической технологии. В связи с этим получение газового сырья для синтеза метанола во многом сходно с процессами получения технологического газа для таких производств, как синтез аммиака, бутанола и других высших спиртов, бензинов, парафинов и т. п. Однако ввиду различия в составах требуемого газа, а также технологических режимов и протекающих реакций в каждом отдельном случае получение исходного газа имеет свои особенности. Разрабатывая процессы получения газа для синтеза метанола, часто стремятся использовать уже известные процессы и оборудование, которые применяются в практике других производств, например, в производстве аммиака. Такие решения иногда бывают оправданы, но часто они приводят к тому, что последующая стадия синтеза осуществляется не в оптимальных условиях, что, безусловно, отрицательно сказывается на процессе в целом. Для синтеза метанола можно применять практически любой газ, содержащий водород и оксиды углерода. В первых производствах метанола, созданных в 30-е годы, в качестве сырья для получения газа использовали твердое топливо — кокс и каменный уголь. С освоением химической промышленностью нефтяных источников сырья и природного газа исходный газ для синтеза метанола стали получать путем крекинга нефтепродуктов и конверсии метансодержащих газов. В настоящее время в промышленной практике получения технологического газа для синтеза метанола применяют и газообразные, и жидкие углеводороды, и твердое топливо, и даже бытовые отходы. Наиболее распространенным сырьем является природный газ и газы нефтепереработки. Суммарные реакции получения метанола из оксидов углерода и водорода описываются уравнениями: СО + 2H2 → CH3OH CO2 + 3H2 → CH3OH + H2O Независимо от метода получения исходного газа в нем всегда присутствуют оксид и диоксид углерода. Основным отличием является обычно содержание диоксида углерода CO2, которое может меняться довольно в широких пределах. Практикой установлено, что газ для синтеза метанола должен содержать компоненты в соотношении, близком к стехиометрическому. Исходный газ может быть получен практически из любого вида сырья, содержащего углеводороды или углерод, однако для получения соотношения близкого к стехиометрическому, в большинстве случаев состав газа необходимо корректировать. Это обеспечивается дополнительными стадиями очистки, дозированием отдельных компонентов или смешением потоков газов, полученных разными способами. Одновременно с участвующими в процессе компонентами (H2, СО, CO2) в газе обычно присутствуют азот, аргон, метан, сероводород и другие соединения серы. Если азот, аргон и метан инертны при синтезе метанола и лишь приводят к нерациональному использованию сырья, то наличие соединений серы вызывает необратимое отравление катализатора синтеза метанола. Для удаления соединений серы газ подвергается двухступенчатой очистке. Обычно для получения исходного газа и его подготовки для синтеза метанола применяют парокислородную, паровую, паровую с дозированием диоксида углерода, высокотемпературную и некоторые другие виды конверсии. Конверсия – это процесс переработки газов с целью изменения состава исходной газовой смеси. Вид конверсии определяется технологическими факторами и в значительной степени зависит от состава природного газа. [1] Характеристики целевого продуктаФизические свойства Метанол СН3ОН — простейший представитель в гомологическом ряду предельных спиртов; его молекулярная масса 32,042. При нормальных условиях чистый метанол представляет собой бесцветную, легкоподвижную, легколетучую, горючую жидкость с запахом, подобным запаху этилового спирта. В свободном состоянии в природе метанол встречается редко и в незначительных количествах, но его производные содержатся во многих растительных маслах (сложные эфиры), природных красителях, алкалоидах (простые эфиры). Метанол при нормальных условиях (0оC, 0,1013 МПа) имеет следующие основные характеристики: Плотность 810,1 кг/м3 Вязкость 0,793 мПа-с Диэлектрическая проницаемость 37,92 Температура кипения 64,65 оС Температура затвердевания -97,70 оС Теплота сгорания 22331 кДж/кг [2] Химические свойства При взаимодействии метанола с щелочными металлами гидроксильный водород замещается металлом: 2CH3OH + 2Na → 2CH3ONa + H2 Метанол реагирует с минеральными и карбоновыми кислотами. При этом образуются сложные эфиры: CH3OH + CH3COOH →CH3COOCH3 + H2O Метанол может реагировать с галогенов водородными кислотами, галогенидами фосфора CH3OH + HCl→ CH3Cl + H2O С аммиаком метанол образует метиламины: СН3ОН + NH3 → CH3NH2 + Н2О СН3ОН + СН3NН2 → (CH3)2NH + Н2О CH3OH + (СН3)2NH2 → (СН3)3N + Н2О Эти реакции протекают в паровой фазе в присутствии катализаторов при 370—400 °С и повышенных давлениях. Дегидратацией на катализаторе при повышенных температурах получают диметиловый эфир: 2СН3ОН → (СН3)2О + Н2О При взаимодействии метанола и минеральных кислот образуются сложные эфиры. Этот процесс называется этерификацией, и его широко используют в промышленной практике для получения различных метиловых эфиров — метилхлоридов, метилбромидов, метилнитратов, метилсульфатов и др.: СН3ОН + H2SO4 → СН3SО3ОН + Н2О [2] Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производстваТермодинамика процесса Метиловый спирт – вещество, образующееся в результате взаимодействия оксидов углерода и водорода. Данные реакции синтеза метанола являются обратимыми и экзотермичными, т.е. протекающими с выделением тепла: СО + 2Н2 →СН3ОН; ΔH = -90,8 кДж CO2 + 3H2 → CH3OH + H2O ΔH = -49, 5 кДж Тепловой эффект приведенных реакций напрямую зависит от параметров процесса, в частности температуры и давлении. Повышение значений данных параметров влечет за собой увеличение количества выделяемой теплоты. С термодинамической точки зрения для смещения равновесия в сторону образования метанола необходимо проводить процесс при низких температурах и высоком давлении. Однако, для увеличения скорости реакции необходимо повышение температуры. При этом выбирая температурный режим, следует учитывать образование побочных продуктов: метана, высших спиртов, кетонов и эфиров. Приведем некоторые побочные реакции: СО + 3Н2 →СН4 + Н2О 2СО + 4Н2→(СН3)2О + Н2О 4СО + 8Н2 → С4Н9ОН + 3Н2О 2СО→СО2 + С т.е. процесс получения метанола является сложным. Побочные реакции обуславливают бесполезный расход синтез-газа и удорожают очистку метанола. Температура и давление Интервал оптимальных температур, соответствующих наибольшему выходу продукта, определяется активностью катализатора, объемной скоростью газовой смеси и давлением. С повышением температуры равновесный выход метанола понижается. Наиболее резкое понижение наблюдается при температурах выше 340°С. При повышении давления выход метанола почти прямо пропорционально увеличивается и резко возрастает степень превращения окиси и двуокиси углерода (при 380°С) Процесс синтеза метилового спирта в зависимости от температурного режима работы катализатора может быть осуществлен в двух вариантах А) высокотемпературный (катализатор 2,5ZnO*ZnCr2O4, температура 370-420, давление 20-35 МПа); Б) низкотемпературный (катализатор ZnO*CuO*Al2O3 или ZnO*CuO*Cr2O3, температура 250-300, давление 5-10 МПа) Катализатор Применяемый для синтеза метанола катализатор должен обладать высокой селективностью, т.е. максимально ускорять образование метанола при одновременном подавлении побочных реакций. Для синтеза метанола предложено много катализаторов. Лучшими оказались катализаторы, основными компонентами которых являются оксид цинка или медь. Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие катализаторы – необратимо. Необходима также тщательная очистка газа от карбонила железа, который образуется в результате взаимодействия оксида углерода с железом аппаратуры. На катализаторе карбонил железа разлагается с выделением элементного железа, что способствует образованию метана. Таким образом, процесс получения метанола является гетерогенно-каталитическим. Лимитирующая стадия – адсорбция водорода на поверхности катализатора. 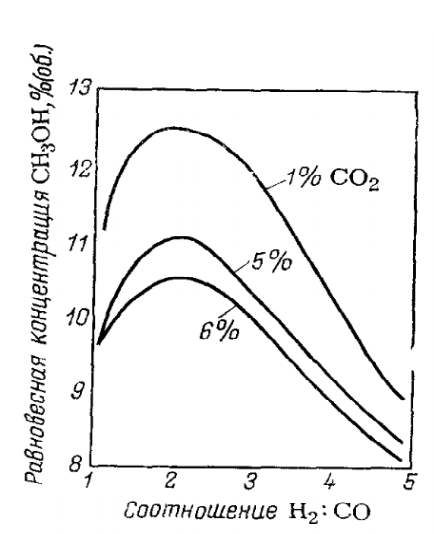 Соотношение H2 и CO Соотношение H2 и COРис 1. Зависимость равновесной концентрации метанола от соотношения H2:CO и кοнцентрации CO2 в газе при 24% (об.) инертных компοнентов В равновесной газовой системе метиловый спирт достигает максимальной концентрации в результате увеличения отношения H2:CO в исходном сырье и соответствие его стехиометрическому соотношению. С увеличением данного значения возрастает степени превращения оксидов углерода, причем для диоксида более интенсивно. Снижение данного соотношения снижает ступень превращения оксида и диоксида углерода в метиловый спирт, но увеличивает степень превращения водорода. Объемная скорость В производстве процесс синтеза осуществляется при объемных скоростях 20 000-40 000 ч-1 и выход метанола составляет около 4 % за один проход. При увеличении объемной скорости до 100 000 ч-1 степень превращения исходной смеси за один проход уменьшается, но при циклической схеме с рециркуляцией газов количество полученного метилового спирта возрастает, так как степень превращения снижается медленнее, чем увеличивается объемная скорость. Охрана окружающей среды в производстве метанола Газовые выбросы в производстве метанола подразделяют на две категории: постоянные и периодические. К постоянным относятся отходящие газы и пары, выделяющиеся из метанола-сырца на стадии дистилляции, а также продувочные газы из емкостей. Основной категорией выбросов в атмосферу являются периодические, которые возникают при остановках агрегатов, отдельных машин, аппаратов, узлов технологической линии. Из остановленных систем выбрасываются при продувке оставшиеся в них газы и пары. Основным направлением уменьшения периодических выбросов газов в окружающий воздушный бассейн является повышение надежности всех узлов системы, сведение количества остановок и пусков агрегатов до минимума, удлинение пробегов между ремонтами. Источником загрязнения биосферы в производстве метанола являются сточные воды. В них содержится до 0,3 % метанола и других кислородсодержащих соединений углерода. В основном это воды от промывки шламов и емкостей вместе с отходами со стадии очистки метанола. Практически полная очистка сточных вод достигается только при их биологической обработке. Биологическое окисление проводят в аэротенках с активным илом. Предельно допустимая концентрация метанола в сточных водах, поступающих на биохимическую очистку, до 200 мг/Л. Как правило, до поступления на биологические очистные сооружения сточные воды производства метанола многократно разбавляются сточными водами других производств и хозяйственно бытовыми водами. [3] Функциональная и химическая схемы синтеза метанола 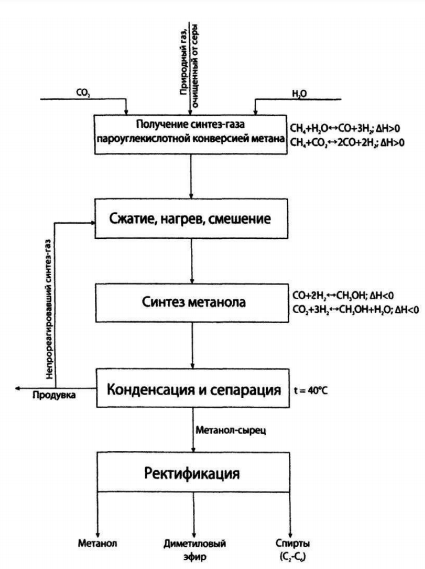 Из химической схемы вытекает: 1. Получение синтез-газа пароуглекислой конверсией метана с целью получения определенного соотношения H2:СО. 2. Возврат (рецикл) непрореагировавшего синтез-газа. 3. Смешение, нагрев и сжатие до соответствующих параметров в зависимости от используемого катализатора. 4. Охлаждение газа после синтеза с целью выделения метанола и при этом нагрев входящих в реактор потоков. 5. Разделение непрореагировавших газов и жидкой фазы. 6. Отделение метанола от побочных продуктов. [4] Технологические схемы производства метанола.Технологический процесс получения метанола из оксида углерода и водорода включает ряд операций, обязательных для любой технологической схемы синтеза: Предварительное очищение газа от карбонила железа, сернистых соединений Подогревание газа до температуры начала реакции Поступление газа в реактор синтеза метанола. По выходе из зоны катализа из газов выделяется образовавшийся метанол, что достигается охлаждением смеси, которая затем сжимается до давления синтеза и возвращается в процесс. (место для схемы) Рассмотрим процесс при высоком давлении 32 МПа 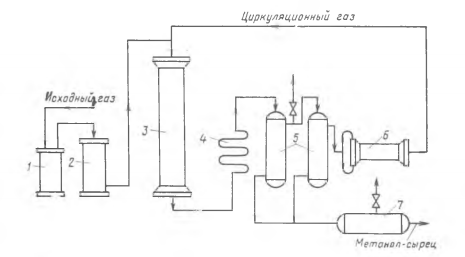 Рис 1. Схема агрегата синтеза с совмещенной насадкой колонны 1, 2 фильтры (масляный и угольный), 3 — колонна синтеза, 4 — холодильник-конденсатор, 5 — сепараторы, 6 — компрессор, 7 — сборник. [3] Сжатый до 32 МПа синтез-газ проходит очистку в масляном фильтре 1 и в угольном фильтре 2, после чего смешивается с циркуляционным газом. Смешанный газ, пройдя кольцевой зазор между катализаторной коробкой и корпусом колонны 3, поступает в межтрубное пространство теплообменника, расположенного в нижней части колонны (рис. 2). В теплообменнике газ нагревается до 330—340 °С и по центральной трубе, в которой размещен электроподогреватель, поступает в верхнюю часть колонны и проходит последовательно пять слоев катализатора. После каждого слоя катализатора, кроме последнего, в колонну вводят определенное количество холодного циркуляционного газа для поддержания необходимой температуры. После пятого слоя катализатора газ направляется в теплообменник, где охлаждается с 300—385 до 130 °С, а затем в холодильник-конденсатор типа «труба в трубе» 4. Здесь газ охлаждается до 30— 35 °С и продукты синтеза конденсируются. Метанол-сырец отделяют в сепараторе 5, направляют в сборник 7 и выводят на ректификацию. Газ проходит второй сепаратор 5 для выделения капель метанола, компримируется до давления синтеза турбоциркуляционным компрессором 6 и возвращается на синтез. Продувочные газы выводят перед компрессором и вместе с танковыми газами используют в качестве топлива. 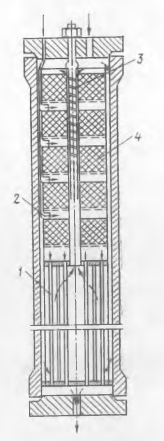 Рис 3. Колонна синтеза метанола: Рис 3. Колонна синтеза метанола: 1 – теплообменник; 2 – холодный байпас; 3 – электроподогреватель; 4 – катализатор. [3] Размещение теплообменника внутри корпуса колонны значительно снижает теплопотери в окружающую среду, что улучшает условия автотермичной работы агрегата, исключает наличие горячих трубопроводов, т. е. делает эксплуатацию более безопасной и снижает общие капиталовложения. Кроме того, за счет сокращения длины трубопроводов снижается сопротивление системы, что позволяет использовать турбоциркуляционные компрессоры вместо поршневых. Теперь рассмотрим процесс, протекающий при низком давлении, а именно 5 МПа. 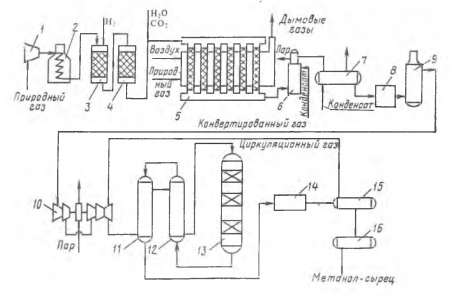 Рис. 3. Схема производства метанола при давлении 5 МПа: 1, 10 — турбокомпрессоры. 2 - подогреватель природного газа; 3 — реактор гидрирования сернистых соединений; 4 - адсорбер; 5 — трубчатый конвертор; 6— котел-утилизатор; 7, 11, 12 - теплообменники; 8, 14 — холодильники-конденсаторы; 9, 15 — сепараторы; 13 — колонна синтеза; 16 — сборник. [3] Процесс производства метанола при низком давлении включает практически те же стадии, но имеет некоторые особенности. Природный газ сжимается турбокомпрессором 1 до давления 3 МПа, подогревается в подогревателе 2 за счет сжигания в межтрубном пространстве природного газа и направляется на сероочистку в аппараты 3 и 4, где последовательно осуществляется каталитическое гидрирование органических соединений серы и поглощение образующегося сероводорода адсорбентом на основе оксида цинка. После этого газ смешивается с водяным паром и диоксидом углерода в соотношении СН4 : H2O : CO = 1 : 3,3 : 0,24. Смесь направляют в трубчатый конвертор 5, где на никелевом катализаторе происходит пароуглекислотная конверсия при 850—870 °С. Теплоту, необходимую для конверсии, получают в результате сжигания природного газа в специальных горелках. Конвертированный газ поступает в котел-утилизатор 6, где охлаждается до 280—290 °C. Затем теплоту газа используют в теплообменнике 7 для подогрева питательной воды, направляемой в котел-утилизатор. Пройдя воздушный холодильник 8 и сепаратор 9, газ охлаждается до 35—40 °С. Охлажденный конвертированный газ сжимают до 5 МПа в компрессоре 10, смешивают с циркуляционным газом и подают в теплообменники 11, 12, где он нагревается до 220—230 °С. Нагретая газовая смесь поступает в колонну синтеза 13, температурный режим в которой регулируют с помощью холодных байпасов. Теплоту реакционной смеси используют в теплообменниках 11, 12 для подогрева поступающего в колонну газа. Далее газовая смесь охлаждается в холодильнике-конденсаторе 14, сконденсировавшийся метанол-сырец отделяется в сепараторе 15 и поступает в сборник 16. Циркуляционный газ возвращают на синтез, продувочные и танковые газы передают на сжигание в трубчатую печь. 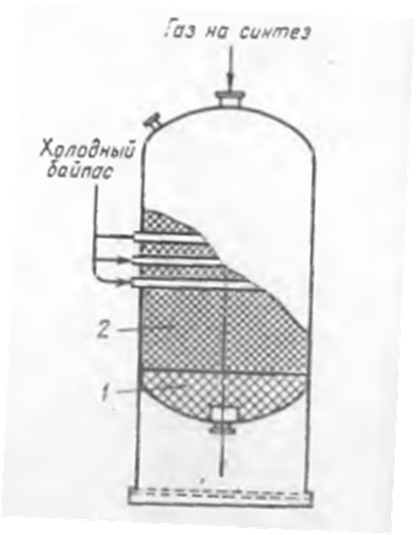 Рис. 4. Колонна синтеза метанола при низком давлении: 1 — фарфоровые шары; 2 — катализатор. [3] Расчет материального баланса ХТСИсходные данные
Основная реакция: СО + 2Н2 Побочные реакции: СО + 3Н2 = СН4 + Н2О 2СО + 4Н2 = (СН3)2О + Н2О Операторная схема синтеза метанола 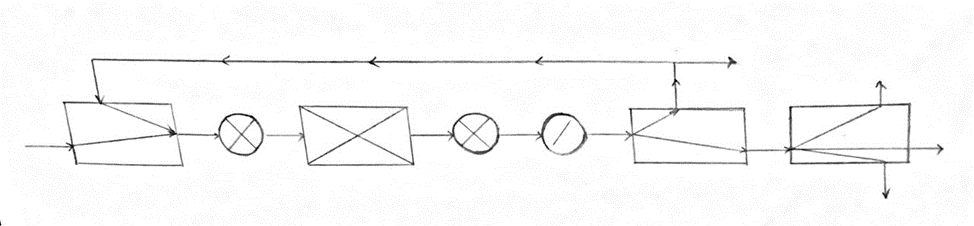 Структурная схема синтеза метанола. 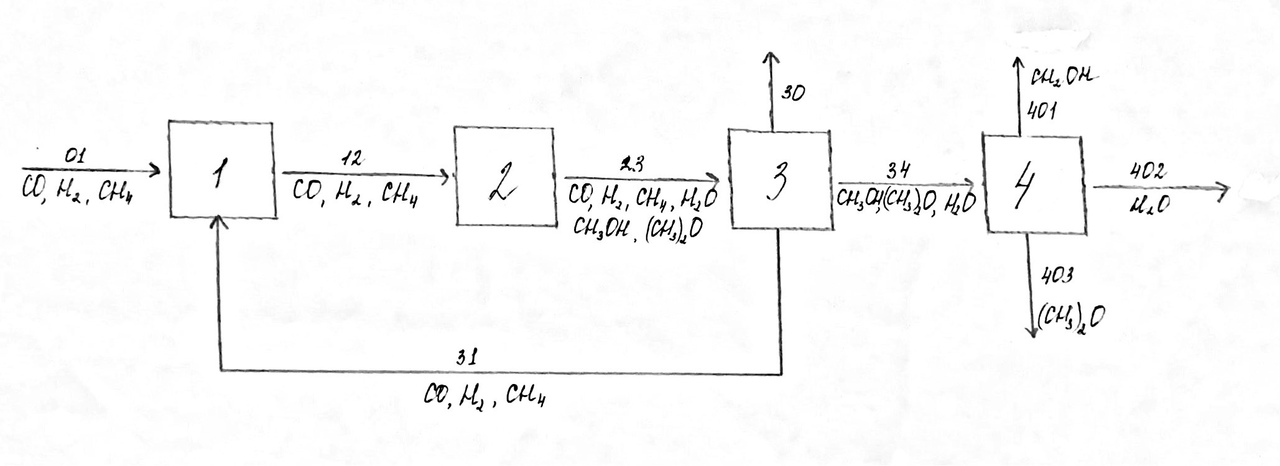 Потоки: 01 - свежий газ; 12 - Смесь газов; 23,34 – смесь продуктов; 31 – циркуляционный газ; 30 – отдувочный газ; 401 – метанол-ректификат; 402 – вода; 403 – эфир. Блоки: 1 – смешение; 2 – синтез; 3 – конденсация и сепарация; 4 – ректификация. (1) N01CO+N31ɣ31CO=N12CO (2) N01H2+ N31ɣ31H2= N12H2 (3) N12CO (1-X) = N31ɣ31CO+ N30ɣ31CO (4) N12H2=2N12CO X (φ403(CH3)2O+φCH3OHCO)+ N31ɣ31H2+ N30ɣ31H2+3 N12COX φCH4CO (5) (ПCH3OH ɷCH3OH)/MCH3OH = N12COXφCH3OHCO (6) N30ɣ31CH4 = ((N01H2+ N01CO)/ (1- ɣ01СH4)) ɣ01СH4+ N12COXφCH4CO (7) N403 = (8) G402 = N12COXφCH4CO MH2O + Соответствие переменных потокам
Матрица коэффициентов
Материальный баланс
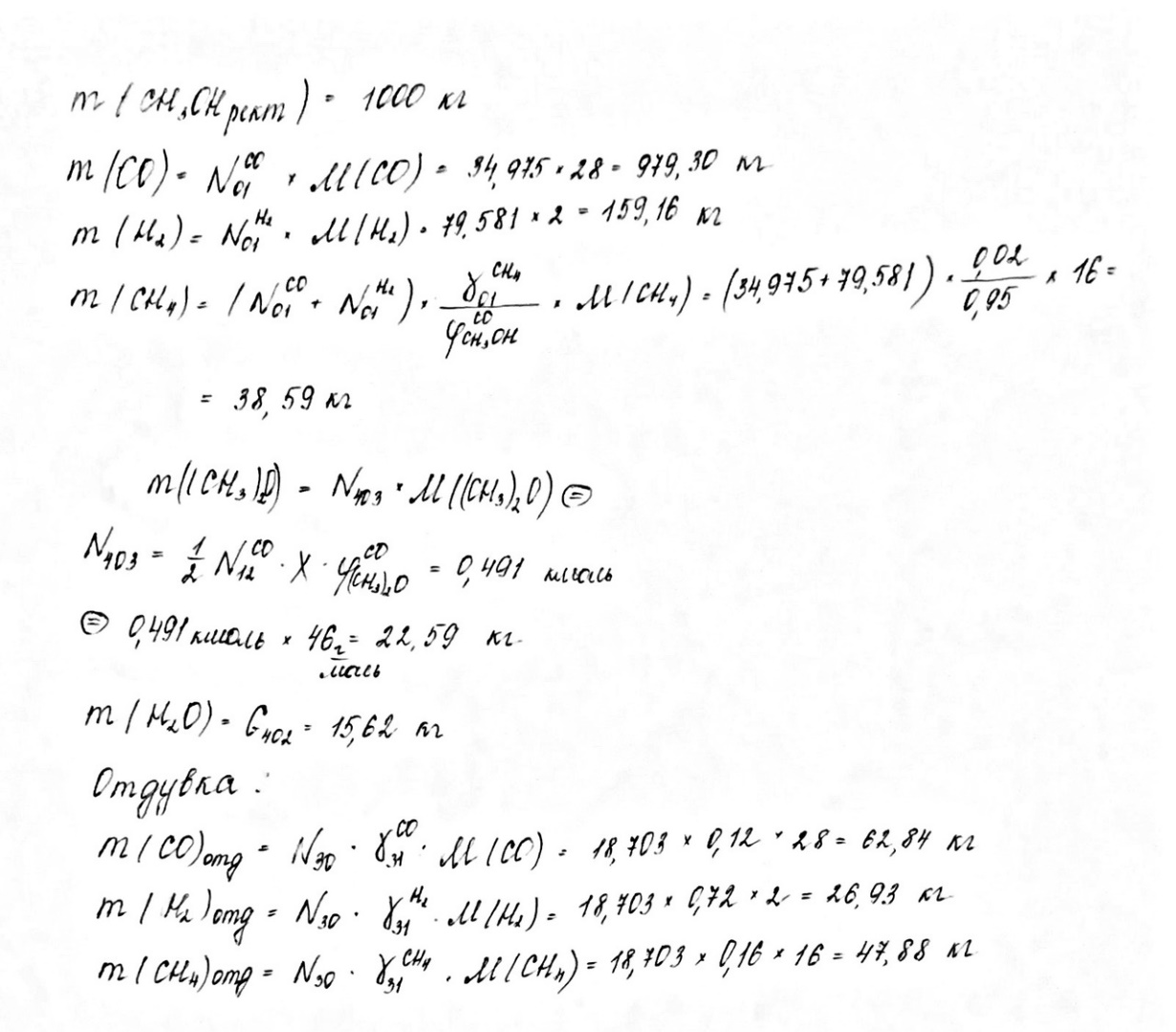  Поточная диаграмма синтеза метанола  ВыводыПринцип наилучшего использования сырья в нашем процессе достигается благодаря использованию рецикла, а также из-за высокой скорости процесса, которая достигается при использовании катализатора. Принцип наилучшего использования энергии – подогрев контактных газов теплом реакции, теплом фазовых переходов, теплоизоляция и сжигание продувки для тепла, избегание перегрева использованием водяных паров. Принцип наибольшей интенсивности процесса осуществляется посредством увеличения объемной скорости и применения одного из двух вариантов протекания процесса синтеза метилового спирта в зависимости от температурного режима работы катализатора: высокотемпературный (катализатор 2,5ZnO*ZnCr2O4, температура 370-420, давление 20-35 МПа); низкотемпературный (катализатор ZnO*CuO*Al2O3 или ZnO*CuO*Cr2O3, температура 250-300, давление 5-10 МПа). Принцип экологической безопасности производства В основе этого принципа лежит процесс производства, при котором вредные выбросы и отходы производства сводятся к минимуму. Для уменьшения периодических выбросов газов в окружающий воздушный бассейн сводят к минимуму количество остановок и пусков агрегатов, а также повышают надежность всех узлов системы. Используют фильтры, отстойники и очистные аппараты Принцип технологической соразмерности – противоречия между кинетикой и термодинамикой устраняется в проведении процесса по ЛОТ и рециклу. ЛитератураКараваев М.М., Мастеров А.П. Производство метанола. – М.: Химия, 1973. – 160 с. https://studwork.org/spravochnik/himiya/himicheskie-soedineniya/metilovyy-spirt Кутепов А.М., Бондарева Т.И., Баренгартен М.Г. Общая химическая технология. – М.: Высш. шк., 1990. – 520 с. Цыганков В.Н. Функциональные схемы химико-технологических систем [Электронный ресурс]: Учебно-методическое пособие / Цыганков В.Н., Устюгов А.В. — М.: Московский технологический университет (МИРЭА), 2018. – 25 с. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1981. – 608 с. Кононова Г.Н., Сафонов В.В., Егорова Е.В. Расчет материального баланса химико–технологической системы. – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 1999. – 26 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


