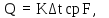курсовой проект аппарат для охлаждения и конденсации газового потока. курсовой проект 0401. Курсовой проект по пахт разработать конструкцию и рассчитать конденсатор для охлаждения и конденсации газового потока состава 25 H
 Скачать 1.48 Mb. Скачать 1.48 Mb.
|
1 Аналитический обзор рассматриваемого процессаПоверхностная конденсация осуществляется в теплообменниках – поверхностных конденсаторах. В общем случае в поверхностных конденсатор поступает перегретых пар. Очень часто охлаждающим агентом является вода. Введем обозначения: D - количество поступающего в конденсатор пара, кг/ч; Н- энтальпия поступающего пара, кДж/кг; tп- температура поступающего перегретого пара, °С; tнас - температура насыщения (конденсации) пара, °С; tж температура конденсата на выходе из аппарата, °С; сп - теплоемкость перегретого пара, кДж/(кг-°С); сж- теплоемкость конденсата, кДж/(кг.°C); r- теплота конденсации пара (теплота испарения жидкости), кДж/кг; W - количество воды, поступающей на охлаждение, кг/ч; св - теплоемкость воды, кДж/(кг.°C); tв.н - начальная температура воды, tв.к - конечная температура воды, °С; Qп- потери тепла в окружающую среду, кДж/ч. При принятых обозначениях энтальпию поступающего перегретого пара можно выразить соотношением H= сп (tн-tнас)+ r+ сж tнас И представить тепловой баланс процесса равенством DH+W св tв.н=D сж tж+ W св tв.к+ Qп Из которого определяют расход охлаждающей воды: 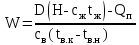 По условиям теплообмена охлаждающая поверхность конденсатора делится на три зоны: охлаждения перегретого пара, конденсации и охлаждения конденсата. Первой из них соответствуют наихудшие условия теплообмена, второй - наилучшие. В результате этого поверхности охлаждения приходится находить для каждой зоны в отдельности. Для определения их необходимо вычисление количеств тепла, передаваемого через поверхность охлаждения в каждой зоне, и промежуточных температур охлаждающей воды tв1 и tв2 (рисунок 1). 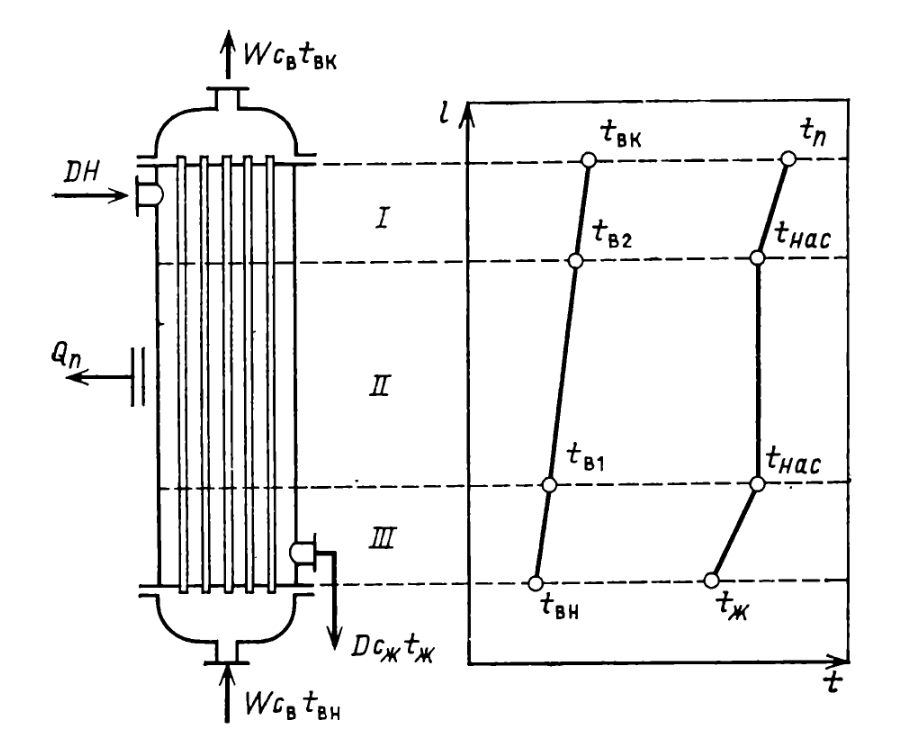 Рисунок 1 – К тепловому балансу процесса конденсации: Ⅰ - зона охлаждения перегретого пара; Ⅱ - зона конденсации; Ⅲ - зона охлаждения конденсата. Количество тепла, передаваемого через поверхность охлаждения в каждой из зон, находят из следующих равенств: для зоны охлаждения перегретого пара 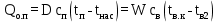 Для зоны конденсации 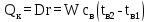 Для зоны охлаждения конденсата 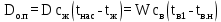 Промежуточные температуры охлаждающей воды: 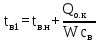 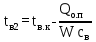 Значение требуемой поверхности теплообмена определяют по уравнению теплопередачи:
где F – площадь поверхности теплообмена, м2; K – коэффициент теплопередачи, Вт/(м2  час); час);Q – тепловой поток в аппарате, Вт/ч; 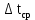 – средняя разность температур между теплоносителями, К. – средняя разность температур между теплоносителями, К.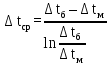 – температурный напор. – температурный напор.Для расчёта поверхности теплообмена удобнее всего принять, что аппарат работает в режиме идеального вытеснения, и разделить поверхности теплообмена на две части: зону конденсации и зону охлаждения конденсата. Теория процессаКонденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость. В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рисунок 2). 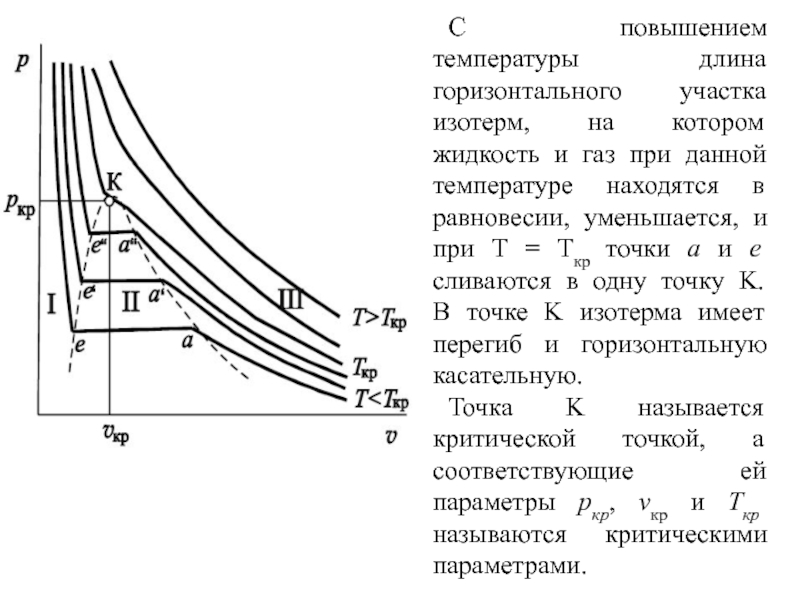 Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка Рисунок 2 - Изотермы реального газа. Основные физические свойства компонентов газового потока. Основные физические свойства этилового спирта при стандартных условиях: бесцветная летучая жидкость; имеет резкий запах и жгучий вкус; смешивается в произвольных отношениях с бензолом, водой, глицерином, ацетоном, метанолом; горюч, легче воды. Плотность этилового спирта 789,45 кг/м3 при 20 °C; 715,7 кг/м3 при 100 ºС, плотность паров 2,043 кг/м3 (0 ºС, 0,101 Мпа), 4,86 кг/м3 при 110 ºС. Температура кипения 78,39 °С. Стандартная мольная теплоёмкость Cp=1,197 Дж/моль·K (г) (при 298 К). Теплота испарения составляет 43250 кДж/моль при 20℃, 38938 кДж/моль при 77,4℃. Энтальпия кипения ΔHкип=839,3 кДж/моль. Этиловый спирт легко воспламеняется и в пожарном отношении очень опасен. Теплоёмкость пара этилового спирта при постоянном давлении равняется при температуре 108-220 ºС 1,897 кДж/(кг·К), при 350 ºС равна 2,562 кДж/(кг·К).[2]. Основные физические свойств воды при стандартных условиях: бесцветная летучая жидкость, не имеет вкуса и запаха, плотность 999,841 кг/м3 при 0℃; 999,8 кг/м3 при 8℃; 0,959 г/мл при 100 ℃. Плотность насыщенного пара при 100 ℃ составляет 0,598 кг/м3. Удельная теплоёмкость при 15℃ равна 4,1868·103Дж/(кг∙К). Температура кипения при 760 мм.рт.ст. и 100 ℃. Удельная теплота парообразования воды при атмосферном давлении и 100 °С 2250,8 кДж/(кг ∙ К). Теплопроводность водяного пара при атмосферном давлении и 100 °С равна 0,02 ккал/м ∙ ч ∙ °С. [3]. |