на сайт. Лабораторная диагностика у хорьков
 Скачать 2.64 Mb. Скачать 2.64 Mb.
|
|
Контрольная работа по дисциплине: «Болезни грызунов и экзотических животных» на тему: «Лабораторная диагностика у хорьков» Исследование мочи Мочу рекомендуется исследовать у каждого больного животного, так как в ней могут быть обнаружены изменения, свойственные патологическому состоянию при отсутствии выраженных клинических симптомов. Точность исследований зависит от того, каким способом, в каком состоянии и когда взята моча. Она должна быть чистой, без посторонних примесей. Чем меньше интервал времени между взятием мочи и исследованием, тем точнее результаты анализа. Для лабораторного исследования собирают первую утреннюю порцию мочи, так как она накапливается ночью, когда животное меньше всего подвержено воздействию внешних факторов, влияющих на качественный и количественный состав мочи. Способы взятия мочи: 1. Собирание мочи путем массажа мочевого пузыря через брюшную стенку. 2. Собирание мочи в мочеприемники. Применяя этот метод, можно определить суточное количество мочи. 3. Собирание мочи в клетке. В таких клетках в качестве мочеприемника используется металлическая сетка пола, ниже которой на 3-5 см располагается дно с наклоном посередине. На середине дна делается конусообразное отверстие, под него подставляется чистый сосуд. 4. Цистоцентез При физическом исследовании мочи определяют ее количество, цвет, прозрачность, консистенцию, запах, относительную плотность. Здоровые хорьки за сутки выделяют от 8 до 14 мл мочи. Увеличение суточного количества выделяемой мочи связано с усилением почечного кровотока. У больных животных полиурия наблюдается в период выздоровления после лихорадочных состояний, рассасывания отеков, экссудатов, транссудатов, при сахарном и несахарном диабете, циррозе почек, хронической недостаточности почек, нефросклерозе, у истощенных животных, при недостатке в рационе белка, солей. Уменьшение суточного количества мочи наблюдается у здоровых животных при недостатке питьевой воды, у больных – при сильном потении, лихорадке, рвоте, сердечной недостаточности, поносе, острой недостаточности почек, при отравлении ртутью, свинцом, мышьяком. Цвет мочи зависит от количества растворенных в ней пигментов, от удельного веса мочи, а также красящих и лекарственных веществ, поступающих в организм. Цвет мочи определяют при естественном освещении на белом фоне, сразу же после ее получения. Моча темнеет при хранении и на свету. Бесцветной моча становится при диабетах, нефросклерозе, интенсивно-желтой – при лихорадке, гипергидрозе, от желто-зеленого до темно-коричневого – при увеличении в моче количества желчных пигментов, от темно-коричневого до кроваво-красного – при наличии крови в моче (гематурия). Красно-коричневый цвет моча может приобретать при присутствии гемоглобина, черный – при присутствии метгемоглобина, темно-коричневый – при присутствии большого количества индикана. Белой моча может быть от примесей гноя при цистите, пиелонефрите. Молочно-белого цвета моча может быть при липурии у собак. Лекарственные вещества тоже окрашивают мочу: сантонин – в зеленовато-желтый цвет, метиленовая синь – в зеленовато-синий, деготь, фенол – от темно-зеленого до черного, карболовая кислота – от коричневого до черного, фенотиазин – в желтый. Прозрачность мочи определяют, рассматривая ее в посуде из прозрачного стекла. Моча считается прозрачной, если через слой мочи толщиной в 5 см хорошо читается типографский текст. Свежевыделенная моча у хорьков прозрачная и лишена осадка, отстоявшаяся моча через некоторое время мутнеет. Помутнение имеет вид облачка, состоящее из мукоида и щелочных фосфатов. Поэтому, важно установить, была ли моча мутная после выделения из уретры или она помутнела на воздухе. Моча с присутствием гноя все время остается мутной. Муть, вызванная присутствием жира, растворяется бензолом, эфиром или спиртом. Моча, содержащая много форменных элементов крови, становится более прозрачной после добавления 10%-ного раствора едкого натрия. Муть от присутствия мочекислых солей исчезает при подогревании мочи или прибавления к ней щелочи. Консистенция определяется путем переливания мочи из одного сосуда в другой. У хорьков моча водянистая или жидкая. Вязкой или желеобразной моча становится при воспалении мочевых путей, при уменьшении диуреза. В отношении обнаружения кристаллов общий анализ мои для хорьков не очень информативен, так как они могут быть вообще не обнаружены, но при этом заболевание уролитиаз присутствует. Таблица 1 – Химический анализ мочи
Исследование крови Кровь является жидкой тканью организма, в которой, как в зеркале, отражается его физиологическое состояние. Исследование крови позволяет в комплексе с клиническими исследованиями выявить скрытые, не проявляющиеся клинически, изменения в органах и тканях, то есть диагностировать субклиническую форму заболевания, определить возникшие осложнения при том или ином заболевании, дифференцировать сходные заболевания, судить о тяжести болезни, функциональном состоянии отдельных органов, следить за эффективностью лечения, прогнозировать заболевание. При заболевании кроветворных органов и паразитарных заболеваниях крови гемолитическому исследованию принадлежит решающее слово. Полное клиническое исследование крови слагается из исследования ее физических свойств, химического состава, морфологических особенностей, эритроцитов, лейкоцитов, тромбоцитов. При физическом исследовании определяют цвет крови, длительность кровотечения, ее свертываемость, вязкость, удельный вес, ретракцию кровяного сгустка, скорость оседания и резистентность эритроцитов. Химическое исследование состоит в определении реакции крови, щелочного резерва, гемоглобина, белка и белковых фракций, билирубина, остаточного азота, мочевины, мочевой кислоты, креатина, креатинина, холестерина, молочной кислоты, сахара, натрия, калия, кальция, магния, хлора, фосфора, протеазы, липазы, каталазы. При морфологическом исследовании определяют число, величину, форму и окраску эритроцитов, лейкоцитов, тромбоцитов, наличие в них включений, их дегенеративные изменения, процентное соотношение между отдельными видами лейкоцитов. Не обязательно проводить все эти исследования у каждого больного животного. Чаще всего определяют количество гемоглобина, эритроцитов, лейкоцитов, лейкоцитарную формулу и морфологические особенности этих клеток. При необходимости определяют скорость оседания эритроцитов, их осмотическую устойчивость, резервную щелочность, содержание билирубина и кальция в сыворотке крови. Методы сбора крови у хорька сравнимы с таковыми у кошек. Общими местами забора крови являются латеральная подкожная вена, головная вена, яремная вена, тыльная плюсневая вена и краниальная полая вена. Реже участками, не рекомендуемыми в условиях частной практики, являются хвостовая артерия хвост и глазничный синус. Яремная вена является наиболее доступным местом для забора крови у хорьков. Могут быть использованы различные методы сдерживания. Хорька можно поместить на спину или лежа на боку с вытянутой головой и вытянутыми/удерживаемыми передними лапами в каудальное направление. Мех следует подстригать над местом венепункции, а область смазывают дезинфицирующим раствором. Яремная вена хорька, в сравнении с таковой у кошки, лежит более латерально. Игла от 22-го до 25-го калибра вводится в вену в краниальном направлении, и кровь аспирируется в шприц. После извлечения иглы следует сильно надавить на область вкола, чтобы предотвратить образование гематомы. Второй метод заключается в том, чтобы уложить животное в положение лежа на груди, потянуть передние лапы вниз через край диагностического стола и наклонить голову в каудальном направлении. Третий метод предполагает, что животное удерживается за шкирку одним человеком, подвешивается перпендикулярно полу или диагностический стол, пока флеботомист выполняет венепункцию. В этой технике игла и шприц располагаются параллельно полу, и игла вводится перпендикулярно хорьку. Четвертый метод включает в себя надежное обертывание животного в полотенце, с открытыми головой и шеей. Краниальная полая вена также может быть использована для получения крови; Однако хорек должен быть под седацией, чтобы уменьшить риск разрыва сосуда иглой (при движении животного), что приводит к значительному внутреннему кровоизлиянию. У хорька без анестезии 2 ассистента должны обеспечить фиксацию животного. Животное кладут на спину на стол для осмотра, один человек удерживает и стабилизирует его голову, а другой человек удерживает нижнюю часть тела и вытягивает передние лапы в каудальном направлении. Мех следует подстригать над местом венепункции, а участок протирать дезинфицирующим раствором. Игла вводится в правую грудную вырезку (правый бок животного), пространство между рукояткой грудины и первым ребром. 0,5-дюймовая игла от 25 до 27 калибра, удерживаемая под углом 30° к относительной плоскости тела, вводится в каудолатеральном направлении, «нацеливая» его к левому бедру. При введении иглы флеботомист должен отвести ее назад, на поршень шприца для создания отрицательного давления. Как только кровь видна течет в канюлю иглы, флеботомист останавливает введение, и стабилизирует иглу и шприц, чтобы завершить сбор образца. После извлечения иглы следует оказать давление на место, но это только предотвратит поток крови из прокола кожи, но не останавливает любой поток, который может возникнуть внутри грудной полости. Латеральную подкожную вену можно использовать для забора небольшого количества крови для общего анализа крови. 2 человека зафиксируют неанестезированного хорька для взятия крови. Шерсть над местом венепункции с латеральной стороны ниже коленного сустава должна подстричься, а пораженный участок протереть дезинфицирующим раствором. Один человек удерживает верхнюю часть тела животного, а вторая – нижнюю, также он удерживает ногу и оказывает давление на сосуд в точке выше будущего вкола. В качестве альтернативы в качестве жгута можно использовать дренаж Пенроуза. Игла от 25-го до 27-го калибра в шприце объемом от 0,5 мл до 1,0 мл вводится в проксимальном направлении в сосуд, при этом флеботомист делает медленную, нежную аспирацию, чтобы предотвратить спадание вены. После извлечения иглы следует приложить сильное давление, для предотвращения образования гематомы. Процедура венепункции латеральной подкожной вены предплечья и забора крови аналогична процедуре у кошек. Однако, поскольку эта вена идеальна для установки внутривенного катетера, ее возможно, следует сохранить, выбрав альтернативное место венепункции. Ручное сдерживание можно осуществить, завернув животное в полотенце с открытой конечностью. Животное также можно удерживать за шкирку и вытягивать конечность, сдавливая пальцами или жгутом, наложенным проксимальнее места венепункции. Забор крови через хвостовую артерию очень болезненный. Кроме того, гематологические параметры могут сильно различаться при этом методе забора крови. Один человек удерживает животное в положении лежа на спине. Флеботомист, использующий иглу от 20 до 21 размера на 1-3 мл шприц, вводит иглу в бороздку по средней линии вентральной поверхности хвоста, начиная примерно на 2–5 см от основания хвоста и вставляя иглу под углом 45° в проксимальном направлении. Из-за артериального давления, место артериопунктуры должно быть закрыто на 3 минуты или дольше, чтобы обеспечить адекватный гемостаза и профилактику образования гематом. Предполагаемый объем цельной крови, основанный на массе тела, и рекомендуемом максимальном безопасном объеме крови, которые следует учитывать, приведены на рисунке 1. Было бы целесообразно собрать меньший объем крови (0,5% от массы тела) у гериатрических, анемичных, гипопротеинемических или иным образом клинически больных пациентов. 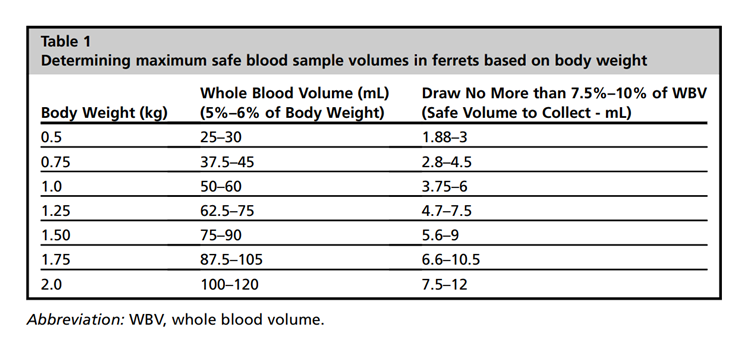 Рис. 1. Допустимые объемы проб крови у хорьков Таблица 2 – Общий анализ крови
Таблица 3 – Биохимический анализ крови
Цитологическое исследование Небольшой размер тела и длинная узкая форма делают хорьков почти идеальным объектом для цитологии, потому что почти все ткани и органы доступны при тонкоигольной аспирации. Тонкая аспирационая игла дает больше диагностических образцов, чем отпечатки тканей или соскобы. Их активная, несколько капризная природы может увеличить риск неблагоприятных последствий, таких как кровотечение и травма при взятии проб; но с адекватным ручным или химическим сдерживанием, можно предотвратить любые осложнения. Конкретная информация о цитологии хорьков в литературе ограничена, но большая часть установленных цитологических признаков поражений у собак и кошек непосредственно применимы и к заболеваниям хорьков. Цитологически у хорьков можно исследовать: кожные массы, выпоты в полости тела, ткани лимфатических узлов, новообразований, селезенки, смывы из носовой полости, трахеи, половых органов и многое другое. Оценка тканей и поражений заключается в определении того, является ли поражение воспалительным или невоспалительным. Воспалительные поражения характеризуются преобладанием клеток в составе инфильтрата. К ним чаще всего относятся гнойные, пиогранулематозные, гранулематозные и лимфоцитарные воспаления. Тип воспаления важно определить, потому что он часто дает ключ к разгадке причины воспаления. Гнойный экссудат обычно возникает при инфекционных поражениях, особенно бактериальных инфекциях. Следовательно, в мазках, с многочисленными нейтрофилами всегда следует тщательно искать бактерии. Макрофаги обычно многочисленны в поражениях, вызванных грибами, инородными телами, простейшими и микобактериями. Преобладание эозинофилов обычно связано с повышенной чувствительной реакцией, паразитизмом и редкими инфекционными агентами (например, Pythium sp.). Кератин и фрагменты волос из разорванных волосяных фолликулов в дерме обычно вызывают интенсивную воспалительную реакцию на инородное тело, содержащую много эозинофилов. Невоспалительные состояния могут далее классифицироваться как неопластические и неопухолевые поражения. Некоторые авторы заявляют, что у большинства хорьков к 5 годам развивается одно или несколько новообразований. При оценке доброкачественных новообразований первым шагом является классификация их как эпителиальных или мезенхимальных (соединительно-тканных). Классификация опухолей как злокачественных основывается на наличии морфологических критериев злокачественности, включающих в первую очередь ядерные. К ним относятся: мономорфная клеточная популяция; увеличение клеток; плеоморфизм клеток (изменчивость размеров и внешнего вида); анизоцитоз (изменение размера клеток); анизокариоз (изменение размера ядер); высокая ядерно-цитоплазматическое соотношение, вызванное увеличением ядер; многочисленные и аномальные митотические фигуры; многоядерность; вариации по количеству, размеру, и форма ядрышек. Опухоли кожи являются третьими по частоте новообразованиями у хорьков после эндокринных и гемолимфатических новообразований. Следовательно, большое количество очагов легкодоступны для взятия проб и цитологического исследования. Опухоли тучных клеток являются распространенной, если не самой распространенной опухолью кожи в хорьки. Они могут быть одиночными или множественными и могут присутствовать много месяцев без изменения внешнего вида. В отличие от собак тучноклеточные опухоли у хорьков ведут себя доброкачественно. Однако из-за биологически активных веществ в гранулах тучных клеток, таких как гистамин, они могут вызывать зуд, заставляющий животное царапать и жевать пораженный участок, что может привести к алопеции и изъязвлению. Мазки из аспиратов тучноклеточных опухолей состоят из дискретных полиэдрических (круглых) клеток с круглыми или овальными ядрами; зернистый хроматин; одно маленькое ядрышко; и умеренное количество цитоплазмы с мелкими фиолетовыми гранулами (рис. 2). 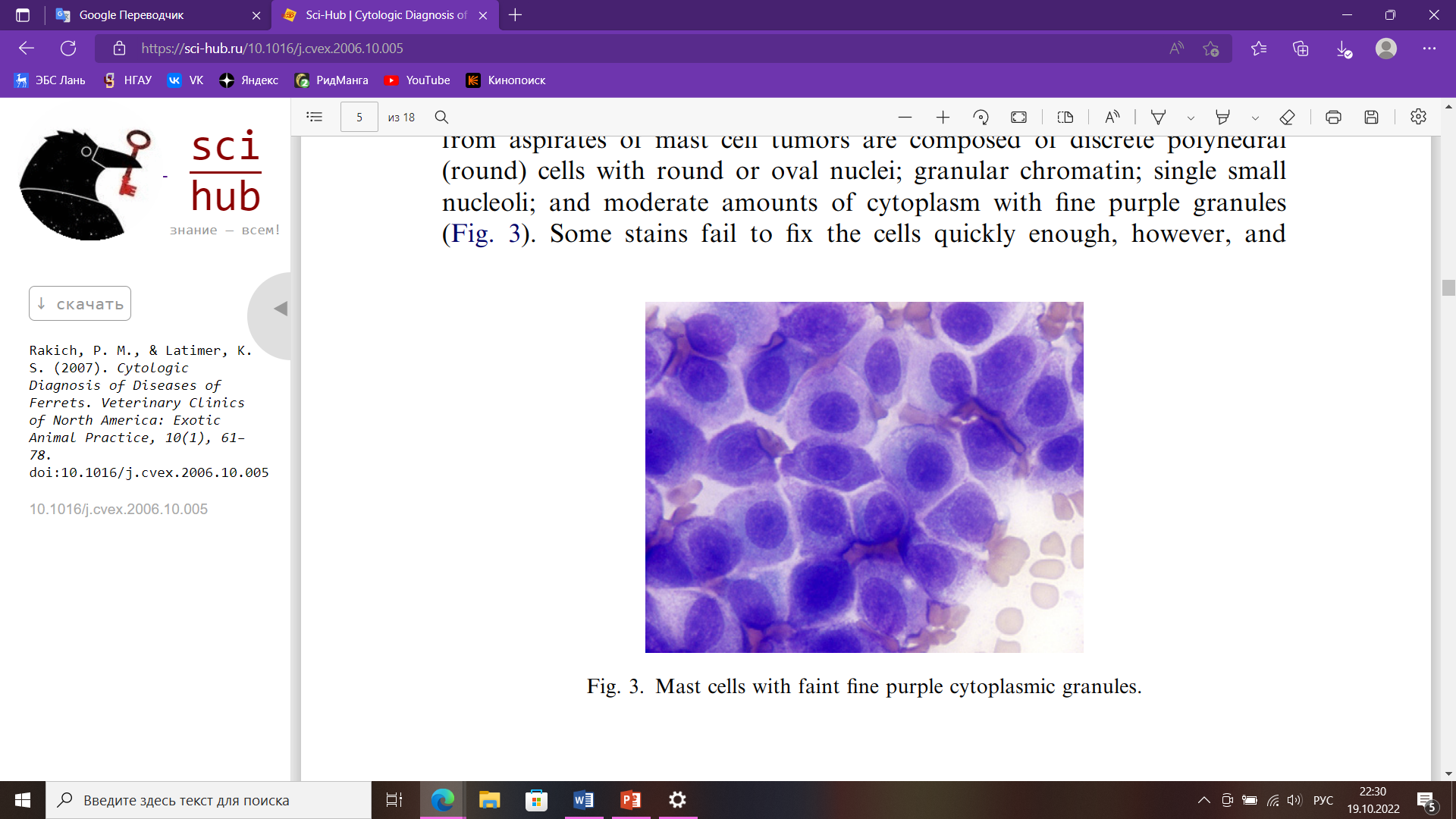 Рис. 2. Тучные клетки со слабыми мелкими фиолетовыми цитоплазматическими гранулами Выпоты в полости тела Свободная жидкость обычно отсутствует в грудной и брюшной полостях у хорьков. Аспирация жидкости из полостей тела может производиться как с диагностической, так и с лечебной целью, особенно в грудной полости, где наличие даже небольшого количества жидкости может нарушать легочную функция. Выпоты у хорьков встречаются редко. Наиболее частая причина выпоты у хорьков — это медиастинальный ЛСА у молодых животных. Несмотря на наличие вилочковой массы и плевральной жидкости, у пораженных животных часто не проявляют одышки из-за способности компенсировать ее. Мазки, приготовленные из аспирированной плевральной жидкость обычно умеренно- или высококлеточные и состоят из однородной популяции больших незрелых лимфоцитов (рис. 3). 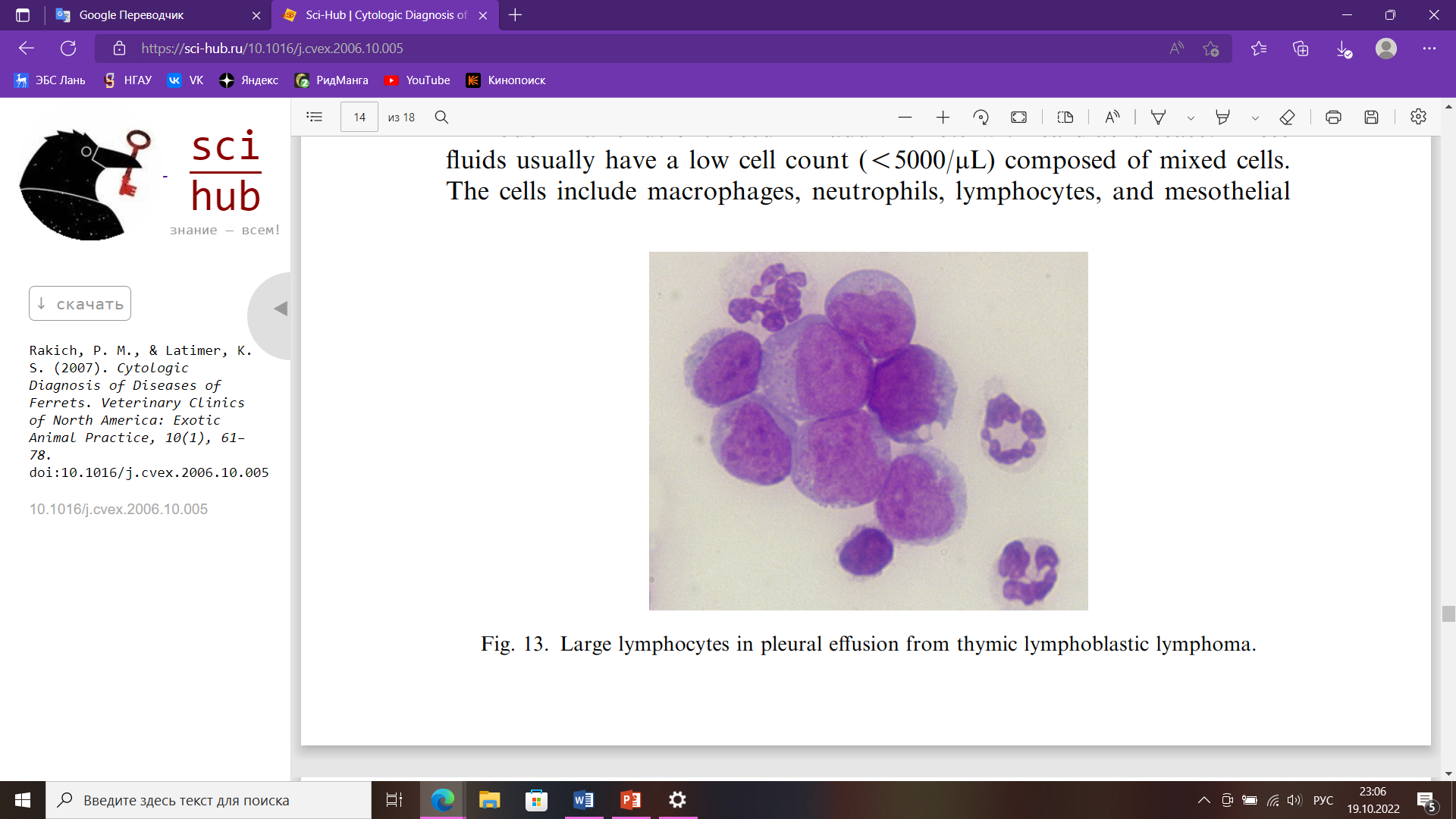 Рис. 3. Большие лимфоциты в плевральном выпоте от лимфобластной лимфомы тимуса У хорьков с сердечными червями также может развиться плевральный выпот. В таких случаях жидкость может содержать многочисленные эозинофилы. Брюшной выпот возникает у взрослых хорьков с сердечными заболеваниями. Эти жидкости обычно имеют низкое количество клеток (>5000/мл), состоящих из смешанных клеток. Клетки включают макрофаги, нейтрофилы, лимфоциты и мезотелиальные клетки. Макрофаги обычно содержат фагоцитированные эритроциты или гемосидерин в их цитоплазме. Мезотелиальные клетки имеют круглые или овальные ядра; хроматин; одно ядрышко; и умеренное количество от среднего до темного голубая цитоплазма, которая может иметь розовую кайму. Клетки располагаются одиночно и скоплениями. Мезотелиальные клетки подвергаются гипертрофии и гиперплазии с выпотом и проявляют переменный анизоцитоз и анизокариоз (рис. 4). Активированные мезотелиальные клетки фагоцитируют материал, и их трудно отличить от макрофагов. 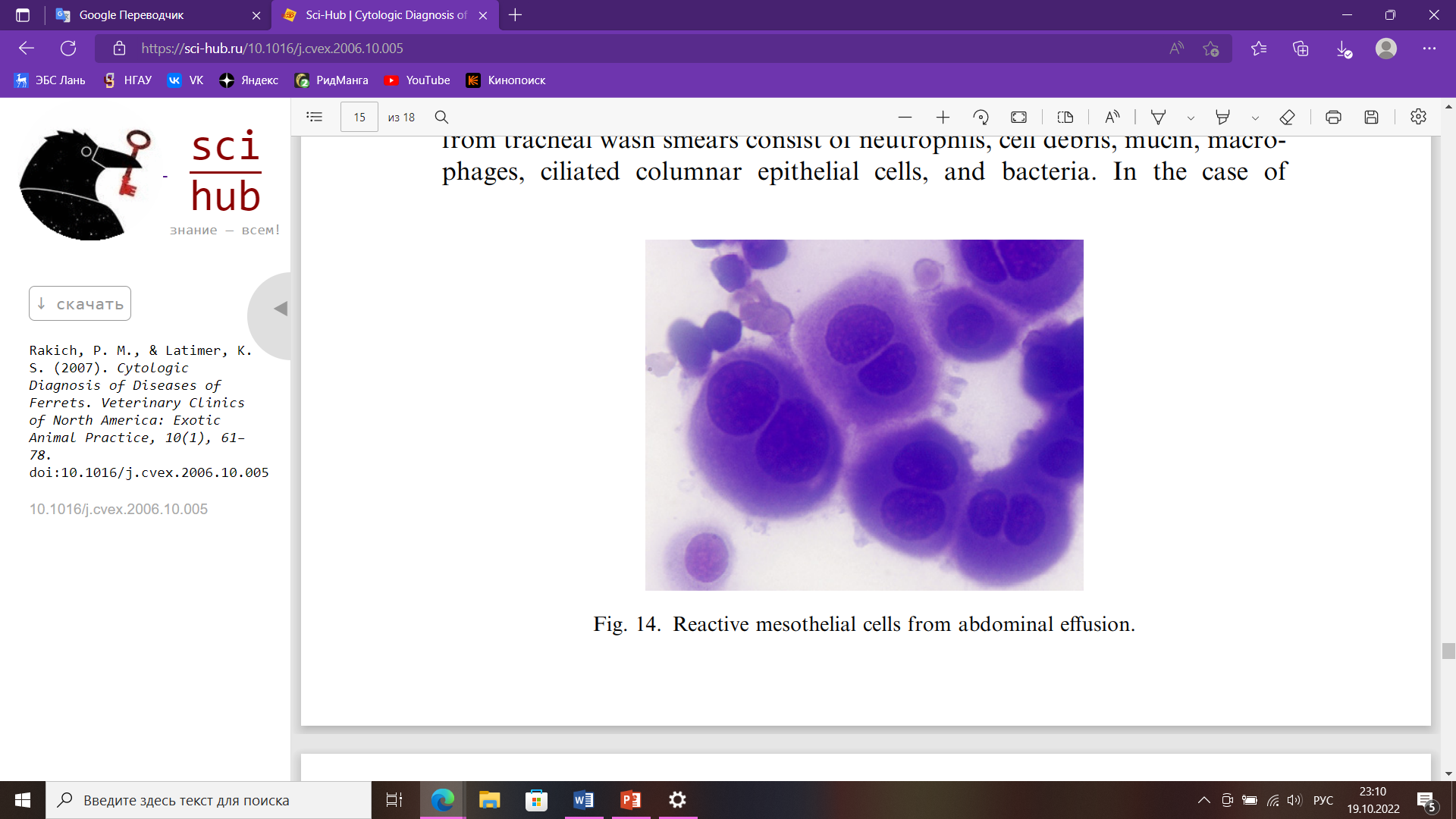 Рис. 4. Реактивные мезотелиальные клетки из брюшного выпота Селезенка Спленомегалия часто встречается у хорьков. Это происходит у здоровых хорьков и у хорьков с различными заболеваниями, и в большинстве случаев спленомегалия не имеет клинических проявлений. Однако тонкоигольная аспирация легко делается, обычно не требует какой-либо седации и не вызывает каких-либо побочных последствий. Аспираты мазков из селезенки при экстрамедуллярном кроветворении напоминают аспираты костного мозга и состоят из зрелых клеток крови, смешанных эритроидных клеток, мегакариоцитов и миелоидных клеток (рис. 5). Смешанные лимфоциты и плазматические клетки также могут присутствовать, потому что селезенка в норме содержит лимфоидные фолликулы и плазматические клетки. 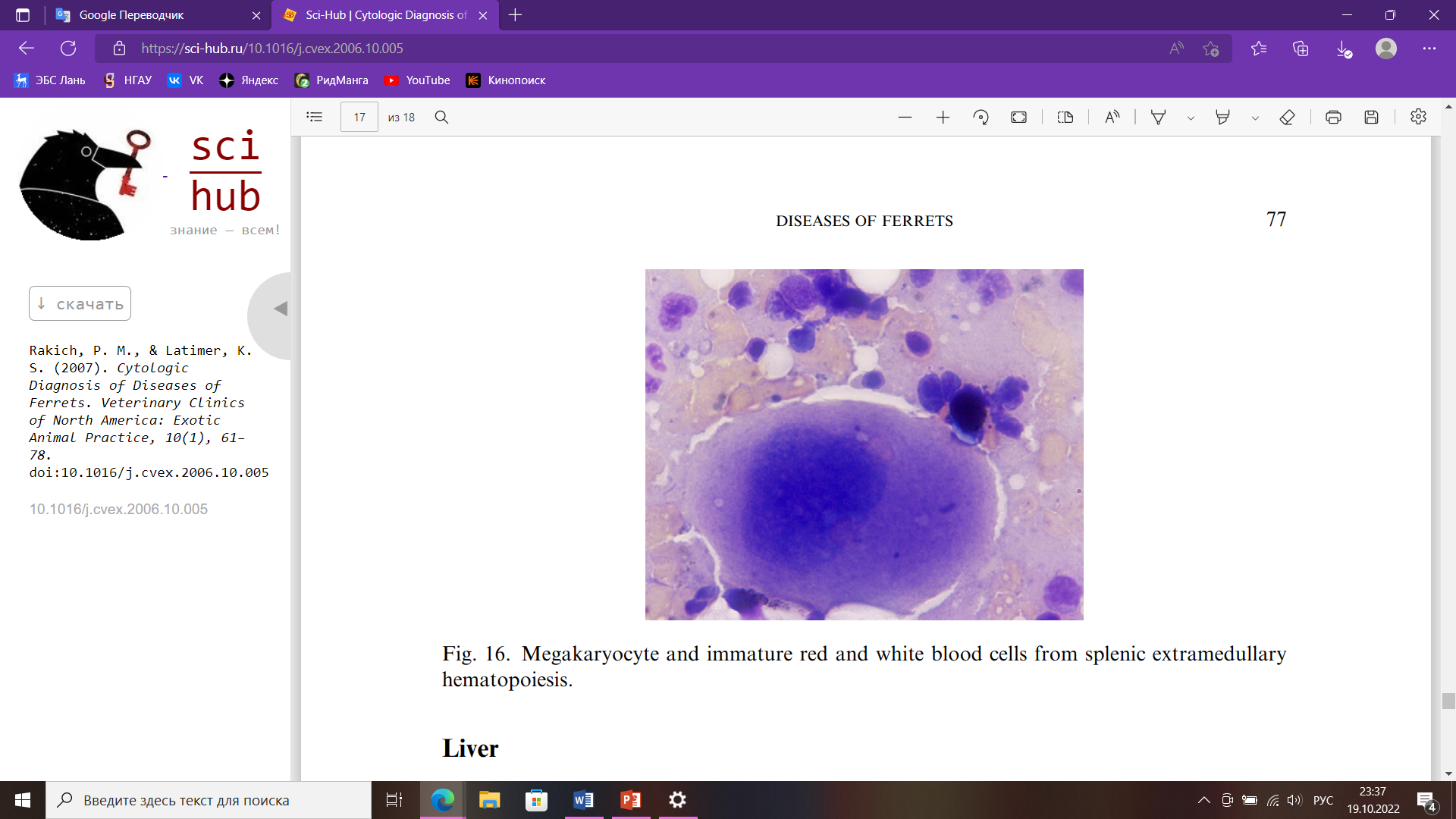 Рис. 5. Мегакариоциты, незрелые эритроциты и лейкоциты из селезенки экстрамедуллярного кроветворения Библиографический список Воронин С.Е. Хорьки, как лабораторные животные / С.Е. Воронин, М.Н. Макарова, К.Л. Крышень, А.А. Алякринская, А.В. Рыбакова. Международный вестник ветеринарии 2. 2016 – 130 с. Госманов, Р. Г. Лабораторные животные для микробиологических исследований : 2019-08-14 / Р. Г. Госманов, А. К. Галиуллин, Ф. М. Нургалиев. — Казань : КГАВМ им. Баумана, 2017. — 67 с. Давыдова А.Л. Заболевание надпочечников (гиперадренокортицизм) у хорька / А.Л. Давыдова, М.Ю. Метлякова, Т.С. Пасынкова // Известия Оренбургского государственного аграрного университета. — 2014. — № 2. — С. 110-112. Лелевич, С. В. Клиническая лабораторная диагностика : учебное пособие для спо / С. В. Лелевич, В. В. Воробьев, Т. Н. Гриневич. — 5-е изд., стер. — Санкт-Петербург : Лань, 2022. — 168 с. Соболев, В. Е. Урологические заболевания животных : монография / В. Е. Соболев. — Санкт-Петербург : Лань, 2022. — 596 с. Шулепова И.И. Лабораторная диагностика: учебное пособие для обучающихся направления 36.03.01 Ветеринарно-санитарная экспертиза ФГБОУ ВО Приморская ГСХА / ФГБОУ ВО Приморская ГСХА; сост. И.И. Шулепова. – Уссурийск: ФГБОУ ВО, 2019. – 88 с. Шеляков Михаил. Физиологические и клинические показатели хорьков. [Электронный ресурс] Режим доступа: https://doctor-veterinar.ru/khorki/o-khorkakh/fiziologicheskie-i-klinicheskie-pokazateli-khorkov. Дата обращения: 18.10.22. Blood Collection Techniques in Exotic Small Mammals. Journal of Exotic Pet Medicine. Volume 18, Issue 2, April 2009, Pages 117-139 Evaluation of erythrocyte morphology and prevalence of poikilocytes in peripheral blood of sick domestic ferrets (Mustela putorius furo). Journal of Exotic Pet Medicine. Volume 31, October 2019, Pages 86-90 Pauline M. Rakich, Kenneth S. Latimer. Cytologic Diagnosis of Diseases of Ferrets. Department of Pathology, College of Veterinary Medicine, University of Georgia, Athens, GA 30602, USA Stephen A. Smith, Kurt Zimmerman, David M. Moore, Hematology of the Domestic Ferret (Mustela putorius furo). |
