ЛАБ ДИАГНОСТИКа. Лабораторная диагностика вирусных инфекций
 Скачать 184.27 Kb. Скачать 184.27 Kb.
|
|
МЕББМ «ҚАЗАҚСТАН- НУО «КАЗАХСТАНСКО-  РЕСЕЙ МЕДИЦИНАЛЫҚ РОССИЙСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТІ» УНИВЕРСИТЕТ» СРСП Тема : Лабораторная диагностика вирусных инфекций Подготовил: Ажгиреев М. , Мачанлин Р. , Сеитпаева А., Абдыкаримов М. Курс: 2 Факультет: общая медицина Группа: 209 «А» Проверил(а):Адиетова Ж.Ф. Алматы 2016 Введение Расширение возможностей в лечении и профилактике вирусных болезней с использованием противовирусных препаратов, иммуномодуляторов и вакцин с различным механизмом действия нуждается в быстрой и точной лабораторной диагностике. Узкая специфичность некоторых противовирусных препаратов также требует быстрой и высокоспецифичной диагностики инфицирующего агента. Появилась необходимость в количественных методах определения вирусов для мониторинга противовирусной терапии. Помимо установления этиологии заболевания лабораторная диагностика имеет важное значение в организации противоэпидемических мероприятий. Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические мероприятия – карантин, госпитализацию, вакцинацию и пр. Реализация программ по ликвидации инфекционных заболеваний, например натуральной оспы, показала, что по мере их выполнения возрастает роль лабораторной диагностики. Существенную роль играет лабораторная диагностика в службе крови и акушерской практике, например, выявление доноров, инфицированных вирусом иммунодефицита человека (ВИЧ), вирусом гепатита В (HBV), диагностика краснухи и цитомегаловирусной инфекции у беременных. Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые культуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3-4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Диагностические методы В лабораторной диагностике вирусных инфекций имеются три основных подхода : 1) непосредственное исследование материала на наличие вирусного антигена или нуклеиновых кислот; 2) изоляция и идентификация вируса из клинического материала; 3) серологическая диагностика, основанная на установлении значительного прироста вирусных антител в течение болезни. При любом выбранном подходе к вирусной диагностике одним из важнейших факторов является качество исследуемого материала. Так, например, для прямого анализа образца или для изоляции вируса исследуемый материал должен быть получен в самом начале заболевания, когда возбудитель еще экскретируется в относительно больших количествах и не связан пока антителами, а объем образца должен быть достаточен для проведения прямого исследования. Также важен выбор материала в соответствии с предполагаемым заболеванием, то есть того материала, в котором исходя из патогенеза инфекции вероятность присутствия вируса наибольшая. Не последнюю роль в успешной диагностике играет среда, в какую берется материал, как он транспортируется и как хранится. Так, носоглоточные или ректальные мазки, содержимое везикул помещают в среду, содержащую белок, предотвращающий быструю потерю инфекционности вируса (если планируется его изоляция), или в соответствующий буфер (если планируется работа с нуклеиновыми кислотами). Прямые методы диагностики клинического материала Прямые методы – это методы, которые позволяют обнаружить вирус, вирусный антиген или вирусную нуклеиновую кислоту (НК) непосредственно в клиническом материале, то есть являются наиболее быстрыми (2–24 ч). Однако из-за ряда особенностей возбудителей прямые методы имеют свои ограничения (возможность получения ложноположительных и ложноотрицательных результатов). Поэтому они часто требуют подтверждения непрямыми методами. Электронная микроскопия (ЭМ). С помощью этого метода можно обнаружить собственно вирус. Для успешного определения вируса его концентрация в пробе должна быть примерно 1·106 частиц в 1 мл. Но поскольку концентрация возбудителя, как правило, в материале от больных незначительна, то поиск вируса затруднен и требует предварительного его осаждения с помощью высокоскоростного центрифугирования с последующим негативным контрастированием. Кроме того, ЭМ не позволяет типировать вирусы, так как у многих из них нет морфологических различий внутри семейства. Например, вирусы простого герпеса, цитомегалии или опоясывающего герпеса морфологически практически неотличимы. Одним из вариантов ЭМ, используемым в диагностических целях, является иммунная электронная микроскопия (ИЭМ), при которой применяются специфические антитела к вирусам. В результате взаимодействия антител с вирусами образуются комплексы, которые после негативного контрастирования легче обнаруживаются. ИЭМ несколько более чувствительна, чем ЭМ, и используется в тех случаях, когда вирус не удается культивировать in vitro, например при поиске возбудителей вирусных гепатитов [1]. Реакция иммунофлюоресценции (РИФ). Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики. В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам. При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител. Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей [2, 3]. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение. Иммуноферментный анализ (ИФА). Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также b-галактозидазу и b-лактамазы [4]. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально. Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала. Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте. Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены) [5, 6]. Радиоиммунный анализ (РИА). Метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков). Молекулярные методы. Первоначально классическим методом выявления вирусного генома считался высокоспецифичный метод гибридизации НК, но в настоящее время все шире используется выделение геномов вируса с помощью полимеразной цепной реакции (ПЦР). Молекулярная гибридизация нуклеиновых кислот. Метод основан на гибридизации комплементарных нитей ДНК или РНК с образованием двунитевых структур и на выявлении их с помощью метки. Для этой цели используются специальные ДНК- или РНК-зонды, меченные изотопом (32Р) или биотином, обнаруживающие комплементарные нити ДНК или РНК. Существуют несколько вариантов метода: – точечная гибридизация – выделенную и денатурированную НК наносят на фильтры и затем добавляют меченый зонд; индикация результатов – авторадиография при использовании 32Р или окраска – при авидин-биотине; – блот-гибридизация – метод выделения фрагментов НК, нарезанных рестрикционными эндонуклеазами из суммарной ДНК и перенесенных на нитроцеллюлозные фильтры и тестируемые мечеными зондами; используется как подтверждающий тест при ВИЧ инфекции; – гибридизация in situ – позволяет определять НК в инфицированных клетках [7]. ПЦР основана на принципе естественной репликации ДНК. Суть метода заключается в многократном повторении циклов синтеза (амплификации) вирусспецифической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок – так называемых праймеров. Каждый цикл состоит из трех стадий с различным температурным режимом. В каждом цикле удваивается число копий синтезируемого участка. Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25–35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения, как правило, с помощью электрофореза в агарозном геле. Метод высокоспецифичен и очень чувствителен. Он позволяет обнаружить несколько копий вирусной ДНК в исследуемом материале. В последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций (вирусы гепатитов, герпеса, цитомегалии, папилломы и др.) [8, 9]. Разработан вариант количественной ПЦР, позволяющий определять число копий амплифицированного сайта ДНК. Методика проведения сложна, дорогостояща и пока недостаточно унифицирована для рутинного применения. Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но при ряде инфекций по-прежнему должны применяться. Исследуются материалы аутопсии, биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом. При цитомегаловирусной инфекции, например, в срезах ткани или в моче обнаруживаются характерные гигантские клетки– "совиный глаз", при бешенстве – включения в цитоплазме клеток (тельца Бабеша–Негри). В некоторых случаях, например при дифференциальной диагностике хронических гепатитов, имеет значение оценка состояния ткани печени. Непрямые методы диагностики Выделение вирусов – один из самых старых и трудоемких методов диагностики. Однако и сегодня выделение вируса с последующей идентификацией с помощью одного из современных методов (ИФА с моноклональными антителами или ПЦР) является наиболее достоверным методом диагностики – так называемый "золотой стандарт". Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки. Как правило, берутся: – при респираторных инфекциях – носоглоточный смыв; – при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы); – при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа); – при экзантемных инфекциях – смывы (корь, краснуха); – при арбовирусных инфекциях – кровь, спинномозговая жидкость. Для выделения вирусов используют культуры клеток, лабораторных животных, эмбрионы кур. Процесс длительный, иногда требующий проведения нескольких пассажей, прежде чем вирус будет обнаружен и идентифицирован с помощью одного или нескольких методов – в реакции нейтрализации (РН), РИФ, ИФА или ПЦР. В настоящее время в большинстве случаев выделение вирусов заменено обнаружением вирусспецифических антигенов в инфицированных клеточных культурах с помощью указанных методов. Для этих целей широко применяются моноклональные антитела, особенно к ранним белкам возбудителя в РИФ или ИФА. Такой подход позволяет получить ответ уже через 24–72 ч после инфицирования клеток культуры тканей. Серодиагностика Серологическая диагностика, основанная на реакции антиген – антитело, может быть использована для определения как тех, так и других, и играет роль в определении этиологии вирусной инфекции даже при отрицательных результатах выделения вируса. Успех серологической диагностики зависит от специфичности реакции и соблюдения временных условий взятия крови, необходимых для синтеза организмом антител. В большинстве случаев используют парные сыворотки крови, взятые с интервалом в 2–3 нед. Положительной реакция считается по крайней мере при 4-кратном нарастании титра антител. Известно, что большинство специфических антител относятся к классам IgG и IgM, которые синтезируются в различное время инфекционного процесса. При этом IgM антитела относятся к ранним, и тесты, используемые для их определения, применяются для ранней диагностики (достаточно исследовать одну сыворотку). Антитела класса IgG синтезируются позже и длительно сохраняются. Для типирования вирусов применяется РН, при группоспецифической диагностике, например, аденовирусной инфекции, используют реакцию связывания комплемента (РСК). Наиболее употребительнымий являются реакция торможения гемагглютинации (РТГА), РСК, РИФ, реакции пассивной и обратной пассивной гемагглютинации (РПГА, РОПГА), различные варианты ИФА, практически повсеместно заменившего равный ему по чувствительности РИА. РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии. РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода является его недостаточно высокая чувствительность и трудность стандартизации реагентов. Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции. РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1:10 и более. РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови. ИФ метод также, как ИФА, применяется для определения антител в сыворотке. Все большее значение и распространение получает ИФА для диагностических целей. На твердую фазу (дно лунок полистироловых планшет или полистироловые шарики) сорбируется вирусный антиген. При добавлении соответствующих антител, находящихся в сыворотке, происходит их связывание с сорбированными антигенами. Наличие искомых антител обнаруживается с помощью анти-антител (например, человеческих), конъюгированных с ферментом (пероксидазой). Добавление субстрата и реакция субстрат – фермент дают окраску. ИФА может быть использована и для определения антигенов. В этом случае на твердую фазу сорбируются антитела. Моноклональные антитела. Большой прогресс в диагностике вирусных инфекций достигнут в последнее десятилетие, когда с развитием генно-инженерных исследований была разработана система получения моноклональных антител. Тем самым были резко повышены специфичность и чувствительность диагностических методов определения вирусных антигенов. Узкая специфичность моноклонов, представляющих небольшую долю вирусных белков, которые могут не присутствовать в клиническом материале, успешно преодолевается использованием нескольких моноклональных антител к различным вирусных детерминантам. Лабораторная диагностика сифилиса Наряду с традиционными разрабатываются новые более чувствительные и специфические методы. Особенности биологии бледной трепонемы обусловливают вариабельные ответы организма-хозяина, что клинически выражается в многофазности течения заболевания и сложности серологических реакций. Методы обнаружения бледных трепонем традиционно подразделяют на прямые (заражение животных, микроскопия в темном поле и т.д.) и непрямые серологические тесты для выявления AT. В свою очередь, серологические методы представлены двумя классами: 1) Нетрепонемные тесты, определяющие AT к липоидным АГ тканей хозяина или возбудителя (VDRL и RPR – плазмореагиновый тест); реактивность в этих местах обычно указывает на повреждение тканей и не всегда специфична в отношении сифилиса. Простота выполнения и низкая стоимость этих тестов позволяет использовать их как отборочные реакции для постановки предварительного диагноза сифилиса при соответствующих клинических симптомах. 2) Трепонемные тесты, в которых используются специфические АГ трепонем, обязательны для подтверждения диагноза (микрогемагглютинационный тест на AT к бледной трепонеме, РПГА и РИФ). Они являются более сложными и дорогостоящими, чем тесты 1-й группы. В перспективе предполагается использование новых прямых методов определения возбудителя – ИФА и ПЦР, клинические испытания которых дают хорошие результаты при диагностике врожденного сифилиса и нейросифилиса. Прямая визуализация патогенных трепонем является широко используемым и доступным методом бактериологического их обнаружения. Он заключается в исследовании возбудителя сифилиса непосредственно в тканевой жидкости из высыпных элементов, подозрительных на сифилитические проявления. Тканевую жидкость, полученную способом аппликации, скарификации или пункции, исследуют в наивном препарате в темном поле зрения или в окрашенных препаратах (по Романовскому Гимзе, по Бурри или после импрегнации по Фонтану и Морозову). Трепонемы можно выявить в экссудате из очагов поражения при первичном, вторичном свежем, вторичном рецидивном сифилисе, в пунктате, полученном из лимфатических узлов, в соке плаценты при родах. Отсутствие трепонем в типичных очагах поражения может быть обусловлено длительностью существования очага или предварительным лечением пациентов. Таблица . Методы серологической диагностики некоторых вирусных инфекций 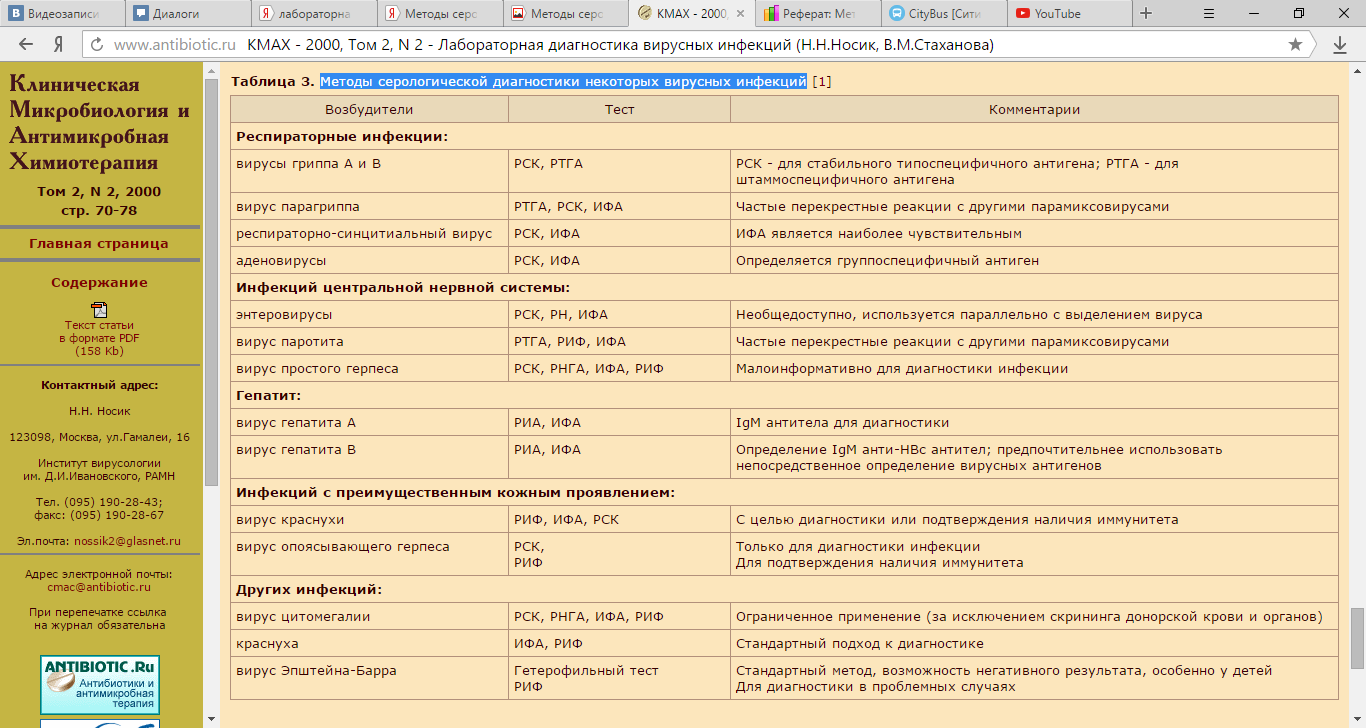 Заключение Количество методов, используемых для диагностики вирусных инфекций, непрерывно растет. Одни уходят в прошлое и имеют в основном историческое значение, другие совершенствуются. Несомненно, что технический прогресс в определении антител, белкового анализа и генодиагностики наряду с расширением наших знаний вирусов и патогенеза вирусных инфекций приведут к появлению новых высокоспецифичных и высокочувствительных методов, удобных для клинического применения. В настоящее время выпускается большое количество коммерческих сертифицированных тест-систем, в том числе и отечественных, для диагностики наиболее распространенных и социально значимых вирусных инфекций. Государственный реестр содержит более 600 диагностических препаратов. Однако далеко не для всех групп вирусов имеются диагностические тест-системы. Например, из большой группы энтеровирусов (более 80 членов) только для определения вирусов полиомиелита имеются тест-системы, в то же время для диагностики ВИЧ-инфекции выпускается более 15 различных наборов. |
