Метода. Методичка для выполнения ЛР. Лабораторная работа Определение константы диссоциации слабого электролита Оборудование и реактивы
 Скачать 1.84 Mb. Скачать 1.84 Mb.
|
Обработка результатов эксперимента1. Заполнить таблицу:
где СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – берется из условий эксперимента, мл; 2. По данным таблицы построить 3 графика в координатах а) [Fe]общ/D = f([KCNS]-1), б) [Fe]общ/D = f([KCNS]-2), в) [Fe]общ/D = f([KCNS]-3). 3. Для каждого графика построить линию тренда (формат линии тренда: аппроксимация – линейная, показывать уравнение на диаграмме, поместить на диаграмму величину достоверности аппроксимации R2). 4. По уравнениям линий тренда для каждого из трех случаев вычислить значения констант нестойкости по формуле: где a – линейный член уравнения линии тренда, b – угловой коэффициент уравнения линии тренда. 5. Вычислить изменение энергии Гиббса диссоциации роданидного комплекса железа по формуле: 6. Определить значение где 7. Результаты вычислений по п.п. 4, 5, 6 занести в таблицу:
8. Сделать вывод об устойчивости роданидного комплекса железа на основании величины константы нестойкости и значения энергии Гиббса. 9. Сравнить полученные значения энергии Гиббса образования роданидных комплексов железа со справочными данными. Пример обработки экспериментальных данных как показано на рисунке. 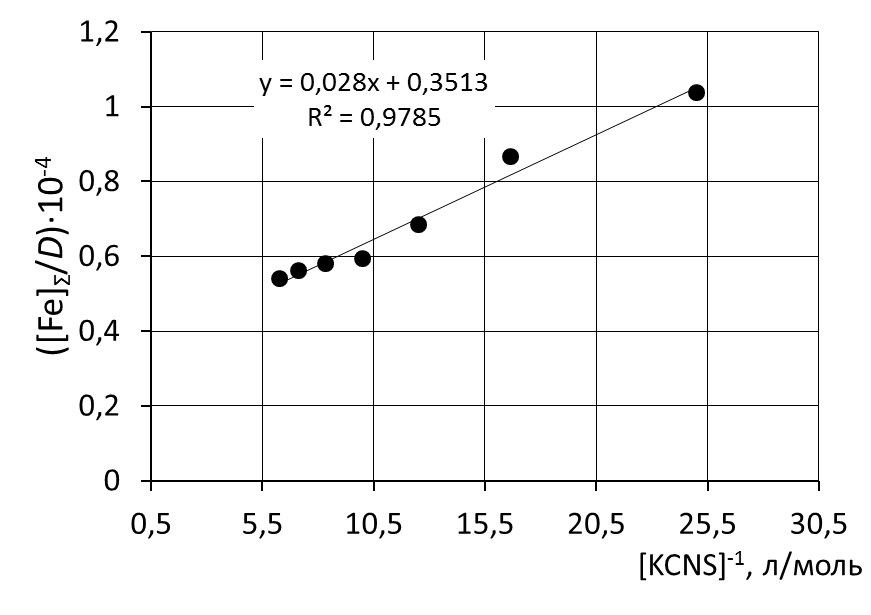 при обработке зависимости данные эксперимента использованы полностью  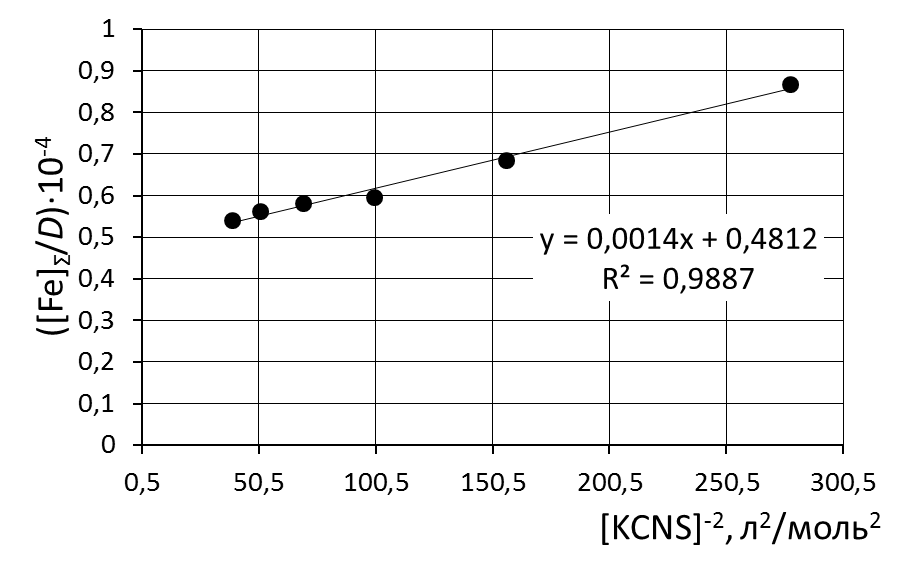  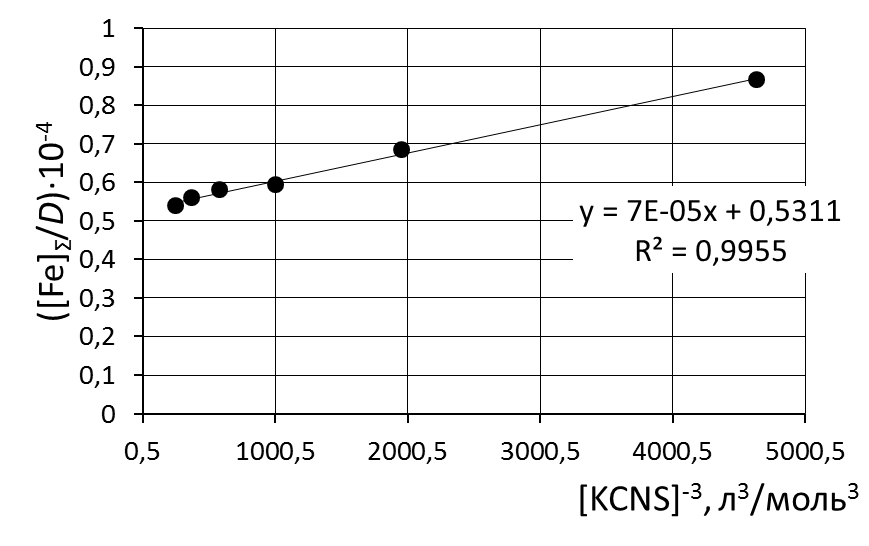 при обработке зависимостей первая экспериментальная точка (отмечена красным) удалена а) [Fe]общ/D = f([KCNS]-1) Уравнение линии тренда: [Fe]общ/D = 0,028·[KCNS]-1 + 0,3513 б) [Fe]общ/D = f([KCNS]-2) Уравнение линии тренда: [Fe]общ/D = 1,4·10-3·[KCNS]-2 + 0,4812 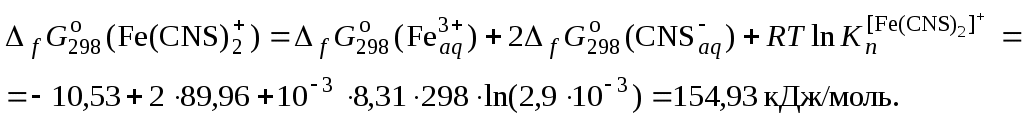 в) [Fe]общ/D = f([KCNS]-3) Уравнение линии тренда: [Fe]общ/D = 3·10-5·[KCNS]-3 + 0,5851
|
