Метода. Методичка для выполнения ЛР. Лабораторная работа Определение константы диссоциации слабого электролита Оборудование и реактивы
 Скачать 1.84 Mb. Скачать 1.84 Mb.
|
Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. Лабораторная работа № 3. Молекулярная адсорбция на активированном углеОборудование и реактивыПеремешивающее устройство (шейкер); бюретка объемом 25 мл – 1 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 5 мл – 1 шт.; колбы круглые объемом 250 мл – 4 шт.; колбы конические объемом 250 мл – 6 шт; стакан химический объемом 150 мл – 1 шт.; стакан химический объемом 50 мл – 1 шт.; стакан химический объемом 250 – 300 мл – 1 шт.; воронка химическая - 4 шт.; фильтр беззольный «белая лента» – 4 шт.; гидроксид натрия – 0,1 н. раствор; фенолфталеин; растворы карбоновых кислот (муравьиной, уксусной). Выполнение работы1. Получить у преподавателя раствор кислоты. 2. Отобрать пробу кислоты в химический стакан объемом 150 мл. 3. Приготовить 4 раствора путем последовательного разведения в 2 раза: 3.1. В круглые колбы № 2, № 3 и № 4 отобрать мерной пипеткой по 50 мл дистиллированной воды; 3.2. В колбы № 1 и № 2 мерной пипеткой объемом 50 мл поместить по 50 мл исходного раствора кислоты; 3.3. Из колбы № 2 при помощи мерной пипетки 50 мл раствора перенести в колбу № 3 и перемешать. 3.4. Из колбы № 3 при помощи мерной пипетки отобрать 50 мл раствора, перенести в колбу № 4, перемешать. 3.5. Из колбы №4 мерной пипеткой отобрать 50 мл раствора и выбросить. 4. В каждую колбу с приготовленными растворами высыпать по навеске 3 г активированного угля. 5. Колбы поставить на перемешивающее устройство на 15 минут. 6. Осторожно слить растворы через бумажный фильтр в конические колбы под теми же номерами, стараясь, чтобы основная масса угля осталась в круглой колбе. 7. Определить концентрацию кислоты в исходном С0 и равновесных С* растворах по следующей методике. 7.1. В 2 конические колбы мерной пипеткой объемом 5 мл отобрать по 5 мл пробы. 7.2. В каждую колбу добавить немного дистиллированной воды (до толщины слоя жидкости около 5 мм). 7.3. В каждую колбу прилить по 3-4 капель индикатора – фенолфталеина. 7.4. Отобрать раствор щелочи в химический стакан объемом 50 мл. 7.5. Из стакана раствор щелочи налить в бюретку. 7.6. Выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан со щелочью и нажать на шарик. 7.7. Довести объем щелочи в бюретке до отметки «0». 7.8. Титровать одну из колб с пробой кислоты раствором гидроксидом натрия до перехода окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. 7.9. Полученное значение объема щелочи занести в таблицу 6 протокола лабораторной работы. 7.10. Довести объем щелочи в бюретке до отметки «0» и провести титрование пробы во второй конической колбе. 7.11. Полученное значение объема щелочи занести в таблицу 6 протокола лабораторной работы. Содержание протокола лабораторной работыМасса навески угля ms = __________ г Концентрация раствора щелочи С(NaOH) = ________ экв/л. Слабый электролит (название и химическая формула) _______________. Ориентировочная концентрация слабого электролита (указана на емкости с кислотой) _________. Объем аликвоты Va = ________ мл. Результаты анализа проб кислоты
Обработка результатов эксперимента1. Рассчитать значение концентрации раствора кислоты, взятого на приготовление растворов и проведение адсорбции по формуле: где V0 – средний объем гидроксида натрия, затраченный на титрование пробы исходной кислоты, мл Полученное значение занести в строку 1 графы «С0» таблицы данных для построения изотерм адсорбции. 2. Вычислить концентрации растворов, полученных согласно п. 3 раздела «Выполнение работы» и занести их в строки 2-4 графы «С0» таблицы данных для построения изотерм адсорбции. 3. По результатам титрования проб после адсорбции вычислить значения равновесных концентраций кислоты по формуле где Vi – средний объем гидроксида натрия, затраченный на титрование пробы кислоты после адсорбции, мл. Полученные значения занести в графу «С*» таблицы данных для построения изотерм адсорбции. 4. Вычислить изменение концентрации кислоты в процессе адсорбции по формуле: 5. Вычслить значения удельной адсорбции растворенного вещества Г по формуле где V – объем кислоты, взятый на адсорбцию, л; ms – навеска адсорбента (активированного угля), кг. 6. Заполнить таблицу данных для построения изотерм адсорбции
7. Построить изотерму удельной адсорбции кислоты в координатах Г = f(C) 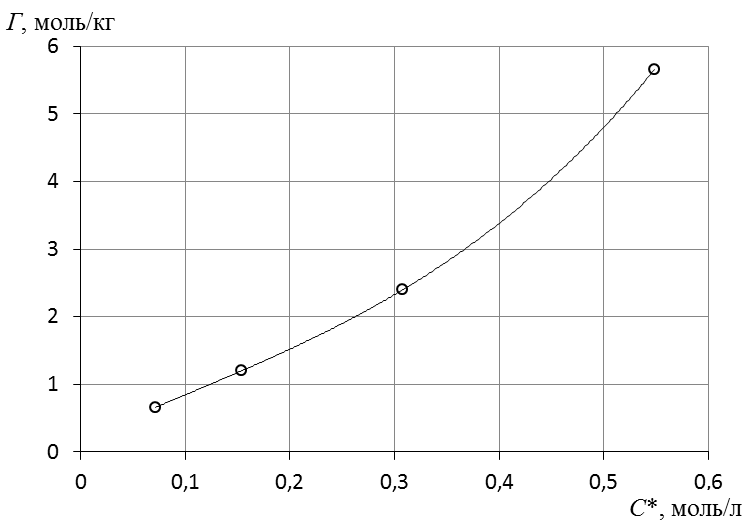 Изотерма удельной адсорбции.8. Построить изотерму адсорбции Фрейндлиха в координатах lgГ = f(lgC) и вычислить коэффициенты уравнения Фрейндлиха по уравнению линии тренда 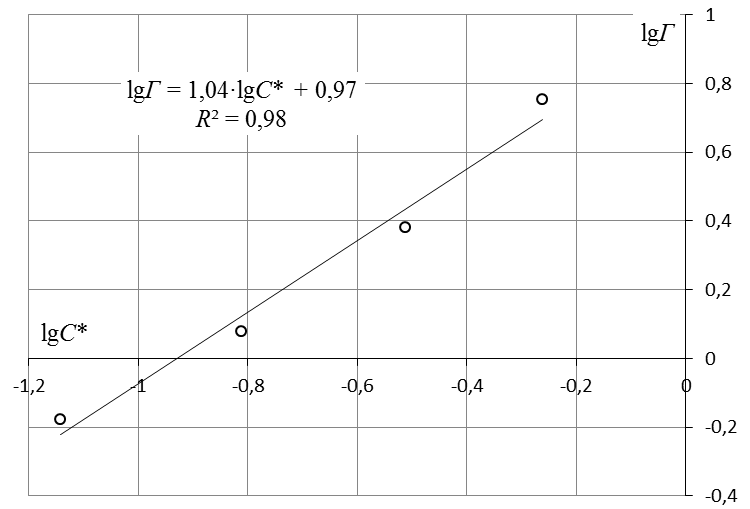 Линейная форма уравнения адсорбции Фрейндлиха. lgK = 0,97; 1/n = 1,04.9. Построить график линейной формы изотермы адсорбции Ленгмюра в координатах 1/Г = f(1/C) 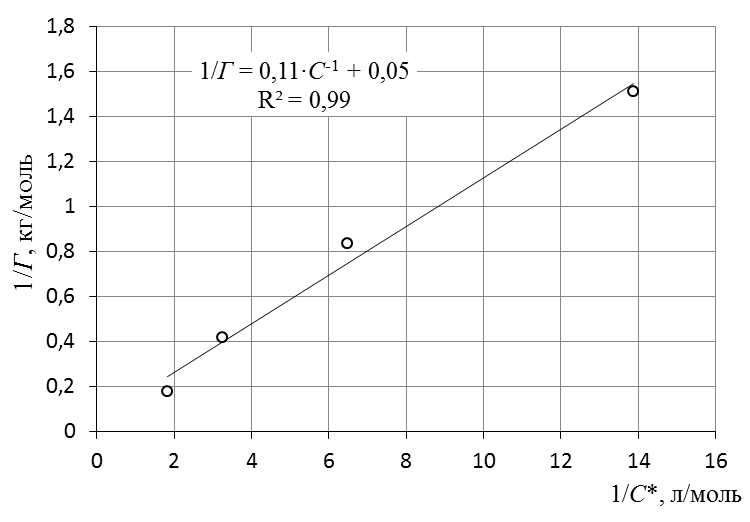 Линейная форма уравнения адсорбции Ленгмюра в координатах 1/Г = f(1/C). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
