Молекулярная биология лабораторная робота. Молекулярное биология. Лабораторная работа 1 (4 часа) кристаллическое отделение альбумина от яичного белка. Реакции осаждения белков
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
|
ЛАБОРАТОРНАЯ РАБОТА №1 (4 часа) КРИСТАЛЛИЧЕСКОЕ ОТДЕЛЕНИЕ АЛЬБУМИНА ОТ ЯИЧНОГО БЕЛКА. Реакции осаждения белков Теоретическая часть: Большинство белков относятся к высокомолекулярным соединениям, которые хорошо растворяются в воде. Растворение белков в воде связано с гидратацией его молекул и образованием вокруг частиц белка гидратной оболочки. Любые физические и химические факторы, нарушающие гидратацию молекул белка и нейтрализующие их заряд, приводят к понижению растворимости белка и способствуют выпадению его в осадок. Многие факторы влияют на физико-химические свойства белковых веществ, вызывают изменения структуры макромолекул. Данный процесс известен как денатурация. При денатурации нарушается активная конформация белковой макромолекулы. Эти изменения касаются в первую очередь вторичной и третичной структуры без нарушения при этом ковалентных (пептидных) связей. Реакции осаждения белков бывают обратимыми и необратимыми. При обратимом осаждении макромолекулы белка в основном не подвергаются глубокой денатурации, а осадки могут быть снова растворены в первоначальном растворителе (например, воде). Обратимое осаждение вызывается действием нейтральных солей аммония, щелочных и щелочноземельных металлов (высаливание), спирта, ацетона, эфира и некоторых других органических растворителей. При необратимом осаждении происходит глубокая денатурация белка, он теряет свойства гидрофильности и становится гидрофобным. Денатурированный белок неспособен к восстановлению своих первоначальных физико-химических и биологических свойств. Необратимое осаждение вызывается высокой температурой, действием концентрированных минеральных и некоторых органических кислот, ионов тяжелых металлов, красителей. 1-Урок: Разделение альбуминов и глобулинов яичного белка Высаливанием называется процесс выделения белков из водных растворов нейтральными растворами концентрированных солей щелочных и щелочноземельных металлов. При добавлении больших концентраций солей к раствору белка происходит дегидратация белковых частиц и снятие заряда; при этом белки выпадают в осадок. Степень выпадения белков в осадок зависит от ионной силы раствора осадителя, размера частиц белковой молекулы, величины ее заряда, гидрофильности. Разные белки осаждаются при различных концентрациях солей. Поэтому в осадках, полученных путем постепенного повышения концентрации солей, отдельные белки находятся в различных фракциях. Высаливание белков является обратимым процессом, и после удаления соли белок вновь приобретает природные свойства. Поэтому высаливанием пользуются в клинической практике при разделении белков сыворотки крови, а также при изолировании, очистке различных белков. Исследуемый материал: яичный белок. Реактивы: насыщенный (NH4)2SO4, измельченный порошок (NH4)2SO4, 10-процентный раствор NaOH, 1-процентный раствор CuSO4. Оборудование: пробирки, пипетки. Ход работы. В пробирку наливают 20 капель неразведенного яичного белка, добавляют равный объем насыщенного раствора сульфата аммония, содержимое перемешивают. Получается полунасыщенный раствор сульфата аммония, выпадает осадок яичного глобулина. Через 5 мин осадок отфильтровывают. В фильтрате остается другой белок – яичный альбумин. Для высаливания альбумина к фильтрату добавляют измельченный порошок сульфата аммония до полного насыщения, то есть до тех пор, пока не прекратится растворение соли. Выпавший осадок альбумина отфильтровывают и с фильтратом проделывают биуретовую реакцию. Отрицательная реакция указывает на отсутствие белка. Оформление работы. Результаты работы заносят в табл. 1. Таблица 1
2-Урок: Разделение альбуминов и глобулинов яичного белка Теоретическая часть: Высаливанием называют процесс осаждения белка из раствора под действием нейтральных солей: NaCl, (NH4)2SO4, Na2SO4, MgCl2 и другие. При высаливании белок выпадает в осадок, не подвергаясь денатурации. При добавлении к растворам белка солей щелочных и щелочно-земельных металлов их ионы адсорбируются на противоположно заряженных группах частиц белка, делая их электронейтральными и тем самым, понижая устойчивость белков в растворе. Кроме того, соли щелочных и щелочно-земельных металлов растворяясь, связывают большие количества воды, что при достаточно высоких концентрациях ведет к дегидратации частиц белка и лишает их гидратной оболочки. Белок при этом выпадает в осадок. Для осаждения из раствора различных белков используют растворы соли разной концентрации. Глобулины, например, осаждаются полунасыщенным раствором сернокислого аммония, а альбумины – только насыщенным раствором. Это происходит из–за того, что частицы глобулинов значительно крупнее частиц альбуминов, это используется для разделения альбуминов и глобулинов. Осаждающиеся при высаливании белки способны вновь растворяться в воде, т.к. макромолекулы белков при высаливании, как правило, сохраняют свои нативные свойства. Цель: разделение альбуминов и глобулинов яичного белка методом высаливания. Исследуемый материал: яичный белок. Реактивы: сульфат аммония кристаллический, сульфат аммония насыщенный раствор, 10 % раствор гидроксида натрия, 0,5 % раствор сульфата меди. Оборудование: штатив с пробирками, воронки, фильтры бумажные, стеклянные палочки, пипетки, Методика выполнения работы: В пробирку прилить 2–3 мл раствора яичного белка и равный объем насыщенного раствора сульфата аммония. Содержимое пробирки тщательно перемешать и оставить на 10 минут. Выпадает хлопьевидный осадок глобулина. Осадку дают отстояться, после чего отфильтровать. К фильтрату добавить кристаллический сульфат аммония на кончике шпателя до насыщения; выпадает хлопьевидный осадок альбуминов. Осадок отцентрифугировать в течение 5 минут при 3000 оборотах в минуту. С фильтратом провести биуретовую реакцию. Отрицательная реакция указывает на отсутствие белков в фильтрате и полноту осаждения. Осадок альбуминов из центрифужной пробирки перенести в пробирку и растворить в 2–3 мл воды. Раствор альбуминов отфильтровать и провести с ним биуретовую реакцию. В пробирку с фильтратом налить 1 мл раствора едкого натра и 1–2 капли раствора сернокислой меди. При взбалтывании в случае присутствия белков появляется фиолетовое окрашивание. Оформление результатов опыта Полученные результаты записывают в таблицу 2. Таблица 2
ЛАБОРАТОРНАЯ РАБОТА №2 (4 часа) ОТДЕЛЕНИЕ БЕЛКОВЫХ ФРАКЦИЙ ОТ МЫШЕЧНОЙ ТКАНИ 3-Урок: Отделение белковых фракций от мышечной ткани Миофибриллы мышечной клетки содержат сократительные белки (миозин и актин) и регуляторные белки (тропомиозин и тропонин). Белки миофибрилл не растворяются в воде, но их можно экстрагировать из мышечной ткани солевыми растворами с концентрацией соли 0,5 моль/л. Многие белки саркоплазмы (гиалоплазмы мышечных клеток) растворимы в воде или в солевых растворах низкой концентрации (0,05 моль/л). При экстракции мышечной ткани 5% раствором хлорида калия извлекаются как миофибриллярные, так и саркоплазматические белки. Оборудование: Ступка фарфоровая с пестиком; воронка; стакан стеклянный с носиком на 1 л; фильтры бумажные; колба; центрифуга К23. Реактивы: навеска мышечной ткани; 5%-ный раствор хлорида калия (КСI); 10%-ный раствор NaOH; 1%-ный раствор CuSO45Н2О. Ход работы: 1. Взвесить 2 г мышечной ткани. Поместить в фарфоровую ступку, добавить 2 мл 5%-ного раствора КСI и растереть песком до гомогенного состояния. 2. К гомогенату добавить 3 мл раствора КСI и растирать 5 мин, затем прибавить еще 5 мл 5%-ного раствора КСI. Растирать 5 мин. 3. Полученный гомогенат профильтровать через два слоя марли или центрифугировать в течение 15 мин при 4000 об/мин. 4. С фильтратом проделать биуретовую реакцию: вставить воронку с фильтратом в пробирку и добавить 1 мл 10%-ного раствора NaOH и 1 каплю 1%-ного раствора сульфата меди. Оценка результата: Кратко запишите результаты проделанных реакций. Вывод 4-Урок: Выделение белков мышечной ткани I. Выделение водорастворимых белков мышечной ткани. 1. В ступке растереть 10 г. мышечной ткани. 2. В плоскодонную колбу объемом 100 мл поместить 2 г гомогенизированной мышечной ткани, залить 12 мл дистиллированной воды и экстрагировать в термостате при температуре 300°С в течение 15 мин (при постоянном перемешивании). При этом в раствор переходят альбуминовые фракции белков мышечной ткани (миоген, миоальбумин, миоглобин, глобулин X). 3. Водорастворимой фракции белков мышечной ткани дать отстояться 2...3 мин, осадок отфильтровать через два слоя марли, положенной на воронку. Получить фильтрат. Промытый водой осадок мышечной ткани оставить для выделения глобулинов. 4. Полученный фильтрат использовать для количественного определения альбуминовых белков. II. Выделение солерастворимых белков мышечной ткани. 1. Оставшуюся на марле кашицу из мышечной ткани (после извлечения водорастворимых белков) отжать, перенести в фарфоровую ступку и растереть с 10 мл 10% раствора сульфата аммония для извлечения глобулиновой фракции белков. Полученному экстракту дать отстояться и отфильтровать. Получить фильтрат. Оставшийся осадок, содержащий белки стромы, используют для выделения белков мышечной ткани, растворимых в щелочах. 2. Полученный фильтрат, содержащий глобулиновую фракцию белков мяса, разделить на две части. Одну часть фильтрата использовать для количественного определения белков. 3. Для осаждения миозина ко второй части фильтрата (около 5мл), содержащего глобулины мышечной ткани, добавить сухой порошок хлорида натрия при небольшом нагревании до полного насыщения, образовавшийся осадок, который представляет собой фибриллярный белок — миозин, спустя 5 мин отделить на центрифуге. Надосадочную жидкость декантировать, оставшийся на дне миозин растворить в дистиллированной воде, получить раствор. 4. Использовать раствор для количественного определения миозина. III. Выделение белков мышечной ткани, растворимых в щелочах. 1. Оставшийся после экстракции водо- и солерастворимых белков осадок перенести в плоскодонную колбу, залить 5 мл раствора 10% гидроксида натрия и поместить на 20 мин в кипящую водяную баню. Полученный раствор охладить и отфильтровать. 2. К 3 мл фильтрата добавить по каплям раствор 0,1 н уксусной кислоты для нейтрализации щелочи. Выпавший осадок, который представляет собой белки стромы, спустя 5 мин. отфильтровать. К фильтрату добавить 1 мл биуретового реактива, объяснить полученный результат. Количественное определение белков 1. Взять 1 мл исследуемого белоксодержащего раствора, добавить 4 мл биуретового реактива и оставить на 30 мин при комнатной температуре. 2. Измерить светопоглощение окрашенного раствора при λ = 540 нм на фотоэлектрокалориметре относительно контрольного раствора. Содержание белка в пробе определить по калибровочному графику. 3. Массовую долю белка (Б, %) рассчитать по формуле: 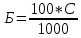 где С – концентрация белка, найденная по калибровочному графику, мг/мл; 100 – коэффициент пересчета в проценты; 1000 – коэффициент перевода миллиграммов в граммы. Оформление результатов работы 1. Записать в тетрадь ход работы 2. Оформить результаты работы в виде таблицы (табл. 4). Таблица 4 Результаты анализа фракционного состава исследуемого белка
ЛАБОРАТОРНАЯ РАБОТА №3 (4 часа) КИСЛОТНЫЙ ГИДРОЛИЗ БЕЛКОВ 5-Урок: Кислотный гидролиз белков Гидролиз – распад сложного вещества на более простые составные части, связанный с присоединением воды в месте разрыва связей. В зависимости от применяющегося катализатора, различают кислотный, щелочной и ферментативный гидролиз. При гидролизе простого белка конечными продуктами являются аминокислоты. В организме гидролиз белка постоянно протекает в процессе как пищеварения, так и в ходе жизнедеятельности клеток под действием протеолитических ферментов. При кислотном гидролизе белка разрушаются некоторые аминокислоты (триптофан подвергается полному разрушению, серин, треонин, цистин, тирозин, фенилаланин – частичному). При щелочном гидролизе отмечается значительно более сильное разрушение аминокислот. При кислотном гидролизе белки распадаются сначала на высокомолекулярные пептиды, а затем – на низкомолекулярные пептиды, дипептиды и аминокислоты. Сложные белки состоят из аминокислот и небелкового компонента (простетической группы). К сложным белкам относятся нуклеопротеиды, хромопротеиды, фосфопротеиды, гликопротеиды, сложные белки-ферменты, металлопротеиды. Кислотный гидролиз простого белка Исследуемый материал: раствор яичного белка. Реактивы: концентрированная НСl, 10-процентный раствор NaOH, 1-процентный раствор CuSO4. Оборудование: круглодонная колба с воздушным холодильником, пробирки, капельницы. Ход работы. Кислотный гидролиз простого белка. Для гидролиза в круглодонную колбу отмеривают 20 мл раствора яичного белка и 5 мл концентрированной соляной кислоты. Колбочку закрывают пробкой с длинной стеклянной трубкой и закрепляют на штативе с асбестовой сеткой. Содержимое колбы кипятят под тягой в течение 45 минут. Открытие промежуточных продуктов распада белка в гидролизате при помощи биуретовой реакции. В процессе гидролиза проделывают биуретовую реакцию с несколькими каплями предварительно нейтрализованного гидролизата. Промежуточные продукты распада белка – пептоны – при проведении биуретовой реакции дают розовое или красное окрашивание, а белки – сине-фиолетовое. Хромопротеиды Хромопротеиды являются сложными белками, простетическая группа которых представлена каким-либо окрашенным соединением небелкового характера (пигментом). Окрашенная простетическая группа различных хромопротеидов может принадлежать к разным классам органических соединений (порфиринам, каротиноидам, производным витаминов и др.). Важнейшую группу хромопротеидов составляют белки, содержащие окрашенное соединение порфириновой природы; к ним относятся гемоглобин крови, миоглобин мышц, некоторые ферменты (каталаза, пероксидаза, цитохромы и др.). Гемоглобин состоит из белка глобина и пигментной части – гема. По химической природе гем представляет собой соединение протопорфирина с двухвалентным железом, которое в особых условиях может переходить в трехвалентное. Геминовая проба Тейхмана. При нагревании высушенной крови с ледяной уксусной кислотой кровяной пигмент распадается на глобин и гематин. Гематин под действием хлористого водорода, возникающего при взаимодействии хлористого натрия (имеющегося в крови или добавленного) и уксусной кислоты, переходит в хлорпроизводное – гемин, который выкристаллизовывается при остывании. Пробой Тейхмана пользуются в судебно-медицинской экспертизе для доказательства наличия кровяных пятен. Гемин отличается от гема наличием трехвалентного железа, соединенного с атомом хлора. Исследуемый материал: кровь. Реактивы: ледяная СН3СООН, насыщенный раствор NaCl. Оборудование: стекла предметные и покровные, стеклянная палочка, микроскоп. Ход работы. Каплю свежей крови помещают на предметное стекло и дают ей высохнуть, держа стекло высоко над пламенем горелки во избежание нагревания выше 60 °С (не кипятить, контролировать нагрев прикосновением стекла к тыльной поверхности кисти руки). К подсушенной крови добавляют 1–2 капли концентрированной уксусной кислоты, смесь тщательно перемешивают стеклянной палочкой, накрывают покровным стеклом и осторожно нагревают до начала кипения кислоты. При этом предметное стекло следует держать высоко над пламенем горелки, чтобы избежать выкипания жидкости. Затем препарат охлаждают и рассматривают под микроскопом образовавшиеся при разрушении гемоглобина кристаллы солянокислого гемина, имеющие форму ромбоидальных палочек. Если обнаружить кристаллы не удается, то приподнимают покровное стекло, добавляют 2–3 капли концентрированной уксусной кислоты, нагревают смесь и после охлаждения вновь исследуют под микроскопом. При исследовании старых пятен геминовую пробу производят с соскобом пятна или же кусочек ткани с пятном режут на мелкие части. Перед обработкой ледяной уксусной кислотой добавляют один маленький кристаллик хлористого натрия. 6-Урок: Кислотный гидролиз белков Фосфопротеиды Фосфопротеиды представляют собой сложные белки, состоящие из простого белка и небелковой части – фосфорной кислоты. Фосфорная кислота связана с белком через гидроксильную группу оксиаминокислот – серина и треонина. К этой группе белков относятся казеиноген молока, вителлин яичного желтка, ихтулин икры и некоторые другие. Фосфопротеиды служат одним из питательных материалов для развития эмбрионов. Исследуемый материал: молоко. Реактивы: СН3СООН, 1-процентный раствор CuSO4, 10-процентный раствор NaOH, 10-процентный раствор НNO3, фенолфталеин, молибденовый реактив. Оборудование: воронки, фильтры, пробирки, стеклянная палочка, пипетки, спиртовка. Ход работы. 1. Гидролиз казеина. В пробирку помещают выделенный из молока казеин и приливают 2 мл 10-процентного раствора едкого натра. Кипятят 10–15 мин на асбестовой сетке с обратным холодильником, затем охлаждают пробирку и проводят реакцию на продукты гидролиза. 2. Обнаружение белка. Белок обнаруживают биуретовой реакцией. В пробирку к трем каплям гидролизата добавляют одну каплю 1-процентного раствора сернокислой меди. Появляется розово-фиолетовое окрашивание. 3. Обнаружение фосфата. Оставшийся гидролизат подкисляют несколькими каплями 10-процентного раствора азотной кислоты в присутствии 1–2 капель фенолфталеина (до обесцвечивания) и отфильтровывают в сухую пробирку. К 5 каплям фильтрата приливают 20 капель молибденового реактива и кипятят несколько минут. Жидкость окрашивается в желтый цвет, а затем при охлаждении выпадает желтый осадок фосфорно-молибденового аммония, указывающий на присутствие фосфата в гидролизате: H3PO4 + 12 (NH4)2MoO4 + 21 HNO3 → → (NH4)3(PO4 ⋅ 12MoO3) + 21 NH4NO3 + + 12 H2О Фосфорно-молибденовый аммоний Гликопротеиды. Открытие углеводного компонента в яичном белке Гликопротеиды – сложные белки, в простетические группы которых входят углеводы и их производные. Гликопротеиды содержатся почти во всех тканях и жидкостях организма, носят общее название муцинов и мукоидов и выполняют опорную и защитную функции. Исследуемый материал: яичный белок. Реактивы: концентрированная H2SO4, 1-процентный раствор тимола, концентрированная CH3COOH. Оборудование: пробирки, капельницы. Ход работы. При взаимодействии концентрированной серной кислоты с гексозами или пентозами происходит дегидратация их: из пентоз образуется фурфурол, а из гексоз – оксиметилфурфурол. Они дают с тимолом или α-нафтолом в присутствии концентрированной серной кислоты продукты конденсации красного цвета. К 10 каплям профильтрованного гидролизата добавляют 2–3 капли 1-процентного раствора тимола, перемешивают и по стенке пробирки осторожно наслаивают 20 капель концентрированной серной кислоты. При встряхивании на дне пробирки образуется красное окрашивание вследствие образования продукта конденсации фурфурола с тимолом. Оформление работы. Результаты работ по сложным белкам оформить в табл. 6. Таблица 6
ЛАБОРАТОРНАЯ РАБОТА №4 (4 часа) ОЧИСТКА БЕЛКОВ МЕТОДОМ ГЕЛЬ-ФИЛЬТРАЦИИ 7-Урок: Гель-фильтрация (ГФ) или эксклюзионная хроматография Гель-фильтрация (ГФ) или эксклюзионная хроматография (ситовая, гельпроникающая, гель-фильтрационная хроматография) представляет собой метод разделения молекул в соответствии с их размером. В отличие от ионообменной и аффинной хроматографии молекулы образца не связываются с сорбентом, таким образом, состав буфера не влияет на разрешающую способность (расстояние между пиками) метода. Следовательно, важным преимуществом ГФ является то, что условия среды могут быть изменены в соответствии с типом образца или требованиями для дальнейших шагов очистки и хранения. ГФ хорошо подходит для биомолекул, которые чувствительны к изменениям рН, концентрации ионов металлов, кофакторов и других условий среды. Разделение может быть выполнено в присутствии необходимых ионов, кофакторов, детергентов, мочевины, гуанидин гидрохлорида, при высокой или низкой ионной силе, при 37°C или на холоду, в соответствии с требованиями эксперимента. Переход молекул вещества из подвижной фазы в неподвижную и обратно за счет диффузии ничем не затруднен. Иная ситуация складывается внутри гранул сорбента. Здесь диффузия более или менее затруднена из-за столкновений молекул диффундирующего вещества с нитями пространственной сетки полимера или стенками пор. Если размеры молекул соизмеримы со средним диаметром каналов в гранулах, то эти затруднения становятся весьма существенными и диффузия тормозится. Может сложиться и такое положение, когда часть внутреннего объема гранул, т.е. часть объема неподвижной фазы (а иногда и весь этот объем), оказывается недоступной для молекул вещества, растворенного в подвижной фазе. Различие степени доступности объема неподвижной фазы для молекул различных компонентов исходной смеси веществ является фактором, определяющим возможность их фракционирования. Очевидно, что оно будет происходить по размерам молекул (Рис7.1). Крупные молекулы, вовсе непроникающие внутрь гранул, будут выходить из колонки первыми. В то же время мелкие молекулы, свободно диффундирующие внутрь гранул, часть времени будут находиться в неподвижной фазе. Таким образом, все мелкие молекулы выйдут из колонки более или менее одновременно и заведомо позднее, чем крупные. Очевидно, что размеры молекул связаны с их массами, но отнюдь не целиком ими определяются. Это особенно важно учитывать в случае макромолекул, размеры которых могут существенно 22 зависеть от плотности упаковки полипептидной или полинуклеотидной цепи. В ограничении свободы диффузии через пространственную сетку пор внутри гранул немалую роль может играть и форма молекулы. Очевидно, что сферическая глобула будет диффундировать иначе, чем молекула такого же объема, но вытянутая в виде палочки. 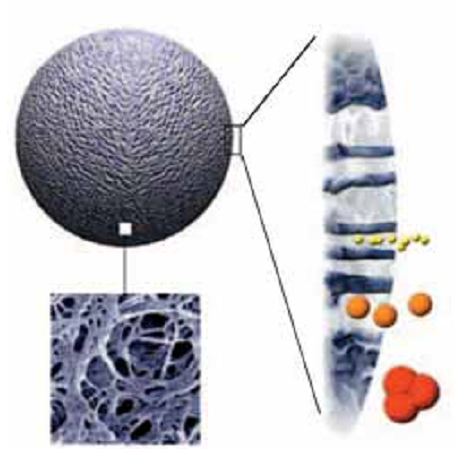 Рис. 7.1 Схематическое изображение шарика сорбента и его электронное приближение (http://www.gelifesciences.com) Гель-фильтрация используется для сравнительного определения молекулярных масс, на завершающем этапе очистки, для обессоливания или быстрой смены буфера. Типичная ГФ хроматограмма представлена на рисунке 7.2.  Типичная ГФ хроматограмма Выбор сорбента Пористые материалы для гель-фильтрации чаще всего выпускаются в виде сферических гранул целого набора диаметров с различными средними размерами пор. Для разделения смесей биополимеров, прежде всего белков, используют гидрофильные полимерные сорбенты (сефадексы, супердексы - декстраны с поперечными сшивками, а также полиакриламидные гели - сефакрилы) или модифицированные полисахаридами макропористые силикагели. Они названы универсальными коммерческими именами. В таблице 7 изображена схема, на которой можно наблюдать соответствие различных типов сорбентов для ГФ молекулярным массам исследуемых молекул белков. С помощью существующих сорбентов можно разделять вещества с молекулярной массой от 100 до 80 000 000 Да. В таком диапазоне можно разделять как пептиды, так и большие белковые комплексы. Селективность сорбента зависит исключительно от количества и размера пор и описывается кривой селективности. Диапазон фракционирования - это диапазон молекулярных масс, которые способны частично проходить в поры сорбента, т.е. молекулы в пределах этого диапазона могут быть разделены с высоким разрешением. В таблице 7 приведены некоторые типичные носители, используемые в гель-фильтрации. Данный список не является исчерпывающим, и есть множество других материалов сорбентов. Выбор материала и марки сорбента зависит от конкретных требований условий гель-фильтрации. Sephacryl®, Sephadex®, Sepharose® и Superdex® являются зарегистрированными торговыми марками компании "GE healthcare". Сорбенты Toyopearl® компании "Tosoh Bioscience" также могут быть применены в ГФ. Сорбенты, изготовленные из полиметакрилата применимы для различных диапазонов фракционирования молекул. 7 Таблица Некоторые распространенные сорбенты для ГФ  Подготовка образцов Правильная подготовка образцов обеспечивает хорошее разрешение и продлевает срок службы колонки. Состав буфера не влияет на эффективность разделения. Образцы должны быть свободны от твердых частиц, особенно при работе с бусинами диаметром 34 мкм или меньше. Подготовка колонки В ГФ правильная набивка колонки имеет решающее значение. Разрешающая способность между двумя фазами увеличивается пропорционально квадратному корню длины колонки. Придерживайтесь следующих правил, если вы решили набить колонку самостоятельно: Размер колонки = min 50см высота слоя для Sephacryl, min 30 см высота слоя для Superdex, Superose Количество геля = в зависимости от объема образца. Смотрите также отдельные инструкции к каждому конкретному сорбенту для получения подробной информации. Приготовление буфера Выбор буфера не влияет на эффективность разделения. Выберите буфер, в который образец должен быть собран и в котором образец сохраняет активность и стабильность. Концентрация буфера должна быть достаточной для поддержания рН. Ионную силу рекомендуется не повышать выше 150мМ NaCl, чтобы избежать неспецифического ионного взаимодействия с матрицей. Очистка и хранение колонок Рекомендуемые условия для хранения описываются в инструкции к колонке. Обычно это 20% этанол при 40С 8-Урок: Определение молекулярной массы белка гель-фильтрацией через сефадекс Принцип метода: элюционный объём белка (VЭ) является практически линейной функцией логарифма его молекулярной массы. Пропуская через колонку с сефадексом G-75 или G 100 исследуемый раствор белка и определив VЭ, можно по калибровочной кривой найти значение молекулярной массы данного белка. Оборудование: Система для хроматографии, включающая самописец, спектрофотометр; штативы с пробирками; колонка для хроматографии 45х1 см. Реактивы: Маркёры: бычий сывороточный альбумин (БСА) – м.м. 6800 Да, lgМ = 4,833; яичный альбумин (ЯА) – м.м. 43000 Да, lgМ = 4,633; цитохром с (ЦС) – м.м. 12400 Да, lgМ = 4,093; лизоцим (Л) – м.м. 13930 Да, lgМ = 4,144; белок Х с неизвестной молекулярной массой; сефадекс G-100; 0,01М трис - буфер, рН 7,5. Ход работы: 1.Определить VЭ для БСА, ЯА и ЦС. Для этого: 1.1. На колонку нанести 0,5 мл БСА, сразу начинать сбор вышедшей жидкости в одну пробирку, собирать до тех пор (наблюдая по самописцу) пока величина пика не достигнет максимума – это VЭ БСА; Замерить VЭ. 1.2. После выхода 1-го белкового пика, нанести на колонку ЯА – замерить VЭ (не забывать передвигать ленту самописца в начальную точку). 1.3. После выхода второго пика нанести ЦС. Замерить VЭ. 2. Пропустить через колонку 0,5 мл раствора белка с неизвестной молекулярной массой. Замерить VЭ. 74  3. Построить логарифмический график, отложив по оси ординат значение логарифмов мол. массы - БСА, ЯА, цитохрома С. По оси абсцисс отложить полученные элюционные объёмы, или пройденные белками пути в (см). 3. Построить логарифмический график, отложив по оси ординат значение логарифмов мол. массы - БСА, ЯА, цитохрома С. По оси абсцисс отложить полученные элюционные объёмы, или пройденные белками пути в (см). Рис. 8. График зависимости логарифма молекулярной массы белков от их элюционного объема. Оценка результатов: 1. Построить график, отложив VЭ Х - раствора; 2. Определить lg М и по lgM определить молекулярную массу Х-белка. Вывод: ЛАБОРАТОРНАЯ РАБОТА №5 (4 часа) ОЧИСТКА БЕЛКОВ ИОНООБМЕННЫМ МЕТОДОМ 9-Урок: Ионообменная хроматография Ионообменная хроматография (ИОХ) представляет собой метод, позволяющий разделять ионы и полярные молекулы на основе их заряда. Она может быть использована для разделения практически любых заряженных молекул, в том числе крупных белков, небольших нуклеотидов и аминокислот. Взаимодействие образца и сорбента основано на обратимом кулоновском взаимодействии. Сорбент имеет на поверхности ионные функциональные группы, которые взаимодействуют с ионами аналита противоположного заряда. Вид хроматографии, при которой отрицательно заряженные группы сорбента связывают положительно заряженный аналит, называется катионообменой. Если для связывания отрицательно заряженного аналита используют положительно заряженный сорбент, то говорят об аниообменной хроматографии. При выборе вида ионообменной хроматографии руководствуются изоэлектрической точкой белка pI (если она известна), при значении рН выше pI белок приобретает отрицательный заряд, если ниже то положительный. Белки имеют многочисленные функциональные группы, которые могут иметь как положительные, так и отрицательные заряды. Во время ионообменной хроматографии белки разделяются в соответствии с их суммарным зарядом. Разделение осуществляется изменением pH или концентрации ионов подвижной фазы. Изменения вносят поэтапно или 10 непрерывным градиентом. Чаще всего образцы элюируют градиентом соли (NaCl). Например, если белок имеет отрицательный заряд при рН=7, то он будет связываться с положительно заряженным сорбентом, в то время как положительно заряженные белки будут смыты потоком элюента (элюированы). При понижении рН, белок будет приобретать растущий положительный заряд и, в конце концов, также будет элюирован, что даст пик УФ поглощения на хроматограмме (Рис 9.1). 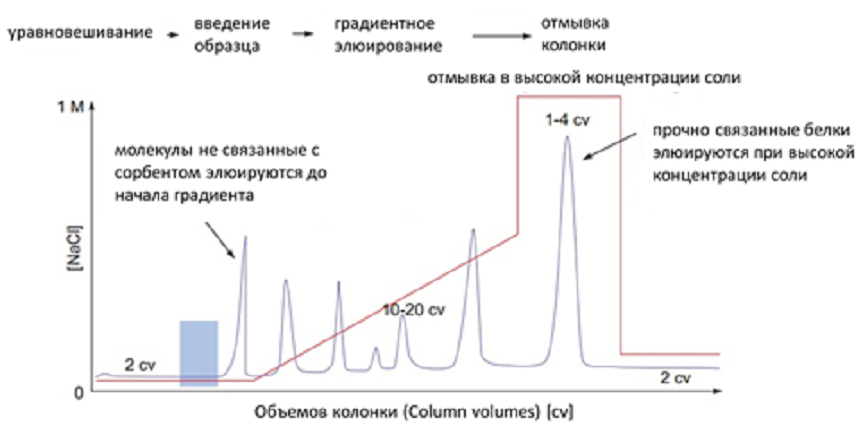 Рис. 9.1. Типичная хроматограмма ионообменного разделения. Выбор ионообменника В большинстве случаев рекомендуется начинать очистку с использования сильного ионообменника, позволяющего работать в широком диапазоне рН. Сильные ионообменники: Q (анионообменник), S и SP (катионообменники) полностью заряжены в широком диапазоне рН (2-12). Слабые ионообменники: DEAE (анионообменник) и CM (катионообменник) полностью заряжены в узком диапазоне рН (2-9 и 6-10, соответственно), но дают дополнительную избирательность при очистке. Функциональные группы Функциональные группы, используемые в ионообменных матрицах, представлены в таблице 9. Сила или слабость ионообменника относится к степени, в которой меняется ионизация функциональных групп в зависимости от рН. Но не относится к силе, с которой функциональные группы связываются с белками. Сильные ионообменники не присоединяют и не теряют протоны при изменении рН и поэтому не имеют буферную емкость, оставаясь полностью заряженными в широком диапазоне рН (Рис.9.2). Таблица 9 Функциональные группы, используемые в ионообменных сорбентах 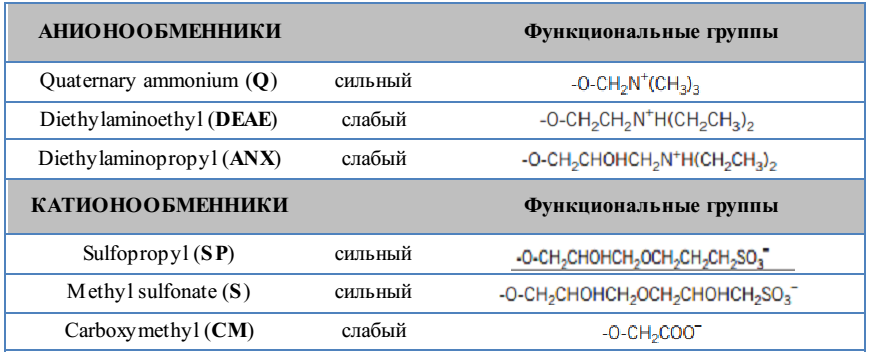 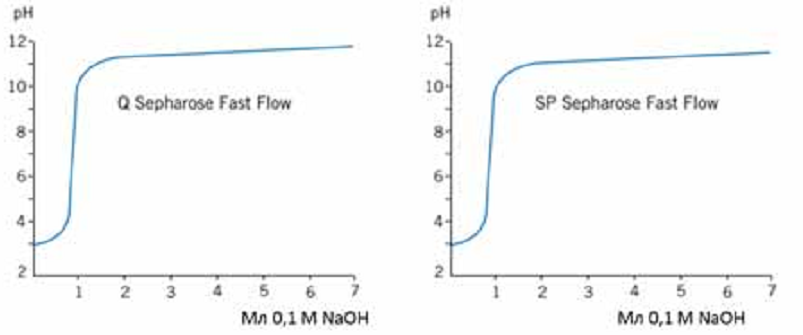 Рис.9.2 Кривые титрования сильных ионообменников Q Sepharose и SP Sepharose. От работы с сильными ионитами есть несколько преимуществ: Механизм взаимодействия прост, поскольку нет промежуточных форм взаимодействия зарядов Способность к связыванию поддерживается и при высоком и при низком рН Легкая разработка и оптимизация протокола очистки Большинство белков имеют изоэлектрические точки в пределах от 5,5 до 7,5 и могут быть разделены на любом из слабых или сильных ионообменников. Преимущество слабых ионобменников в том, что они дают различную селективность по сравнению с сильными. Их недостаток в том, что они меняют ионообменную емкость, присоединяя и отдавая протоны, в зависимости от рН (Рис.9.3). 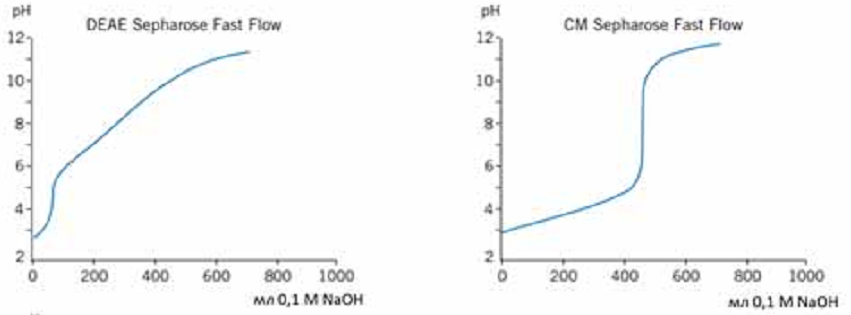 Рис.9.3 Кривые титрования слабых ионообменников DEAE Sepharose и СМ Sepharose Выбор сорбента Такие параметры, как масштаб очистки, скорость разделения, разрешение, связывающая способность сорбента и стабильность образцов следует учитывать при выборе сорбента. Подготовка образцов Правильная подготовка образцов обеспечивает хорошее разрешение и продлевает срок службы колонки. Для эффективного связывания образцы должны находиться в том же рН и ионной силе, что и исходный буфер. Образцы должны быть свободны от твердых частиц, особенно при работе с бусинами диаметром 34 мкм или меньше. Общее количество белка, загружаемое на колонку не должно превышать общую связывающую способность колонки. Для оптимального разделения при градиентном элюировании используйте примерно одну пятую общей связывающей способности колонки. Подготовка колонки Для оптимизации методики, а так же для увеличения скорости и эффективности очистки, используйте небольшие готовые колонки. Придерживайтесь следующих правил, если вы решили набить колонку самостоятельно: Размер колонки = Обычно слой геля составляет 5-15 см. Количество геля=Рассчитайте количество геля, необходимое для связывания образца и используйте в пять раз больше, чтобы набить колонку. Смотрите также отдельные инструкции к каждому конкретному сорбенту для получения подробной информации. Приготовление буфера Используйте очищенные воду и реактивы, не содержащие посторонних примесей и включений. Профильтруйте буфер через 0,45 или 0,22 мкм фильтр и убедитесь, что в нем не осталось пузырьков, которые в результате смогут существенно повлиять на разрешение. Ионы буфера должны иметь тот же заряд, что и выбранный сорбент, со значением pKa ±0,6 рН единиц от рабочего рН. Выбирайте рН на 0,5-1 единицу выше pI точки, если она известна. Концентрация буфера должна быть достаточной для поддержания буферной емкости и постоянного рН во время загрузки образца, и когда используется градиент соли. При работе с образцами, для которых pI неизвестно, попробуйте эти условия: Анионообменник Градиент 0-100%: 10-20 объемов буфера В Начальный буфер А: 20мМ Tris-HCI, pH 8,0 Элюирующий буфер В: 20мМ Tris-HCI + 1M NaCI, pH 8,0 Катионообменник Градиент 0-100%: 10-20 объемов буфера В Начальный буфер А: 20мМ Na2HPO4 х 2H2O, pH 6,8 Элюирующий буфер В: 20мМ Na2HPO4 х 2H2O + 1M NaCI, pH 6,8 Очистка и хранение колонок Рекомендуемые условия для хранения описываются в инструкции к колонке. Обычно это 20% этанол при 40С. 10-Урок: Ионообменная хроматография |
