удельная электропроводность лаба. поддельная электропроводность. Лабораторная работа 1 Измерение удельной электропроводности раствора слабого электролита и расчёт константы его диссоциации
 Скачать 62.97 Kb. Скачать 62.97 Kb.
|
|
Голяков Сергей, Рыбалко Екатерина Группа 01-041, направление «Медицинская биохимия» Лабораторная работа №1 «Измерение удельной электропроводности раствора слабого электролита и расчёт константы его диссоциации» Цель: измерить удельную электропроводность слабого электролита (муравьиной кислоты), рассчитать константу его диссоциации Оборудование: мерный цилиндр, стаканчик, кондуктометр, кондуктометрический датчик, дистиллированная вода, раствор муравьиной кислоты 0,1 н Ход работы: С помощью кондуктометра измеряем удельную электропроводность дистиллированной воды. Æн20 =0,0000057 См В мерный цилиндр наливаем 50 мл раствора муравьиной кислоты, раствор переливаем в стаканчик, затем с помощью кондуктометрического датчика измеряем удельную электропроводность В мерный цилиндр из стаканчика переливаем 25 мл раствора муравьиной кислоты, остатки выливаем в канализацию. В мерный цилиндр доливаем дистиллированную воду до отметки в 50 мл, переливаем разбавленный раствор в стаканчик и измеряем удельную электропроводность Пункт 3 повторяем 4 раза. Таким образом, концентрация муравьиной кислоты в растворе с каждым разбавлением уменьшается в половину, получаются следующие концентрации растворов: 0,1 н (исход.), 0,05н, 0,025н, 0,0125н и 0,00625н Удельная электропроводность воды не составляет более 2% от электропроводности разбавленных растворов. Рассчитаем эквивалентную электропроводность Λ по формуле 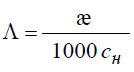 Найдём эквивалентную электропроводность при бесконечном разбавлении Λо с помощью формулы Для нахождения предельных электропроводностей катионов и анионов электролита воспользуемся табличными значениями и формулой 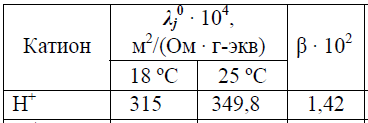 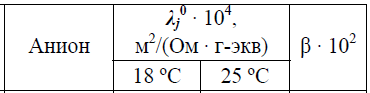 t=20°С Λо = 0,0374 По формуле С помощью закона разведения Освальда найдем константу диссоциации электролита и найдем среднее значение 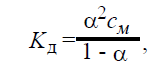 Полученные данные занесём в таблицу
Среднее значение Кд = 3,28*10^(-4) П 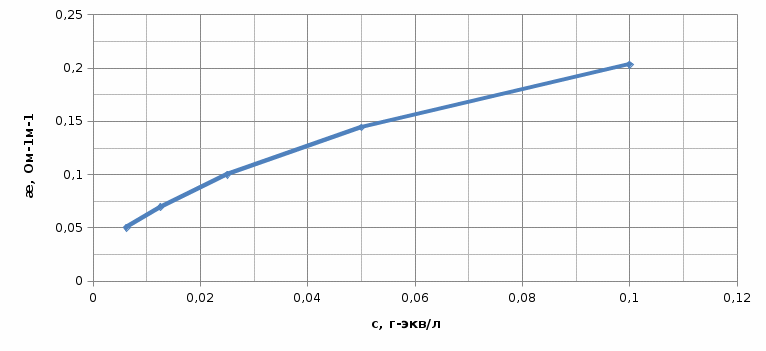 остроим графики ӕ - сн и Λ - сн остроим графики ӕ - сн и Λ - сн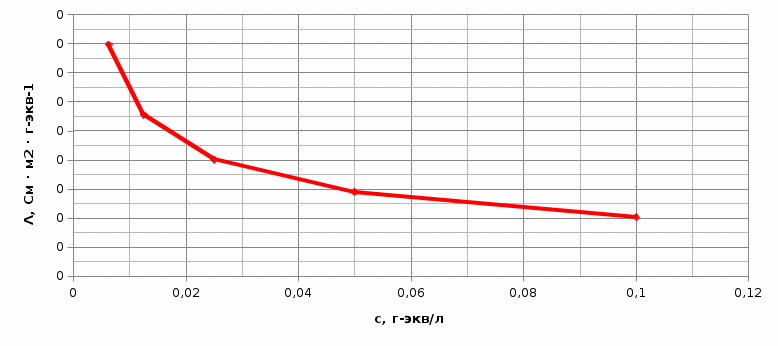 Чтобы найти Кд графическим методом, построим график Λсм – 1/Λ Воспользуемся формулой 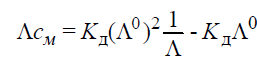
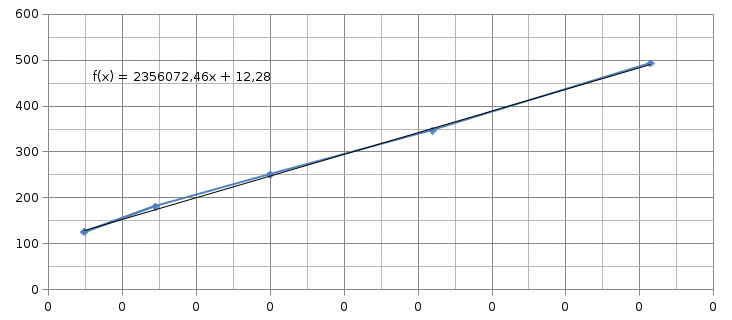 По графику найдём тангенс угла наклона, который равен Кд(Λо)2 Кд(Λо)2= 5,28*10^(-6), следовательно, Кд=5,28*10^(-6)/(0,0374)2=3,77*10^(-3) Вывод: мы измерили удельную электропроводность муравьиной кислоты при разных концентрациях, нашли константу диссоциации графическим и аналитическим методами Аналитический метод: Кд = 3,28*10^(-4) Графический метод: Кд = 3,77*10^(-3) Константы диссоциации различны из –за погрешности при измерении удельной электропроводности, округлении при математических расчетах и т.д. |
