химия. ФХМА Лабораторная работа.Коноплеева А.о. Лабораторная работа 1 потенциометрический метод анализа Цель Определить эдс напряжение гальванического элемента
 Скачать 34.96 Kb. Скачать 34.96 Kb.
|
|
Лабораторная работа № 1 «ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА» Цель: Определить ЭДС напряжение гальванического элемента. Приборы и оборудование: 1.Бюст для взвешивание веществ на аналитических весах 2.Мерная колба на 50 мл 3.Бюретка 4.Ключ для замыкания электрической цепи 5.Пипетка Мора 6.Химические стаканы. 7.Колбы на 250 мл- 2 шт Вещества: 1.Медь II сернокислая 5-водная «ЧДА» (CuSO4*5H2O) 2.Цинк сернокислый 7-водный «ЧДА» (Zn4SO4*7H2O) Методика работы: Рассчитали молярную массу каждого вещества Рассчитали нужную массу вещества для приготовления нужных растворов. Взвесили на аналитических весах наши вещества медь и цинк. Приготовили растворы 1 М, 0,1 М, 0,01 М с медью и цинком. Для приготовления 1 М раствора нам понадобилось : 7,1 г сухого вещества: цинк и 6,2 г сухого вещества: медь. С помощью бюретки и пипетки Мора смешали раствор и воду. Для приготовления 0,1 М раствора нам понадобилось : 5мл раствора и 50 мл воды. С помощью бюретки и пипетки Мора мы смешали раствор и воду. Для приготовления 0,01 М раствора нам понадобилось : 0,5мл раствора и 50 мл воды. Сделали дважды необходимый раствор. Для приготовления 0,001 М раствора нам понадобилось : 0,05мл раствора и 50 мл воды. Полученные растворы мы помещали в химические стаканы и замыкали электрическую цепь. Наблюдали за результатами напряжения на вольтметре. Результаты измерений: Молярная масса ZnSO4= 287,54 CuSO4= 249,68 Формула для нахождения массы навески: 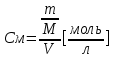 m(ZnSO4)= 1*287,54*0,25= 7,1 г m(CuSO4)= 1*249,68*0,25=6,2 г Цена деления=0,03
График: 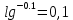 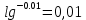  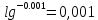 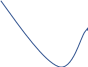  0,73 0,71   0,65       0,62 -0,001 -0,01 -0,1 -1 Вывод: Входе данной лабораторной работы определяли ЭДС гальванического элемента. |
