отчёт исследование эффекта джоуля -томсона при адиабатическом истечении газа. отчёт печать 12 печать 2. Лабораторная работа 12 Исследование эффекта ДжоуляТомсона при адиабатическом истечении газа
 Скачать 394 Kb. Скачать 394 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСТИТЕТ» Кафедра общей и технической физики Отчёт Лабораторная работа №12 Исследование эффекта Джоуля-Томсона при адиабатическом истечении газа
Санкт-Петербург 2022 г. Цель работы: 1) определение изменения температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; 2) вычисление по результатам опытов коэффициентов Ван-дер-Ваальса "a" и "b". Краткое теоретическое содержание: Явление, изучаемое в работе: Эффект Джоуля-Томсона при адиабатическом истечении углекислого газа. Основные определения физических величин, явлений, процессов: Адиабатическое расширение – расширение газа без теплообмена с окружающей средой. Идеальный газ – модель газа, в которой пренебрегаются размеры молекул по сравнению с расстоянием между ними, т.е. молекулы рассматриваются как материальные точки, также пренебрегаются силы взаимодействия между молекулами (за исключением моментов столкновения). Обычные газы при невысоких давлениях можно рассматривать, как идеальные. Теплообмен – физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Законы и соотношения, лежащие в основе лабораторной работы: Первый закон термодинамики – теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил. Q=∆U+A Где, Q – количество теплоты (Дж); U – внутренняя энергия (Дж); A – работы (Дж) Уравнение Менделеева-Клапейрона (идеального газа) – формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа, имеющая вид: Где, P – давление (Па); V – объём (м3); R – универсальная газовая постоянная, R=8,31 Дж/(моль∙К); T – температура (К) Уравнение Ван-дер-Ваальса (реального газа) – формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой реального газа при помощи коэффициентов Ван-дер-Ваальса, имеющая вид: Поправка a (в формуле Поправка b — поправка, учитывающая силы отталкивания (из общего объёма вычитается объём, занимаемый молекулами). Схема установки: 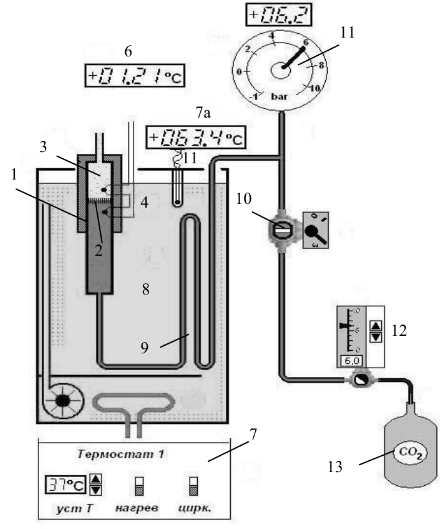 1-трубка с пористой перегородкой (2); 4-дифференциальная термопара; 6-индикатор; 7-пульт; 7а- индикатор пульта; 8-термостатический объём; 9-змеевик; 10-кран; 11-манометр; 12-редуктор; 13 блок. Исходные данные: R - универсальная газовая постоянная, R=8,31; Табличные значения: Основные расчётные формулы: Коэффициент Джоуля-Томсона: Температура инверсии: Температура критическая: Формулы косвенных погрешностей: Абсолютная погрешность измерений коэффициента Джоуля-Томсона: Абсолютная погрешность измерений температуры инверсии: Где a - постоянaная Ван-дер-Ваальса, [a] = b - постоянная Ван-дер-Ваальса, [b] = Абсолютная погрешность измерения температуры критической: где - Относительная погрешность измерения коэффициента Джоуля-Томсона: Относительная погрешность измерения постоянных ван-дер-Ваальса: Погрешность прямых измерений: ∆(∆T) = 0,01 ∆(∆P) = 0,01MПа ∆Tжидк = 1 Результаты измерений:
Примеры вычислений и расчет погрешности: Погрешности косвенных измерений: 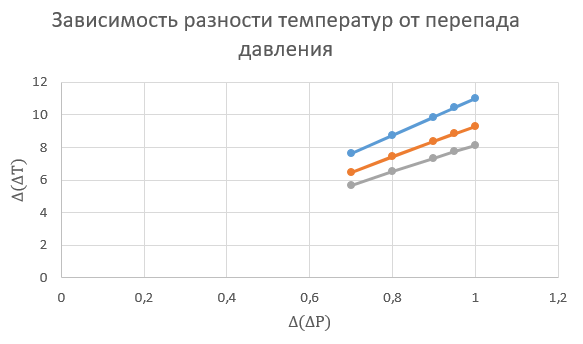 Окончательный результат: Вывод: В ходе проведенной лабораторной работы было определено изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; по результатам опытов определены коэффициенты Ван-дер-Ваальса. Полученные в результате эксперимента коэффициенты Ван-дер-Ваальса отличаются от табличных коэффициентов: 1). Коэффициент Табличное значение Экспериментальное значение 2). Коэффициент Табличное значение Экспериментальное значение |

 Ед.изм.
Ед.изм.