Лабораторные работы 1 и 2 по физике. Лабораторная работа № 2. Лабораторная работа 2 по дисциплине Физика Проверка закона БойляМариотта (тема) фио студента
 Скачать 460.23 Kb. Скачать 460.23 Kb.
|
Лабораторная работа № 2 по дисциплине «Физика» Проверка закона Бойля-Мариотта (тема)
Москва 2020 Цель работы – проверка выполнения закона Бойля-Мариотта для воздуха при комнатной температуре. Задание: измерить давление воздуха в сосуде при комнатной температуре и рассчитать объем воздуха для 15 различных положений поршня, получить значения для трех различных количеств воздуха в сосуде, представить полученные значения в виде P-V диаграммы, проверить справедливость закона Бойля-Мариотта для воздуха при комнатной температуре. Теоретическое обоснование Состояние некоторой массы m идеального газа определяется тремя термодинамическими параметрами: давлением P, объемом V и температурой T. Между этими параметрами существует определенная связь, называемая уравнением состояния PV/T = const. Многие газы при комнатной температуре и нормальном давлении можно считать идеальными. Чем выше температура и ниже давление реального газа, тем его свойства ближе к идеальному газу. Согласно модели идеального газа: 1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом, в котором находится газ, т.е. молекулы можно считать материальными точками; 2) между молекулами газа отсутствуют силы взаимодействия, т.е. потенциальная энергия взаимодействия молекул меньше кинетической энергии их теплового движения; 3) столкновения молекул газа между собой и со стенками сосуда, являются абсолютно упругими. Уравнение состояния некоторой массы m идеального газа, называется уравнением Клайперона – Менделеева: PV = VRT = 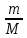 RT RTгде М – молярная масса, V – количество вещества. Моль — это количество вещества, в котором содержится число частиц, равное числу атомов в 12 г. изотопа углерода 12С. Опытным путем установлено, что в одном моле различных веществ содержится 6,02 1023 частиц. Это число – постоянная Авагадро NА = 6,02 1023 моль-1. При нормальных условиях (Po = 1,01 105Па, То = 273 К) один моль любого газа занимает объем Vм = 22,4 л. Универсальная газовая постоянная R может быть рассчитана R= 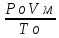 = 8,31 = 8,31 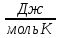 . .Закон Бойля - Мариотта установленный опытным путем, описывает поведение идеального газа при постоянной температуре для данной массы газа. Согласно этому закону, произведение давления газа на его объем есть величина постоянная PV = const, при T = const, m = const. Кривая, изображающая зависимость между давлением P и объемом V при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графике P-V чем выше, тем выше температура, при которой происходит процесс (Т1Т2 Т3). Описание аппаратуры и методики измерения: 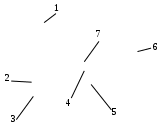
С помощью манометра измеряют давление Р воздуха в цилиндрическом сосуде, значение Р в кПа. Объем воздуха V в цилиндрическом сосуде изменяется за счет движения поршня с помощью ручки. Этот объем равен Sx, х – расстояние объема, измеряемого по шкале. Количество воздуха V сосуда, в котором воздух попадает через открытый перед началом опыта клапан 2 (во время опыта он закрыт). Давление в сосуде не должно превышать 350 кПа (3,5 бар). Клапан 3 служит для сброса воздуха, если давление превышает ному. 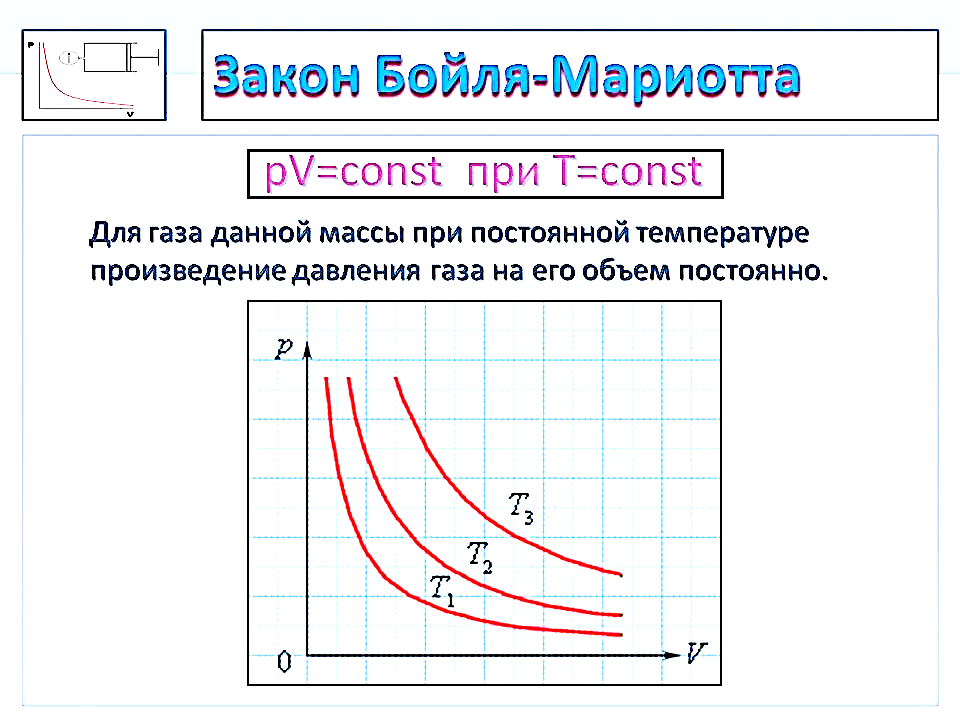 Ход работы Таблица 1
Таблица 2
Таблица 3
Расчеты для таблиц 1, 2, 3. V = Vo + 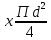 , где Vo = 20 см3, d = 50 мм = 5 см. см3 = 10-6 м3, кПа = 103Па , где Vo = 20 см3, d = 50 мм = 5 см. см3 = 10-6 м3, кПа = 103ПаV = 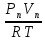 , где R = 8, 31 , где R = 8, 31 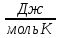 ; Т = 298 К ; Т = 298 КV1 = 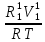 = = 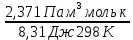 = 0,00096 моль = 0,00096 мольV2 = 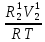 = = 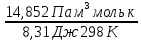 = 0,005997 моль = 0,005997 мольV3 = 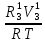 = = 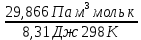 = 0,01206 моль = 0,01206 мольЕ = 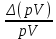 = = 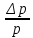 + + 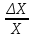 + 2 + 2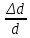 + + 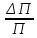 где p = 5103 Па, p = 510-4м, d = 510-4м. Е1 = 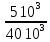 + + 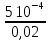 + 2 + 2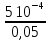 + + 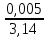 = 0,1716 = 0,1716Е2 = 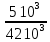 + + 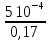 + 2 + 2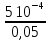 + + 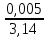 = 0,1436 = 0,1436Е3 = 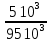 + + 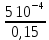 + 2 + 2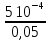 + + 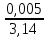 = 0,0776 = 0,0776Таблица 1: (pV) = E(pV) – абсолютная погрешность (pV)1 = E1 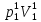 = 0,1716 2,371 = 0,407 = 0,1716 2,371 = 0,407Таблица 2: (pV)2 = E2 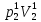 = 0,1436 14,852 = 2,133 = 0,1436 14,852 = 2,133Таблица 3: (pV)3= E3 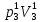 = 0,0776 29,866 = 2,317 = 0,0776 29,866 = 2,317Вывод: Таким образом, в данном эксперименте я убедился, что для различных положений поршня в пределах погрешности pV=const. |


