Лаба по химии №2. Лабораторная работа 2 скорость химических реакций и химическое равновесие цель работы
 Скачать 172.57 Kb. Скачать 172.57 Kb.
|
|
Лабораторная работа №2 СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель работы. Изучить влияние различных факторов на скоростьхимических реакций и химическое равновесие. Теоретическое введение Химическая термодинамика позволяет предсказать принципиальную возможность или невозможность самопроизвольного течения химических реакций, а также рассчитать равновесные концентрации реагирующих веществ. Однако, знание рассмотренных закономерностей еще недостаточно, чтобы предсказать реальную возможность химической реакции, определить скорость реакции, и ее механизм, а также управлять процессом. Быстрота реакции зачастую не связана со значением ее энергии Гиббса. Например, термодинамическая вероятность реакции окисления водорода до воды: Н2 + 1/2О2 ⇄Н2О(ж) ∆G0298 = 237,2 кДж/моль значительно выше, чем вероятность реакции нейтрализации с образованием воды: Н+ + ОН то же время первая реакция в обычных условиях без катализатора практически не идет, а вторая реакция протекает мгновенно. Скорость и механизм химических реакций изучает химическая кинетика. Химическая кинетика -раздел химии,изучающий скорость химическихпроцессов и влияние на неё различных факторов. Характер взаимодействия зависит от агрегатного состояния продуктов реагентов. Продукты и реагенты, вместе взятые, образуют так называемую физико-химическую систему. Совокупность однородных частей системы, обладающих одинаковым химическим составом и свойствами отделенных от остальных частей поверхностью раздела, называют фазой. Системы, состоящие из одной фазы, называются гомогенными, а системы, содержащие несколько фаз, - гетерогенными. Соответственно этому в химии введено понятие о гомогенных и гетерогенных реакциях. Основным понятием в химической кинетике является понятие о скорости реакции: скорость химической реакции определяется изменением количества вещества (реагирующего или образующегося в единицу времени), отнесенного к единице объема (гомогенная реакция) или к единице поверхности раздела фаз (гетерогенная реакция): Uср= (C2-C1)/( 2- 1)= где Uср - средняя скорость реакции за данный промежуток времени . Так как концентрация исходных веществ со временем убывает, то (С2-С1) / ( 2- 1) 0. Но скорость величина всегда положительная, поэтому знак минус имеет конкретный физический смысл. Если скорость реакции вычисляется по изменению концентрации получающихся веществ, то правая часть уравнения имеет знак плюс. Истинная скорость реакции в данный момент времени определяется как первая производная от концентрации по времени:
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации С, температуры t, присутствия катализаторов, а также от некоторых других причин (например, от радиоактивного облучения, от давления в случае газовых реакций, от степени измельчения в случае твердых веществ). Влияние концентрации реагентов на скорость химического взаимодействия выражается основным законом химической кинетики (закон действующих масс). Скорость химических реакций, протекающих в однородной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени равных порядкам реакции по веществам. Математически это положение можно выразить следующим образом: аА+ bB = dD; Кинетическое уравнение имеет вид V k где С(A), С(В) - молярные концентрации веществ А и В, моль/л; k – константа скорости реакции, зависящая от природы реагирующих веществ и температуры; nА и nB – коэффициенты, называемые порядками реакции по веществам А и В. Сумма порядков реакции по реагентам называется порядком реакции n : n = nА + nB . Порядок концентрации определяется экспериментально, он зависит от ее сложности. Для элементарных реакций, протекающих в одну стадию, порядок реакции по реагенту совпадает со стехиометрическим коэффициентам в уравнении реакции перед веществом. Тогда, кинетическое уравнение реакции принимает вид: k где а, b - стехиометрические коэффициенты. Если [A] Основной закон химической кинетики не учитывает реагирующие вещества в твердом состоянии, так как их концентрация постоянна, они реагируют лишь с поверхности. Например: С(к) + О2(г) = СО2(г) k Зависимость скорости реакции от температуры приближенно описывается правилом Вант Гоффа. Повышение температуры на каждые 10 о увеличивает скорость реакции в 2-4 раза, т.е. 2 t1 Vt2 Vt1 г Более точно зависимость скорости реакции от температуры описывается уравнением Аррениуса: A где К - константа скорости реакции; А - предэкспоненциальный множитель, учитывающий число столкновений молекул в единицу времени; е - основание натуральных логарифмов; R - универсальная газовая постоянная, равная 8,31 Дж/(моль К); Т - абсолютная температура (К); Е - энергия активации, т.е. энергия, которую необходимо сообщить молю вещества для перевода молекул в активное состояние, кДж/моль. Катализаторы - это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными как по составу, так и по массе. Чаще всего роль катализатора заключается в увеличении скорости реакции, хотя некоторые катализаторы не ускоряют, а замедляют процесс. Явление ускорения химических реакций в присутствии катализаторов носит название катализа, а замедление - ингибирования. Существует два вида катализа: гомогенный и гетерогенный. При гомогенном катализе реагенты, продукты и катализатор составляют одну фазу (газовую или жидкую), а поверхность раздела между катализатором и реагентом отсутствует. При гетерогенном катализе катализаторы (обычно твердые вещества) находятся в ином фазовом состоянии, чем реагенты и продукты реакции, и реакция развивается на поверхности раздела фаз. Особым случаем катализа является автокатализ, процесс которого ускоряется одним из продуктов реакции. Химическое равновесие. Реакции, которые протекают в одном направлении и идут до конца, называют необратимыми. Большинство реакций являются обратимыми, т.е. протекают в противоположных направлениях и не идут до конца. Химическое равновесие - это состояние системы, когда скорость прямой и обратной реакции равны между собой. Химическое равновесие характеризуется константой равновесия, которая для реакции аА + bB ⇄ сC + dD имеет следующий вид: [C]c [D]d Кр = [A]a [B]b , где [A], [B], [C], [D] - равновесные концентрации, моль/л. Константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации. Она показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации исходных веществ и продуктов реакции равны единице. В этом физический смысл Кр . Смещение равновесия в зависимости от изменения концентрации реагирующих веществ, температуры, давления (в случае газовых реакций) в общем виде определяется правилом Ле-Шателье: если на систему, находящуюся в равновесии, производится какое-либо воздействие (изменяется С, t, р), то равновесие сместится в сторону того процесса, который ослабляет произведенное воздействие. Из принципа Ле-Шателье следует: при увеличении концентрации исходных веществ равновесие реакции смещается вправо, при уменьшении - влево; при увеличении температуры равновесие экзотермической реакции смещается влево, эндотермической - вправо; при увеличении давления равновесие газофазной реакции смещается в сторону меньшего числа газообразных молекул, при уменьшении давления - в сторону большего числа газообразных молекул. Если реакция протекает без изменения мольного объема газообразных веществ, то изменение давления не смещает ее равновесия. Катализатор одинаково ускоряет прямую и обратную реакции обратимого процесса, т.е. достижение состояния равновесия. Смещение равновесия в желаемом направлении имеет огромное значение в химии. МЕТОДИКА И ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ ВАРИАНТ№6 Опыт 1. Влияние концентрации на скорость реакции. Исходные концентрации Na2S2O3 и Н2SO4 Таблица №1
Соотношение концентрации и скорости реакции. Таблица №2
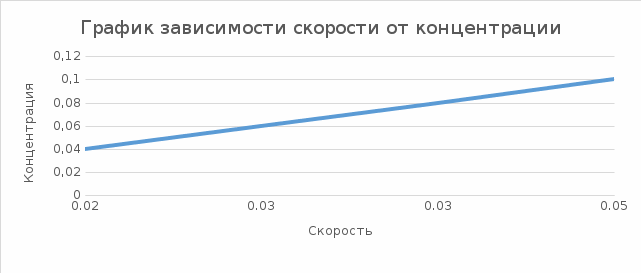 - Вывод: В процессе выполнения работы мы выяснили, что при увеличении концентрации (С/ Na2S2O3 моль/л) увеличивается скорость реакции, соответственно уменьшается время появления суспензии серы. Также это доказывает закон действующих масс, который заключается в том, что масса, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. ( число исходных веществ равно числу получившихся продуктов). Опыт 2. Влияние температуры на скорость реакции температурный коэффициент, исходя из правила Вант-Гофа.  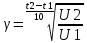 Экспериментальные данные по изучения влияния температуры на скорость реакции Таблица №3
Расчеты: Vусл= 1/τ 1/21=0,05 1/7=0,14 1/3=0,33 Температурный коэффициент: 1. 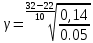 = =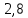 2. 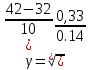 = 2,36 = 2,363. 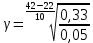 = = 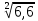 =2,57 =2,57Вывод: В данном опыте мы рассмотрели влияние температуры на скорость реакции. При повышении температуры увеличивается скорость реакции, соответственно уменьшается время до появления суспензии серы. Так же мы вычислили температурный коэффициент по формуле Вант-Гоффа и выяснили, что от первого к третьему опыту температурный коэффициент увеличивается. Опыт 3.Влияние катализатора на скорость реакции Гипотеза: Катализаторы – это вещества, влияющие на скорость химической реакции, но остающиеся после реакции в химически неизменном виде и первоначальном количестве. Следовательно MnO2 и PbO2 должны остаться в неизменном количестве, а скорость реакции должна увеличиться. Алгоритм выполения: по 2-3 мл 30%-го пероксида водорода H2O2. 1) микрошпатель порошка диоксида марганца MnО2 H2O2+MnО2 выделяется много кислорода О2, ГЕТЕРОГЕННАЯ РЕАКЦИЯ 2) диоксида свинца PbO2. H2O2+ PbO2 выделяется мало кислорода О2, ГЕТЕРОГЕННАЯ РЕАКЦИЯ Две гетерогенные реакции, так как разные состояния агрегатов (H2O2 –жидкость; MnО2 и PbO2 – порошок) и протекают на границе раздела фаз.  Вывод: Скорость химической реакции изменяется в присутствии катализатора, сам катализатор остаётся неизменным после окончания реакции. Опыт 4. Смещение химического равновесия обратимой реакции Гипотеза: при добавлении родаида аммония происходит сдвиг в химической реакции равновесия в сторону прямой реакции, твердого хлорида аммония –в сторону обратной реакции,а хлорида железа(3) не влияет на химическое равновесие Алгоритм выполнения: 1) В пробирку, на три четверти заполненную водой, добавим по 4 -5 капель растворов хлорида железа FeCl3 и роданида аммония NH4CNS 2) Окрашенный раствор разольём по 4 пробиркам 3) В первую пробирку добавим 4 -5 капель раствора FeCl3 4) Во вторую 3 - 5 капель NH4CNS 5) В третью микрошпатель кристаллического хлорида аммония NH4Cl 6) И четвёртую пробирку оставим для сравнения 7) Далее пронаблюдаем как изменится цвет растворов в пробирках 8) Укажием направление смещения химического равновесия. 9) Запишем выражение для константы равновесия (Кр) данной обратимой реакции При добавлении 5-ти капель раствора FeCl3 раствор будет иметь кроваво-красную окраску, равновесие сместиться вправо. При добавлении 5-ти капель NH4CNS раствор примет красно-коричневую окраску, равновесие сместится вправо. Если добавить NH4Cl, то раствор станет оранжевого цвета, равновесие сместится влево. FeCl3 + 3NH4CNS ⇄ Fe(CNS)3 + 3NH4Cl. Выражение для константы равновесия: 𝐾р=[Fe(CNS)3]⋅[NH4Cl]3 ∕ [FeCl3]⋅[NH4CNS]3. Вывод:Гипотеза доказана ,что при добавление родаида аммония сдвигает химическое равновесие в сторону прямой реакции, твёрдого хлорида аммония – в сторону обратной реакции, хлорида железа (3) не влияет на химическое равновесие. Общий вывод: Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации С, температуры t, присутствия катализаторов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
