Контрольная. Лабораторная работа 4 Гидролиз солей студент гр. Б210911 Абдикодиров Р. А (подпись, дата) Проверил Доцент
 Скачать 24.06 Kb. Скачать 24.06 Kb.
|
|
Министерство образования и науки РФ ФГБОУ ВО «Ижевский государственный технический университет имени М. Т. Калашникова» Кафедра «Химия и химическая технология» Лабораторная работа №4 Гидролиз солей Выполнил: студент гр. Б21-091-1 ____________ Абдикодиров Р.А (подпись, дата) Проверил: Доцент ____________ Семакина Н.В (подпись, дата) Ижевск 2022 Цель работы. Научиться определять характер среды в растворах различных солей. Изучить влияние различных факторов на гидролиз. Научиться оценивать степень гидролиза. Теоретическая часть Определение понятия гидролиза солей. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде. Классификация солей по отношению к гидролизу.
Особые случаи гидролиза. Полный и необратимый гидролиз Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или летучи, или неустойчивы и разлагаются с образованием летучих продуктов (Cr2S3, Al2S3, Cr2(C03)3, Fe2(CO3)3, A12(CO3)3, гидролиз соли протекает необратимо: Поэтому сульфид алюминия не может существовать в водных растворах, а может быть получен только «сухим способом», например из простых веществ при высокой температуре: 2Al+3S = Al2S3 Необратимому гидролизу подвергаются соли трехвалентных катионов А13+, Сг3+ и Fe3+ в присутствии карбонатов и сульфидов щелочных металлов. Количественные характеристики гидролиза: степень и константа гидролиза. Константа гидролиза Кг характеризует способность соли подвергаться гидролизу: чем больше константа гидролиза, тем силнее протекает гидролиз. Для соли, образованной слабой кислотой и сильным основанием:  Для соли, образованной сильной кислотой и слабым основанием: 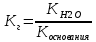 Для соли, образованной слабой кислотой и слабым основанием:  Степень гидролиза – отношение количества гидролизовавшихся молекул к общему количеству молекул. h=n/n0 Экспериментальная часть.
Гидролиз_хлорида_алюминия'>Гидролиз хлорида алюминия AlCl3+3H2O = 3HCL + AL(OH)3(осадок) (молекулярное уравнение) AL3++3H2O = 3H++AL(OH)3 (сокращенное ионное уравнение) Al3+ + HOH = AlOH2+ + H+ (первая стадия гидролиза) Гидролиз карбоната натрия Na2CO3 + H2O = NaOH + NaHCO3 (молекулярное уравнение) CO32-+H2O = HCO3- + OH- (сокращенное ионное уравнение) CO32- + HOH = HCO–3 + OH- (первая стадия гидролиза) KCL – соль, образованная сильным основанием и сильной кислотой, поэтому гидролиз не протекает. NaCH3COO + H2O = CH3COOH + NaOH (молекулярное уравнение) CH3COO– + H2O = CH3COOH– + OH– (сокращенное уравнение) Вывод о реакции среды в растворах солей Гидролиз солей, образованных сильным основанием и слабой кислотой протекает всегда по аниону, заряд которого определяет число теоретических ступеней гидролиза. Реакция среды их водных растворов - щелочная (рН > 7). Гидролиз солей, образованных сильной кислотой и слабым основанием протекает всегда по катиону, заряд которого определяет число теоретических ступеней гидролиза. Реакция среды их водных растворов кислая (рН < 7). Гидролиз солей, образованных слабым основанием и слабой кислотой протекает одновременно по катиону и по аниону, образуя сразу два слабых электролита. Реакция среды водного раствора такой соли устанавливается путем сравнения констант диссоциации образующихся слабых электролитов. Если константы диссоциации основания и кислоты близки, то реакция раствора остается практически нейтральной, если же они различаются на несколько порядков, то среда может быть слабокислой или слабощелочной - в зависимости от силы кислоты и основания. Соль, образованная сильным основанием и сильной кислотой. Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами H+ и OH-воды слабодиссоциирующих труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН = 7. Опыт 2. Случаи полного (необратимого) гидролиза. 2AlCL + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl 2Al3+ + 3CO32- + HOH = 2Al(OH)3 + 3CO2 2AlCL3 + 3(NH4)2S + 6HOH = 2Al(OH)3 + 3H2S +6 NH4Cl 2Al3+ + 3S2- + 6HOH = 2Al(OH)3 + 3H2S Опыт 3. Факторы, влияющие на степень гидролиза солей. CO32- + HOH = HCO3- + OH- SO32- + HOH = HSO32- + OH- Сравнил h: Na2SO3 < Na2СO3   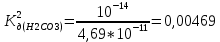    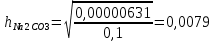 Вывод: чем слабее кислота, или основание, образовывающее соль, тем большей степени подвергаются гидролизу их соли. | ||||||||||||||||||||||||||||||||||||||||||||||||||
