Лабораторная работа 4 Изучение изотермического процесса. Цель работы
 Скачать 145.46 Kb. Скачать 145.46 Kb.
|
|
ЛАБОРАТОРНАЯ РАБОТА № 4 Изучение изотермического процесса. Цель работы: изучить параметры изотермического процесса, экспериментально проверить справедливость закона Бойля-Мариотта. 1.1. Теоретическое введение. Системы, состоящие из большого числа тел (молекул), называются мак- росистемами. К таким системам относятся, например, газы, жидкости, твердые тела. Системы, между которыми возможен обмен энергией, без учета микро- скопического строения тел, составляющих систему, называется термодинами- ческой системой. Простейшим примером термодинамической системы является идеальный газ. Идеальным называется газ, молекулы которого приняты за материальные точки и находятся в постоянном хаотическом движении. Между молекулами идеального газа отсутствуют силы притяжения, а отталкивание при соударени- ях происходит по закону упругого удара. Состояние термодинамической системы однозначно описывается конеч- ным числом параметров, которые называются термодинамическими парамет- рами. Термодинамические параметры (параметры состояния) – физические величины, характеризующие состояние термодинамической системы, например, температура T, давление P, объём V , масса газа m (количество вещества или число молей ν m , где μ – молярная масса). μ Равновесным состоянием системы называют такое состояние, при кото- ром все ее термодинамические параметры сколь угодно долго остаются неиз- менными в отсутствие внешнего воздействия, при этом давление и температура имеют одинаковые значения во всех частях объема. Всякое изменение состоя- ния системы, характеризующееся изменением ее термодинамических парамет- ров, называется термодинамическим процессом. Термодинамический процесс называется равновесным, если при его протекании система проходит непре- рывный ряд бесконечно близких равновесных состояний. Очевидно, что реаль- ный процесс изменения состояния системы всегда протекает с конечной скоро- стью и поэтому не является равновесным. Однако реальный процесс будет тем ближе к равновесному, чем медленней он протекает. Поэтому равновесные процессы называют квазистатическими. Квазистатический (квазиравновесный) процесс – бесконечно медленный переход термодинамической системы из од- ного равновесного состояния в другое, при котором термодинамическое состо- яние в любой момент времени бесконечно мало отличается от равновесного, и его можно рассматривать как состояние термодинамического равновесия. Тер- модинамический процесс, при протекании которого один из термодинамиче- ских параметров остаётся постоянным, называется изопроцессом (при посто- янной массе m const ) В термодинамике часто встречаются квазистатические изопроцессы: изо- хорный – процесс, происходящий при постоянном объеме ( m const , V=const); изобарный процесс – процесс, в котором давление остается постоянным ( m const , P=const); изотермический процесс – процесс, происходящий при постоянной температуре ( m const , T=const) и т.д. Все квазистатические про- цессы можно изобразить в виде графика. Соответствующие кривые называются изохорой (V=const), изобарой (P=const) и изотермой (T=const) и т.д. Уравнение, выражающее связь между термодинамическими параметрами макросистемы, называется уравнением состояния. Уравнение состояния в об- щем виде для термодинамической системы может быть записано: f(P,V,T) 0 . Конкретный вид функции f предполагается известным из эксперимента. Изу- чая свойства идеального газа, установили ряд законов, определяющих связь термодинамических параметров идеального газа. Уравнение Клапейрона–Менделеева – уравнение состояния идеального газа массы m: PV m RT vRT , где v m количество вещества (количество μ μ молей вещества), μ – молярная масса газа (масса 1 моля газа), R- универсаль- ная газовая постоянная. Для одного моля идеального газа, взятого при нормальных условиях: 0 0 P 1,013105 Па, T 273,15K , V0=0,0224 м3/моль, (согласно закону Авогадро объ- ём одного моля равен V0=22,4 л) по уравнению Клапейрона-Менделеева можно определить универсальную газовую постоянную P0Vмоля T0 const R ( R 8,31 Дж ). моль К  Из уравнения состояния легко получить уравнения изопроцессов, происхо- дящих в идеальном газе, например изохорного, изобарного и изотермического. Из уравнения состояния легко получить уравнения изопроцессов, происхо- дящих в идеальном газе, например изохорного, изобарного и изотермического.
| ||||||||||||||||||||||||||||||||
| P0V | αV χ | 1 |
| V0 | αP | |
αVи χ существует, подтвержденное опытом соотношение: , где P0,
V0 – давление и объём газа при 0°С, а V - конечный объём газа при изотермиче- ском процессе.
Воспользуемся уравнением Клапейрона – Менделеева и графиками изо- процессов для нахождения величин αP , αVи χ
Изотермический процесс (Т =const,
m const )
Для данной массы газа при постоянной температуре Т = const произведе-
ние давления на объем – величина постоянная
PV =const
или давление газа
изменяется обратно пропорционально объему:
P const
V
, при
m const, T const.
График изотермического процесса в координатах (P, 1 ) - прямая, прохо-
V
дящая через начало координат. Тангенс уг-
 ла наклона графика tgγ
ла наклона графика tgγ P
ΔP .
Δ
1
V
Pс
Из уравнения состояния идеального га-
P за PV mRT νRT , имеем для изотерми-
μ
0 1 1 1
1 ческого процесса
P 1 νRT
V
, или
V1 Vср V2 V
1 dP
dP d νRT
V
, тогда
νRT tgγ .
1
d
| R | tgγ |
| νT |
Универсальная газовая постоянная равна .
V
Определим коэффициент всестороннего сжатия
χ 1 V
V P
. Из уравне-
ния состояния имеем
PV const :
PdV+VdP 0
или
dV V dP P
T
. Из уравнения
Клапейрона – Менделеева:
dP
νRTdV
V2
, отсюда
dV
dP
V 2
νRT
χV
. Найдем
коэффициент всестороннего сжатия
χ
V
P
χ 1
νRT
или
χV V , тогда
P
при
Т = const, m const .
Знак минус в выражении
χ 1
 P
Pуказывает на то, что увеличение объема
приводит к уменьшению давления. Изотермический коэффициент сжимаемости идеального газа равен, таким образом, обратной величине его давления. С ро- стом давления величина уменьшается.
графика
Из уравнения состояния идеального газа
PV m RT νRT , имеем для изо-
μ
постоянная
, где
ν V Vмол
, а Vмол=22,414 л.
Найдем коэффициент теплового расширения
αр V
dV
dТ
. Так как
1
0 р
dV α V
tgβ , то, учитывая уравнение процесса коэффициент теплового
| α T tgβ V V T 0 | 1 |
| T0 |
dT P0
V
расширения будет равен α tgβ T tgβ . Так как tgβ νR
, то
при
V0 VT0 P
P=const,
m const ; (T0=273,15 K).
Описание экспериментальной установки
Экспериментальная установка для исследования экспериментальных газовых законов приведена на рисунке 1.
Рисунок 1. Схема установки для исследования газовых законов.
– стеклянный корпус;
– подвижный поршень (шприц находится внутри стеклянного корпуса);
– плитка;
– датчик давления;
– устройство Cobra;
– резиновая трубка-переходник;
,8 – отверстия в стеклянном корпусе;
– магнит;
– термодатчик.
В стеклянном корпусе (1) находится шприц с подвижным поршнем (2). Под стеклянным корпусом, не касаясь его, расположена плитка (3). Датчик давления (4), подключают к входу S1 устройства Cobra (5). Короткая резиновая трубка- переходник (6) соединяет датчик давления со шприцом. Этот датчик позволяет ав- томатически производить измерение давления во внутренней камере шприца. Стеклянную емкость через отверстие (7) заполняют водой. В воду помещают маг- нитную мешалку. Можно перемешивать воду, обеспечивая равномерный прогрев воздуха во внутренней камере шприца, поднося магнит (9) к стеклянному корпусу (1). В отверстие (8), закрытое специальной пробкой с отверстием, помещают тер- модатчик (10), также подключив его к разъему S2 устройства Cobra (5).
Осуществить изотермический процесс можно при постоянной температуре, изменяя объем воздуха в шприце, перемещая поршень (2). Давление при этом бу- дет меняться, что автоматически зафиксирует датчик давления (4). Температуру при этом будет фиксировать термодатчик (10).
Изобарический и изохорический процессы можно изучать одновременно. Температуру воздуха в шприце можно увеличить при нагревании воды, находя- щейся в стеклянном корпусе. Для этого используют плитку (3). Нагревание возду- ха в шприце приведет к его расширению, поршень будет перемещаться таким об- разом, чтобы давление оставалось равным атмосферному (р = const). Фиксируя изменение объема воздуха вручную и соответствующую температуру по показа- ниям термодатчика (10), можно получить данные о зависимости V(T) для изоба- рического процесса.
В то же время, можно получить данные о зависимости р(Т) для изохориче- ского процесса, возвращая поршень (2) в исходное положение (к начальному объ- ему, то есть поддерживая V = const) после повышения температуры на определен- ную величину Т (например, 5К). Давление автоматически будет фиксировать датчик давления (4).
Во всех случаях количество воздуха в шприце остается неизменным, то есть = const.
Порядок выполнения работы
При выполнении работы необходимо строго выполнять требования тех- ники безопасности и охраны труда, установленные на рабочем месте студента в лаборатории.
Лабораторная работа имеет компьютерное сопровождение. Прежде чем приступить к измерениям, изучите правила пользования компьютерной про- граммой.
Внимание! Лабораторная работа состоит из двух частей:
проверка закона Бойля-Мариотта при комнатной температуре,
проверка законов Гей-Люссака и Шарля при нагревании газа,
Подготовка к работе
Убедитесь, что установка собрана в соответствии с рис. 1. Не подключайте пока трубку-переходник (6) к датчику давления (4).
Убедитесь, что, стеклянная емкость заполнена дистиллированной водой и отверстие закрыто крышкой.
Резиновую трубку, закрепленную на «отростке» отверстия (7), опустите в стеклянный стакан для стекания жидкости при последующем нагревании.
Перемещая поршень (2), установите начальный объем шприца Vo = 50 мл.
Подключите трубку (6) к датчику давления (4).
Устройство Cobra подключено к USB – порту компьютера.
Включите компьютер.
Запустите программу для проведения измерений. Для этого на рабочем столе компьютера выберите ярлык программы Phywe Measure 4. В открыв- шемся окне в пункте меню Прибор>Кобра3 Идеальный газ. В появившемся диалоговом окне в закладке Каналы установите настройки измерений в соот- ветствие с рис. 2. Необходимо пройти все вкладки и нажать все нужные флажки.
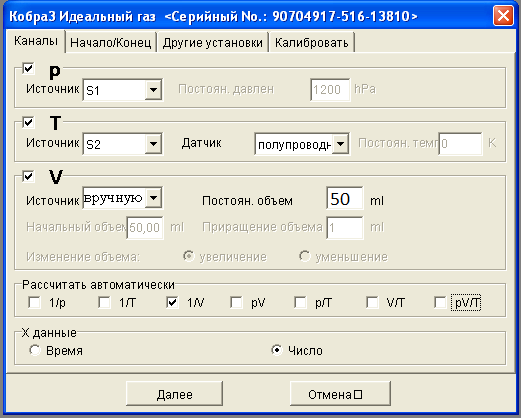
Рисунок 2 Окно настроек работы по изучению изотермического процесса.
В закладке Начало/Конец выберите «по нажатию клавиши».
В закладке Другие установки поставьте флажки в поле Цифр. дисплей 1. В появившемся диалоговом окне в разделе Канал выберите Давление р в соот- ветствии с рис. 3а, 3б. Поставьте флажок в поле Цифр. дисплей 2. В появившемся диалоговом окне в разделе Канал выберите Температура Т.
Поставьте флажок в поле Диаграмма 1, затем в появившемся диалоговом окне Параметры дисплея заполните поля в соответствии с рис. 4. В разделе Ка- нал в поле давление р задается диапазон возможных значений давления. В разде-
ле ось х в полях задается число возможных измерений. Рекомендуется в качестве максимального значения выбрать
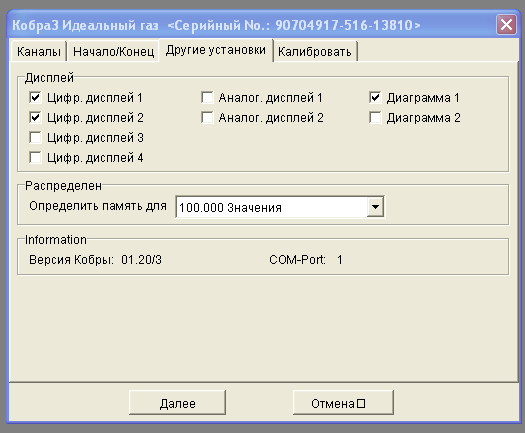 Рисунок 3а. Закладке Другие установки |  Рисунок 3б. Окно параметры дисплея |
В поле режим установите не автодиапазон.
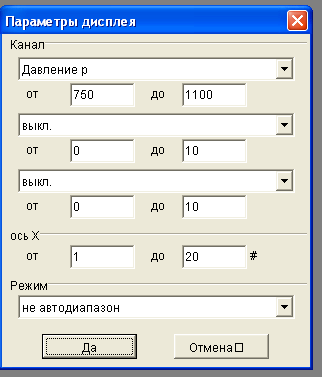 Рисунок 4 Окно Параметры дисплея. | 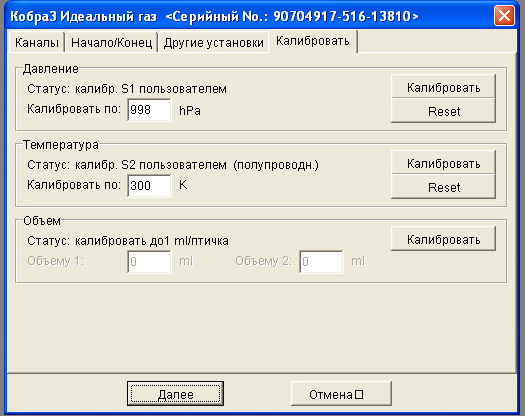 Рисунок 5 Закладка Калибровать |
Откалибруйте датчик. Для этого в закладке Калибровать введите в соот- ветствующие поля значения комнатной температуры и давления, измеренные термометром и барометром соответственно.
Нажмите Далее в закладке Калибровать. На экране появится четыре ок- на: температура Т, давление P, Измерение, окно для построения графика зависи- мости давления от числа измерений. Расположите дисплеи, появившиеся на экране, в удобном порядке.
Сохраните исходные данные измерения температуры То, давления Pо, нажав на кнопку Сохранить значения в окне Измерения (рис. 6) или Enter.
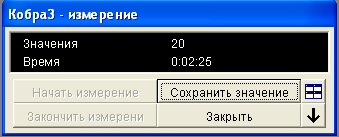
Рисунок 6 Окно Измерения.
Упражнение 1. Проверка закона Бойля – Мариотта при комнатной тем-
пературе
Рассчитайте число молей воздуха в шприце (V1 – начальный объем воздуха, равный 50 мл)
Перемещая вращательным движением поршень (2) шприца вправо, уве- личьте объем на 1 мл. Давление воздуха в шприце изменится.
Постепенно увеличивайте объем воздуха с шагом в 1 мл до объема при- близительно в 60 мл. Результаты измерений занести в таблицу №1.
Постройте график зависимости P=f(V)
Убедитесь, что график зависимости P=f(V) действительно является ги- перболой. Для этого линеаризируйте его, построив график зависимости P=f(1/V).
Рассчитайте тангенс угла наклона полученного графика. Определите универсальную газовую постоянную R и модуль всестороннего сжатия χ.
Упражнение 2. Проверка законов Гей-Люссака и Шарля при нагрева-
нии газа
Перемещая поршень (2), установите начальный объем шприца V1 = 50 мл. и установите начальное давление, для этого отсоедините датчик давления и потом подсоедините его обратно.
Запишите исходные данные измерения температуры Т1, давления P1 в от-
чет.
Рассчитайте число молей воздуха в шприце.
Включите нагреватель.
Примечание: В процессе измерений не забывайте перемешивать воду в
стеклянном корпусе, поднося к нему магнитную мешалку
Внимание: пп. 5, 6 выполняются одновременно.
После каждого увеличения температуры примерно на Т = 5 К, перемещая поршень шприца вращательным движением, доводите объем в шприце до началь- ного V1 и заносите результаты измерения давления и температуры в таблицу №2 (изохорный процесс).
После каждого увеличения объема воздуха в шприце на 1 мл фиксируйте этот объем и соответствующее ему значение температуры и записываем в таблицу
№3. Завершите измерения после достижения объема воздуха 60 мл (изобарный процесс).
Постройте график зависимости V=f(T). Рассчитайте объем воздуха Vo, соответствующий температуре 0оС.
Рассчитайте тангенс угла наклона полученного графика. Определите универсальную газовую постоянную R и коэффициент теплового расширения αV.
Постройте график зависимости P=f(Т). По графику зависимости P=f(Т).
экстраполяцией в область значений Т=273К найдите значение P0.
Рассчитайте тангенс угла наклона полученного графика. Определите универсальную газовую постоянную R и термический коэффициент давления αP.
Проведите статистическую обработку результатов измерений R, полу-
ченных разными способами и сравните коэффициенты αV и αP . Определите их
теоретическое значение:
α = α = 1
, (T0=273,15K).
T
P V
0
Список литературы
Матвеев А.Н. Молекулярная физика. – М. Высшая школа, 2011.
Кикоин А.К., Кикоин И.К. Молекулярная физика. – М.: Наука, 2006.
Сивухин Д.В.Общий курс физики. – М.: Наука, 2000, Т.2.
Иродов И.Е. Физика макросистем. – М.: Наука, 2004.
Гершензон Е.М., Малов Н.Н., Мансуров А.Н. Молекулярная физика. – М.: АСАDEMA, 2000.
Детлаф А.А., Яворский Б.М. Курс физики. – М.: Высшая школа, т. 2, 3. 2011.
Трофимова Т. И. Курс физики. – М.: Высшая школа, 2008.
Савельев И. В. Курс общей физики. – М.: Наука, 2007. Т. 1.
Контрольные вопросы
Какой газ называется идеальным? При каких условиях реальный газ можно считать идеальным?
Напишите уравнения состояния для идеального газа?
Сформулируйте закон Бойля – Мариотта? Каким уравнением он описыва- ется?
Сформулируйте закон Гей-Люссака? Каким уравнением он описывается?
Сформулируйте закон Шарля? Каким уравнением он описывается?
Каков физический смысл термического коэффициента давления? Как в данной работе он определяется?
Каков физический смысл термического коэффициента объемного расши- рения? Как в данной работе он определяется?
Каков смысл коэффициента всестороннего сжатия? Как в данной работе он определяется?
Как связаны между собой коэффициенты объемного расширения, термиче- ский коэффициент давления и коэффициент всестороннего сжатия?
Выведите законы изопроцессов из уравнения состояния идеального газа.
Изобразите графики изопроцессов в координатах P(V), V(T), P(T).
Выведите формулы для расчета универсальной газовой постоянной, ис- пользуя графики изопроцессов.


