Коллоиды + ЭДС. Лабораторная работа 4 Коллоиднодисперсные системы. Их получения и свойства Теоретическая часть Коллоидные системы и методы их получения
 Скачать 381.56 Kb. Скачать 381.56 Kb.
|
Лабораторная работа №4 «Коллоидно-дисперсные системы. Их получения и свойства»Теоретическая частьКоллоидные системы и методы их получения КОЛЛОИДНЫЕ РАСТВОРЫ относятся к дисперсным системам, т.е. к таким системам, в к которых одно вещество распределено в другом в виде частиц различных размеров. Среда, содержащая вещества в раздробленном состоянии, называется дисперсионной, а раздробленное вещество (распределенное в ней) – дисперсионной фазой. Дисперсные системы многообразны, распространены в природе и широко используются в технике. Многообразие дисперсных систем обусловлено различием химического состава отдельных компонентов систем, величиной частиц дисперсной фазы и дисперсной среды. Дисперсные системы классифицируют по величине частиц дисперсной фазы (степени дисперсности) или по природе и агрегатному состоянию дисперсной фазы и дисперсной системы. Количественно степень дисперсности характеризуется линейными размерами частиц, раздробленного вещества, т.е., чем меньше размеры частиц, тем больше степень дисперсности фазы. По величине частиц дисперсной фазы все дисперсные системы можно условно разделить на группы. ГРУБОДИСПЕРСНЫЕ СИСТЕМЫ – размер частиц превышает 0,1 мкм. Это взвеси, суспензии, если дисперсная фаза состоит из капель жидкости. Дисперсные системы, обладающие кинетической устойчивостью, т.е. частицы которых под влиянием броуновского движения находятся в хаотическом движении, относятся к коллоидным системам. КОЛЛОИДНЫЕ СИСТЕМЫ. Размеры частиц лежат в пределах от 0,1 мкм до 1 ммкм (мкм-микрон). Такие частицы уже не оседают, не задерживаются порами бумажного фильтра. Частицы коллоидных систем по своим размерам значительно больше молекул (ионов) среды, что обусловливает наличие поверхности раздела: коллоидная частица- среда. Поэтому коллоидные системы называют микрогетерогенными системами. ИСТИННЫЕ РАСТВОРЫ. (молекулярно- и ионно- дисперсные системы). Размер частиц обычно меньше 1 мкм. К ним относятся растворы солей, кислот, оснований и др. Существует понятия о двух классах коллоидов: одни из них названы лиофобными, а другие - лиофильными. К первой группе коллоидных систем были отнесены системы, в которых частицы дисперсной фазы не активны по отношению к дисперсной среде. Лиофобные коллоиды могут образовываться как из неорганических, так и из органических веществ, нерастворимых в данной среде. Частицы этих ситем представляют собой не отдельные молекулы, а агрегаты молекул, получившие название мицелл. Ввиду значительных размеров мицелл, по сравнению с молекулами дисперсной фаз, возникает поверхность раздела между отдельной частицей и окружающей средой, что и дает основание считать эти системы микрогетерогенными. Название лиофильных коллоидов было присвоено веществам, хорошо растворимым в определенных жидкостях. К таким растворам относятся высокомолекулярные соединения (ВС) с молекулярной массой больше 10 тысяч, например, желатина, целлюлоза и др. К собственно коллоидным растворам относятся микрогетерогенные системы, основные свойства которых определяются наличием коллоидных частиц, как отдельной фазы, представляющих собой агрегаты молекул. Характерной особенностью такого рода систем является не только наличие поверхности раздела, но и то, что получение их происходит не самопроизвольно, а с затратой внешней энергии. В отличие от них растворы ВС получаются самопроизвольно, т.е. так же, как и обычные растворы. То или иное вещество может быть получено в коллоидном состоянии при следующих условиях: Размеры частиц вещества доводят до коллоидных размеров двумя методами: а) раздроблением (дисперсионные методы) ; б) укрупнением молекул, атомов или ионов до частиц коллоидного размера( конденсационные методы) ; Для воспрепятствования слипанию частиц при их взаимном столкновении в растворе необходимо присутствие стабилизаторов (ионов электролитов, которые на поверхности коллоидной частицы образуют ионно-гидратную оболочку); Коллоидные частицы (дисперсная фаза) должны обладать плохой растворимостью в дисперсной среде, хотя бы в момент их получения. При соблюдении этих условий коллоидные частицы приобретаю электрический заряд и гидратную оболочку, что препятствует выпадению их в осадок. ДИСПЕРСИОННЫЕ МЕТОДЫ. Сущность механического диспергирования заключается в энергичном и продолжительном растирании, размывании и прочих механических приемах раздробления вещества. Для этих целей применяются специальные машины, работающие по принципу ударного размельчения и растирания диспергируемых веществ. Наиболее широкое распространение получили шаровые и коллоидные мельницы. Диспергирование обычно ведут, добавляя соответствующие стабилизирующие вещества, препятствующие слипанию раздробленных частиц. Довольно широкое распространение получил метод измельчения веществ с помощью ультразвука, так называемый ультразвуковой метод. Ультразвуковые установки отличаются высокой производительностью и с их помощью можно диспергировать самые разнообразные вещества. Конденсационные методы. Большинство конденсационных методов получения коллоидных растворов основано на различных химических реакциях: окисления, восстановления, обменного разложения, гидролиза и др. В результате этих реакций молекулярные или ионные растворы переходят в коллоидные путем перевода растворенных веществ в нерастворимое состояние. Рассмотрим кратко наиболее важные методы конденсации (агрегации) частиц до коллоидных размеров. Метод окисления. Он основан на реакциях окисления, в результате которых одно из веществ может быть получено в коллоидном состоянии. Так, при окислении сероводорода кислородом воздуха или двуокисью серы можно получить золь серы: 2 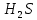 + +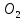 =2 =2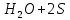 ; 2 ; 2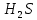 + +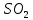 =2 =2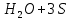 Метод восстановления. Наиболее распространенные химические методы получения коллоидных растворов различных металлов основаны на реакциях восстановления. В качестве примера рассмотрим реакцию получения золя золота путем восстановления перекисью водорода или формалином: 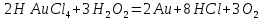 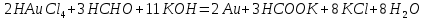 Реакцией восстановления получены в коллоидном состоянии многие металлы: Au, Ag, Pt, Pd, Rh, Os, Hg и др. Метод обменного разложения. При взаимодействии двух веществ в результате реакции обмена образуется новое труднорастворимое вещество, которое при наличии определенных условий способно находится в коллоидном состоянии. В качестве примера можно назвать реакцию получения золя сульфата бария 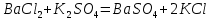 Или золя хлорида серебра 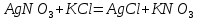 Метод гидролиза. Этим методом широко пользуются при получении золей различных металлов из их солей, если в результате реакции гидролиза образуется труднорастворимый гидроксид. Так, например, труднорастворимый гидроксид железа образуется при гидролизе хлорида железа по уравнению реакций: 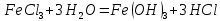 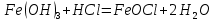 Образующаяся в результате этих реакций соль железа FeOCl диссоциирует частично на ионы FeOCl 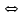 FeO⁺+Cl⁻ FeO⁺+Cl⁻Эти ионы и обеспечивают ионогеный слой вокруг частиц 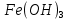 , благодаря чему они удерживаются во взвешенном состоянии. , благодаря чему они удерживаются во взвешенном состоянии.Замена растворителя. При замене растворителя вещество, ранее находившееся в растворенном состоянии, выделяется из раствора в виде высокодисперсной фазы, нерастворимой в данном растворителе. Так, если спиртовой раствор канифоли (который представляет собой истинный раствор) небольшими порциями прибавлять в воду, образуется коллоидный раствор канифоли в воде. В данном случае спирт хорошо смешивается с водой, а канифоль очень мало в ней растворяется и поэтому выделяется в виде высокодисперсной фазы. Кроме канифоли этим методом можно приготовить золи серы, фосфора, мастики и т.п. также путем вливания их спиртовых растворов в воду. Электрический метод. Этот метод используется преимущественно для приготовления коллоидных растворов благородных металлов. Сущность его заключается в получении электрической дуги между находящимися в воде электродами из золота или платины, серебра и т.д., т.е. из металла, золь которого хотят получить. В дуге под воздействием высокой температуры металл электродов испаряется, а затем пары его конденсируются в частицы коллоидных размеров, образуя соответствующих золь. Метод пептизации. Многие осадки, практически нерастворимые в воде, переходят в коллоидный раствор при действии на них некоторых веществ. Этот старый классический способ получения золей разрабатывался впервые биохимиками, которые назвали его пептизацией, а прибавляемое вещество - пептизатором (или стабилизатором). В отличие от других методов получения золей при пептизации не происходит изменения степени дисперсности частиц, а наблюдается только их разъединение. Пептизаторы способны хорошо адсорбироваться на поверхности коллоидных частиц осадка и, таким образом, сообщать им способность переходить в золь. Пептизаторами служат различные электролиты, которые способствуют дезагрегации аморфных осадков. В качестве примера можно назвать получение золя гидроксида железа (III ) при действии на него осадок небольшим количеством соли 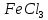 , выполняющей роль пептизатора. , выполняющей роль пептизатора.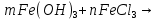 { [ { [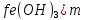 , nFe3+, 3(n-x)Cl- }3x+3xCl- , nFe3+, 3(n-x)Cl- }3x+3xCl- Практически все рыхлые свежеобразованные осадки гидроксидов металлов, например, 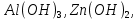 подвергаются пептизации. подвергаются пептизации.Возникновение двойного электрического слоя и его строение На основании изучения электрокинетических явлений в коллоидных системах было установлено, что у поверхности коллоидных частиц на границе раздела фаз образуется двойной электрический слой (ДЭС) и возникает скачек потенциала. Это обусловлено тем, что ионы одного знака необменно адсорбируются на поверхности адсорбента, а ионы противоположного знака в силу электростатического притяжения располагаются около нее. Причем величина и знак заряда поверхности зависят от природы твердых частиц адсорбента и от природы жидкости, с которой он соприкасается. Впервые представления о образований ДЭС было высказано Квинке (1859) и развито в работах Гельмгольца (1879). По Гельмгольцу, образование ДЭС происходит следующим образом. На поверхности коллоидной частицы адсорбируется преимущественно один из ионов, который сообщает поверхности слой знак заряда. Под действием электростатистических сил притяжения противоионы стремятся расположиться возможно ближе к ионам, адсорбированным на поверхности частиц. В результате образуется два слоя ионов, из которых один расположен на поверхности, другой- в растворе, на расстояний молекулярного радиуса. Такая система ионов получила название двойного электрического слоя по Гельмгольцу. С развитием теории электролитической диссоциации и введением понятия об ионах появилась теория, развитая в работах Гуи (1910), согласно которой ДЭС имеет диффузное строение. Под воздействием двух взаимно противоположных сил( электростатического притяжения и теплового движения частиц жидкости ) противоионы образуют около твердой поверхности адсорбента диффузную ионную атмосферу. В дальнейшем теория ДЭС получила свое развитие в работах Штерна (1924), который учел, что ионы имеют вполне определенные размеры, и центры их не могут подойти к заряженной поверхности ближе, чем на расстояний ионного радиуса. По Штерну, только часть противоионов находится на молекулярном расстояний от поверхности, образуя гельмгольцевский плоский конденсатор, другая часть образует диффузный слой. В разбавленных растворах структура ДЭС приближается к структуре слоя Гуи, а при повышении концентрации – к слою Гельмгольца. Таким образом, структура двойного слоя зависит не от механизма возникновения зарядов на поверхности коллоидных частиц, а от плотности расположения зарядов на ней. Согласно современной теорий ДЭС, при относительном движении жидкой и твердой фаз плоскость скольжения их лежит на некотором расстоянии от твердой фазы (рис. а, линия mn). 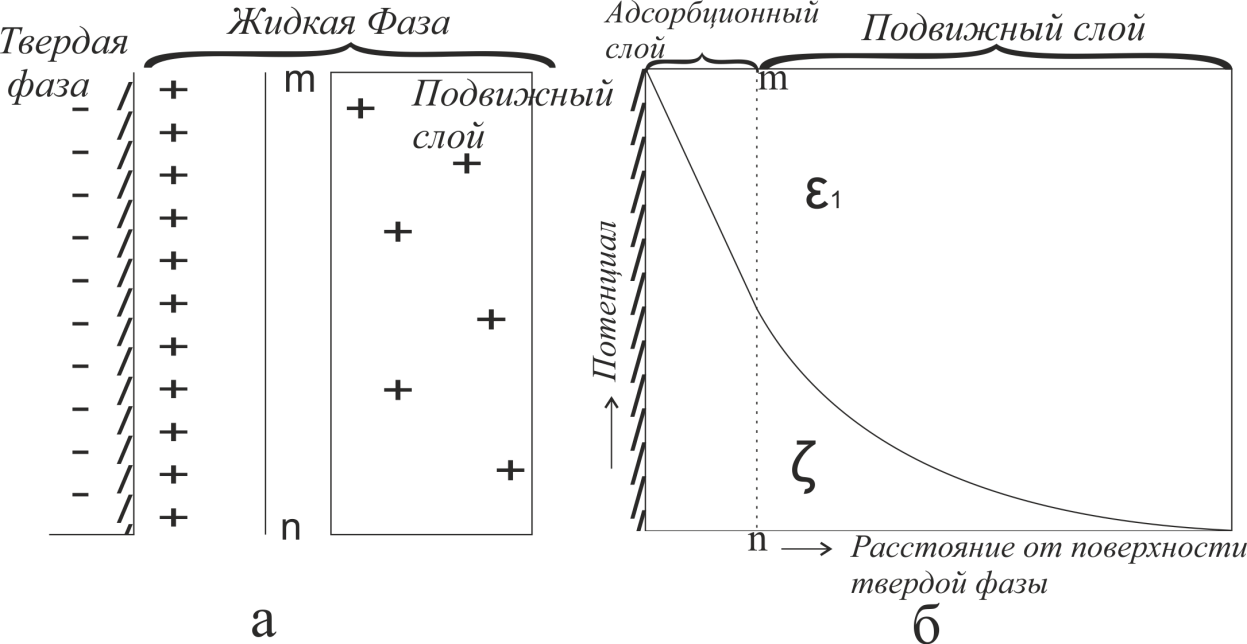 Рисунок. Схема двойного электрического слоя: а - расположение заряда; б - кривая падения потенциала Непосредственно у поверхности коллоидной частицы золя образуется так называемый адсорбционный слой, который включает не только потенциалопределяющие ионы, но и часть противоионов, которые в обычных условиях считаются неподвижными и при движении твердой фазы перемещаются вместе с ней. Остальная часть противоионов составляет диффузный слой, в котором концентрация ионов (по мере удаления от поверхности коллоидной частицы) постепенно убывает. Разность потенциалов между подвижной (диффузной) и неподвижной (адсорбционной) частью ДЭС называется электрокинетическим потенциалом. Этот потенциал обычно обозначают греческой буквой ζ (дзета) и поэтому называют дзета - потенциалом. Полное падение потенциала от его значения на поверхности до нулевого значения (рис. б) соответствует максимальной разности потенциалов между твердой поверхностью и всеми противоионами, взятыми вместе. Эту максимальную разность потенциалов называют термодинамическим потенциалом и обозначают греческой буквой ε (эпсилон). Как видно из рис. б, электрический потенциал составляет лишь часть термодинамического потенциала ε: ζ= ε – ε1, Где ε1 – падение потенциала в неподвижном слое, называемое адсорбированными в нем противоионами. Величина дзета – потенциала тесно связана с толщиной диффузионного слоя противоионов. Обычно чем больше размыт этот слой, тем больше величина потенциала. Если слой противоионов предельно сжат – дзета- потенциал равен нулю. Увеличение концентрации электролитов влечет за собой уменьшение толщины диффузионного слоя и, как следствие, уменьшение ζ- потенциала. Наоборот, разбавление золя способствует увеличению толщины диффузионного слоя за счет перехода противоионов из адсорбированного слоя. Таким образом, ζ- потенциал очень чувствителен к посторонним электролитам. Причем влияние на него оказывают и ионы, имеющие заряд обратного знака. Влияние постороннего иона на величину дзета -потенциала тем сильнее, чем больше заряд иона. Как показали многочисленные опыты, влияние природы иона на ζ – потенциал возрастает в гораздо большей степени, чем заряд ионов. Так, для ионов K+, Ba2+, Al3+ заряды относятся как 1: 2: 3, а концентрации, производящие одинаковое действие, относятся как 800: 25: 1 . 1.3. Строение золей Рассмотрим строение коллоидной частицы на примере золя иодида серебра. Последний получается при взаимодействии растворов нитрата серебра и иодида калия, при избытке одного из растворов. В случае избытка иодида калия получаются частицы, строение которых в общей форме можно представить следующим образом:  Где m-число молекул AgI, образующих нерастворимый в воде агрегат; n- число потенциалопределяющих ионов 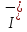 , причем всегда m ˃ n. Далее (n-x) – число противоионов , причем всегда m ˃ n. Далее (n-x) – число противоионов 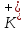 , образующих вместе с потенциалопределяющими ионами , образующих вместе с потенциалопределяющими ионами 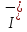 адсорбционный слой, а х – число противоионов адсорбционный слой, а х – число противоионов 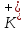 , находящихся в дисперсионной среде. Ионы эти не адсорбируются на ядре коллоидной частицы, но концентрируются вокруг него, образуя диффузный слой. Агрегат молекул , находящихся в дисперсионной среде. Ионы эти не адсорбируются на ядре коллоидной частицы, но концентрируются вокруг него, образуя диффузный слой. Агрегат молекул 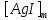 называется ядром коллоидной частицы, а система, заключенная в фигурные скобки, называется гранулой. Гранулы в данном случае имеют отрицательный заряд, что вызывает притяжение к ним находящихся в растворе ионов называется ядром коллоидной частицы, а система, заключенная в фигурные скобки, называется гранулой. Гранулы в данном случае имеют отрицательный заряд, что вызывает притяжение к ним находящихся в растворе ионов 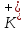 в эквивалентном количестве. Вся система, состоящая из гранул и этих ионов называется мицеллой. в эквивалентном количестве. Вся система, состоящая из гранул и этих ионов называется мицеллой.Если при образовании йодида серебра взять небольшой избыток нитрата серебра, то потенциалопределяющими ионом будет 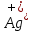 и формула мицеллы примет вид: и формула мицеллы примет вид: { 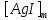 , , 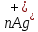 , (n-x) , (n-x) 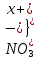 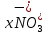 Таким образом, можно сформулировать принципы формирования мицеллы: Из растворов на поверхности коллоидных частиц (ядер) адсорбируются ионы, близкие по своей природе к составу ядра. Противоионы, связанные в адсорбционным слое, уменьшают заряд ядра, но не нейтрализуют его целиком. Знак заряда гранулы определяется знаком потенциалопределяющих ионов, так как они находятся в адсорбционном слое в избыточном количестве (n˃n-x). Противоионы диффузного слоя нейтрализуют свободный (избыточный) заряд гранулы: мицелла в целом электронейтральна. Эксперементальная частьМетод конденсации 1. Получение гидрозоля серы Насыщенный раствор серы в абсолютном спирте вливают по каплям в дистиллированную воду при взбалтывании. Получается молочно-белый опалесцирующий золь. Сера растворяется в этиловом спирте, образуя истинный раствор. В воде сера практически нерастворима, поэтому при добавлении воды к ее спиртовому раствору молекулы конденсируются в более крупные агрегаты. 2.Получение золя Fe(OH)3 посредством гидролиза. 100 мл дистиллированной воды нагревают до кипения. В кипящую воду по каплям добавляют 5-10 мл 2% - ного раствора FeCl3 . Получают коллоидный раствор гидроокиси железа (III) интенсивного красно-коричневого цвета. Затем осторожно вливают полученный раствор в полиэтиленовый мешочек и опускают его в кристаллизатор с дистиллированной водой. По истечению нескольких минут отбирают в пробирку небольшую пробу воды из кристаллизатора и добавляют 1-2 капли раствора AgNO3 . Образуется молочно-белый коллоидный раствор AgCl, что доказывает присутствие ионов Cl-. Реакция получения гидроокиси железа (׀׀׀) идет по схеме (6). Поверхностные молекулы агрегата Fe(OH)3 вступают в химическое соединение с HCl (7). Руководствуясь правилом С.М. Липатова, заключающемся в том, что из растворов на поверхности коллоидных частиц адсорбируются ионы, близкие по своей природе к составу ядра, схематически можно изобразить строение частиц золя гидроокиси железа (׀׀׀) следующим образом: FeOCl ⇌ FeO+ + Cl- [Fe(OH)3]n+mFeO+ +mCl- ={[Fe(OH)3]n mFeO+ (m-x)Cl-}+x xCl- Образующаяся мицелла в растворе диссоциирует: {[Fe(OH)3]nmFeO+(m-x)Cl-}+xxCl- ⇌ {[Fe(OH)3]n mFeO+ (m-x)Cl-}+x xCl- Реакция с AgNO3 доказываем подвижность ионов Cl- диффузионного слоя, которые способны переходить через полупроницаемую мембрану, давая осадок с ионами Ag+: Ag+ + Cl- → AgCl↓ 3. Приготовление эмульсии подсолнечного масла в воде методом пептизации. При взбалтывании подсолнечного масла с водой образуется эмульсия, которая быстро расслаивается. Для придания устойчивости эмульсии взбалтывание необходимо вести в присутствии эмульгатора (стабилизатора), в данном случае буры. Бура является электролитом, диссоциирующим в растворе: Na2B4O7 ⇌ 2Na+ + B4 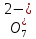 Ионы Na+ и B4 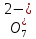 , адсорбируясь на частичках масла, сообщают им заряд, позволяющий им, отталкиваясь друг от друга, не слипаться. При взбалтывании подсолнечного масла с раствором буры образуется устойчивая эмульсия. , адсорбируясь на частичках масла, сообщают им заряд, позволяющий им, отталкиваясь друг от друга, не слипаться. При взбалтывании подсолнечного масла с раствором буры образуется устойчивая эмульсия.Лабораторная работа №6 «Измерение электродных потенциалов и ЭДС цепей»Теоретическая частьПрибор, в котором в результате химических превращений в системе можно получить электрическую энергию, называется гальваническим элементом. Он состоит из двух или нескольких соприкасающихся друг с другом растворов, в которые погружены металлические электроды, соединенные между собой внешним проводником. В такой системе анод окисляется, а на катоде протекает реакция восстановления: (-) A: MI – Ze- = M2+ (+) K: M22+ + Ze- = M2 Электродвижущей силой гальванического элемента ЭДС (Е) называется разность потенциалов между электродами в условиях работы элемента. ЭДС принято выражать положительной величиной. Поэтому при ее расчёте из потенциала металла, на котором протекают процессы восстановления, вычитают потенциал окисляющегося металла) при устранении диффузионного потенциала, возникающего на границе двух растворов за счёт разной подвижности ионов. Пример: элемент Даниэля–Якоби Zn / ZnSO4 // CuSO4 / Cu A : Zn – 2e- = Zn2+ К : Cu2+ + 2e- = Cu E = Ɛ Cu2+/Cu – Ɛ Zn2+/Zn Величина электродного потенциала, возникающего между металлом и раствором, содержащим ионы этого металла (Ɛ), определяется уравнением Нернста. Ɛ Mz+/M = Ɛ0Mz+/M + 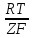 lna Mz+ lna Mz+или (tο =25oC) Ɛ Mz+/M = Ɛ0Mz+/M + 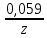 lga M2+ lga M2+где Ɛ0 – стандартный электродный потенциал, зависящий от природы металла. R – универсальная газовая постоянная (8,32 Дж/моль*гр.) T – абсолютная температура, T = t0 + 273 Z – валентность металла F – число Фарадея (96500 Кл) a – активность электролита, применяемая для сильных электролитов (a = C·f 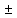 , С – концентрация электролита, моль/л; f , С – концентрация электролита, моль/л; f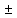 - средний коэффициент активности электролита, Приложение 1) - средний коэффициент активности электролита, Приложение 1)Определить абсолютную величину электродного потенциала невозможно. Поэтому его измеряют относительно другого электрода, потенциал которого известен. Например, относительно стандартного водородного электрода, потенциал которого условно принят за ноль. Таким образом, электродным потенциалов называется ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода. Металлы, расположенные в ряд по величине их стандартных потенциалов, образуют ряд напряжений или ряд стандартных электродных потенциалов (СЭП). Чем меньше алгебраическая величина потенциала, т. е. чем левее в ряду напряжений расположен металл, тем выше его восстановительная способность. На основании ряда СЭП можно сделать некоторые важные выводы о химической активности металла. Каждый металл в ряду СЭП обладает способностью вытеснять все следующие за ним металлы из растворов их солей. Все металлы, стоящие в ряду СЭП до водорода, вытесняют водород из разбавленных растворов кислот. Следует учитывать, что рядом СЭП следует пользоваться с учетом особенностей рассматриваемых процессов. (взаимодействия с водой щелочных металлов, образование пассивных пленок на некоторых металлах и т. д.) Экспериментальная часть Измерение электродных потенциалов и ЭДС цепей 1. Для измерения потенциалов отдельных электродов необходимо собрать цепь из исследуемого электрода и электрода сравнения (рис. 1). В качестве электродов сравнения используют электроды второго рода (например, хлорсеребряный электрод Ag/AgCl/KCl), обладающие хорошо воспроизводимыми значениями потенциалов. Схема прибора для измерения потенциалов электрода 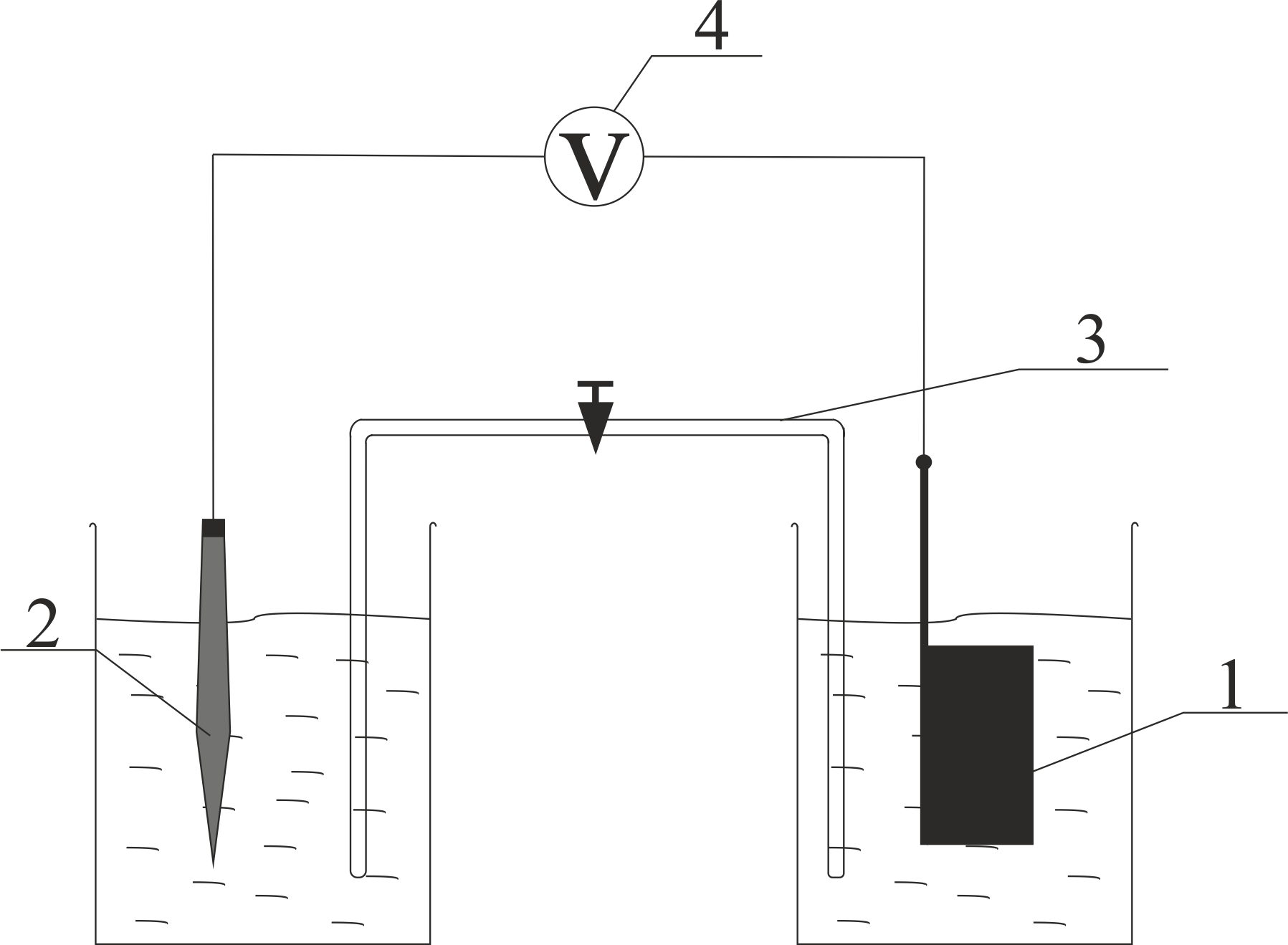 1 – Исследуемый электрод в растворе электролита. 2 – Электрод сравнения в насыщенном растворе KCl. 3 – Электролитический ключ. 4 – Измерительный прибор (потенциометр или высокоомный вольтметр) Перед опытом исследуемые электроды обезжиривают спиртом, а при необходимости декапируют в растворе кислоты. Хлорсеребряный электрод сравнения опускают в насыщенный раствор KCl, исследуемый - в раствор электролита (Cu в CuSO4, Zn в ZnSO4) Электролитический ключ служит для контакта двух растворов. Колено ключа, обращенное к исследуемому электроду, заполняют раствором электролита. Другое колено - раствором KCl. При подключении проводов к измерительному прибору определяют потенциал исследуемого электрода относительно электрода сравнения 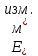 Далее пересчитывают 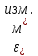 на водородную шкалу по формуле (4). на водородную шкалу по формуле (4).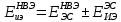 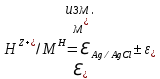 где 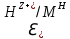 – потенциал исследуемого электрода по водородной шкале. – потенциал исследуемого электрода по водородной шкале.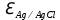 – потенциал стандартного хлорсеребряного электрода (+0.22) – потенциал стандартного хлорсеребряного электрода (+0.22)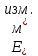 – измеренный потенциал исследуемого электрода относительно хлорсеребряного электрода сравнения. – измеренный потенциал исследуемого электрода относительно хлорсеребряного электрода сравнения. Знак (+) в формуле (4) реализуется в том случае, когда исследуемый электрод подключен к (+) измерительного прибора, а электрод сравнения – к (-). Если же исследуемый электрод более отрицателен, чем электрод сравнения, то в формуле (4) следует оставить минус. Металл, электролит, его концентрация - по заданию преподавателя. По формуле Нернста (3) рассчитывают значения потенциала исследуемого электрода с учетом среднего коэффициента активности электролита 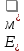 и сравнивают эту величину с измеренным и пересчитанным на водородную шкалу значением электродного потенциала и сравнивают эту величину с измеренным и пересчитанным на водородную шкалу значением электродного потенциала 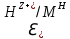 . . Определяют относительную ошибку измерения 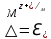 - - 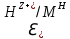 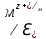 (5) (5)Полученные результаты заносят в таблицу 2.1.1. Таблица 2.1.1. Значения электродных потенциалов в зависимости от природы электролита и концентрации электролита
  И т.д. 0.01 0.10 1.00 И т.д. 2.1.3.2 Измерение ЭДС электрохимической цепи Собрать установку для измерения ЭДС элемента Даниэля- Якоби 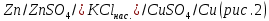 Схема прибора для измерения ЭДС гальванического элемента: 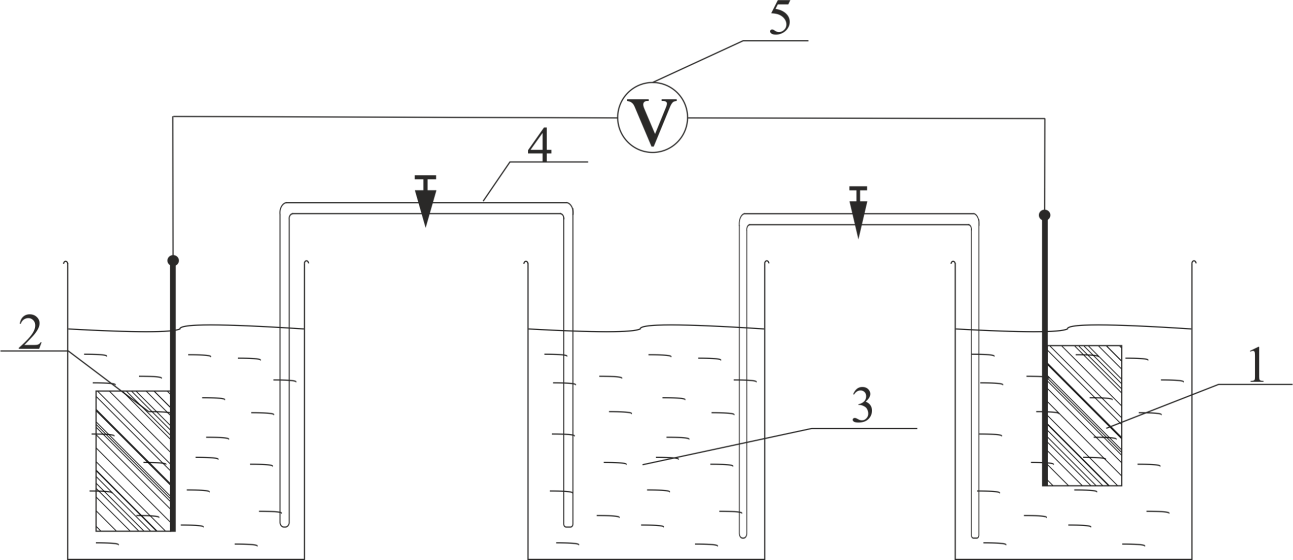 1-Цинковый электрод в растворе 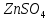 2- Медный электрод в растворе 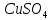 3-Насыщенный раствор KCl 4-Электролитические ключи 5- Измерительный прибор Элемент представляет собой Zn в растворе 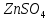 . Cu в растворе . Cu в растворе 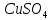 . Подготовка электродов к работе описана ранее. Контакт между растворами осуществляется двумя электролитическими ключами, одно колено которых заполняют раствором насыщенным раствором KCl, другое растворами . Подготовка электродов к работе описана ранее. Контакт между растворами осуществляется двумя электролитическими ключами, одно колено которых заполняют раствором насыщенным раствором KCl, другое растворами 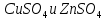 . Концентрация солей – по заданию преподавателя. Соединительные провода от электродов замыкаются на измерительном приборе. Измеряют ЭДС по формуле (6) как разность между потенциалом Cu и Zn электродов с учетом коэффициентов активности. . Концентрация солей – по заданию преподавателя. Соединительные провода от электродов замыкаются на измерительном приборе. Измеряют ЭДС по формуле (6) как разность между потенциалом Cu и Zn электродов с учетом коэффициентов активности. 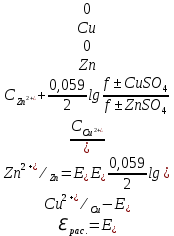 (6) (6) Находят относительную ошибку опыта 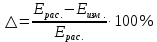 (7) (7)Результаты заносят в таблицу 2.1.2 Значения ЭДС электрохимической цепи в зависимости от концентрации солей
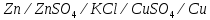 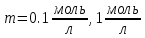 и т.д. и т.д. Приложение 1Стандартные окислительно-восстановительные потенциалы 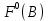 при при 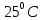 по отношению к по отношению к 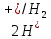 , газ , газ
Приложение 3Стандартные электродные потенциалы некоторых металлов
ОглавлениеЛабораторная работа №4 «Коллоидно-дисперсные системы. Их получения и свойства» 2 Лабораторная работа №6 «Измерение электродных потенциалов и ЭДС цепей» 15 Приложение 1 23 Приложение 3 25 |

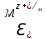
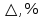
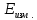 , в
, в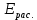 , в
, в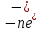
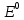
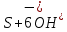
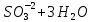
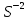
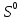
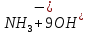
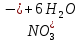
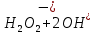
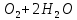
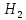
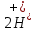
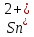
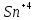
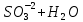
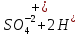
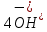
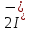
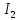
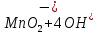
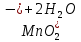
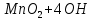
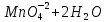
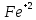
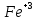
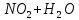
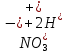
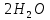
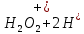
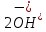
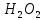
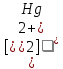
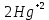
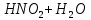
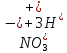
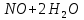
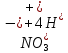
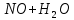
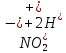
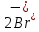
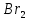
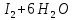
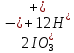
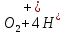
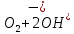
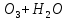
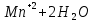
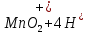
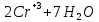
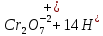
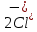
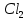
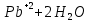
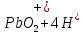
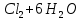
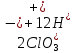
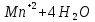
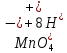
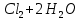
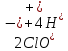
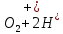
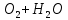
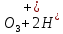
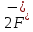
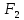
 Ca2+ + 2e-
Ca2+ + 2e-