химия. Лабораторная работа_№6. Лабораторная работа 6 Электролиз растворов цель работы Изучить электродные процессы при электролизе растворов
 Скачать 112.49 Kb. Скачать 112.49 Kb.
|
|
Лабораторная работа № 6 Электролиз растворов 1.ЦЕЛЬ РАБОТЫ: Изучить электродные процессы при электролизе растворов. 2. РАБОЧЕЕ ЗАДАНИЕ: 1. Взвесить массу катода до электролиза. 2.Провести процесс электролиза. 3. Взвесить массу катода после электролиза. 4. Рассчитать выход по току. 5.Ответить на контрольные вопросы. 3. ОБЩИЕ СВЕДЕНИЯ. Окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита у электродов при пропускании постоянного электрического тока, называется электролизом. Электролиз осуществляется в электролизерах. Основным конструкционным элементом являются электроды, соединенные с полюсами источника постоянного тока. Электрод, присоединенный к отрицательному полюсу источника тока, называется катодом, положительный электрод - анодом. На катоде в процессе электролиза всегда происходит восстановление катионов из объема электролита. На аноде происходит отдача электронов, т.е. реакция окисления. В растворах и расплавах различных электролитов имеются разноименные по знаку ионы, т.е. катионы и анионы, которые находятся в хаотическом движении. Но если в такой расплав электролита, например, расплав хлорида натрия NaCl, опустить электроды и пропустить постоянный электрический ток, то катионы Na+ будут двигаться к катоду, а анионы Сl- к аноду. На катоде электролизера происходит процесс восстановления катионов электронами внешнего источника тока: Na+ + e= Na° Катион натрия Металлический натрий На аноде идет процесс окисления аниона хлора, причем, отрыв избыточных электронов от С1- осуществляется за счет энергии внешнего источника тока: 2С1- - 2е = С12° Анион хлора Молекулярный хлор Суммарное уравнение электролиза расплава хлорида натрия: 2NaCl → 2Na + + 2С1-→ 2Na ° + С12° Если электролизу подвергается расплав, который содержит несколько различных катионов металлов, то в этом случае последовательность восстановления определяется электродными потенциалами. В первую очередь восстанавливаются катионы металлов, обладающих большим значением электродного потенциала. Более сложные процессы электролиза протекают в водных растворах электролитов. С учетом ряда стандартных потенциалов металлов возможны три случая протекания восстановительного процесса на катоде в водных растворах (процессы на катоде не зависят от материала катода): 1. Катионы металлов, стандартный электродный потенциал которых больше, чем -0,413В (от Ni2+ до Pt4+), при электролизе практически полностью восстанавливаются на катоде. Меn+ +n*е→Меo 2. Катионы металлов, с малой величиной стандартного электродного потенциала (от Li+ до А13+ включительно) не восстанавливаются на катоде, вместо них восстанавливаются молекулы воды: 2Н2О + 2е → Н2 + 2ОН- 3. Катионы металлов, стандартный ионный потенциал которых меньше, чем у водорода, но больше, чем у алюминия (от Мn+ до Н2+), при электролизе на катоде восстанавливаются одновременно с молекулами воды. Для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться правилами таблицы 1. Таблица 1 Катодные процессы в водных растворах
Характер реакций, протекающих на аноде, зависит от природы аниона и материала анода. Аноды подразделяются на нерастворимые и растворимые. Нерастворимые аноды изготавливаются из угля, графита, платины, иридия, при электролизе они служат лишь передатчиками электронов. Анионы бескислородных кислот (S2-, I-, Вг-, Сl-) при их достаточной концентрации окисляются довольно долго: 2Сl--2е→С12 2Вг--2е→Вг2 Если же раствор содержит анионы кислородных кислот (например, SO42-,NO3-, СО22-, РО43-), то на аноде окисляются не эти ионы, а молекулы воды: 2Н2О-4е→О2 + 4Н+ Если растворимые аноды изготавливаются из меди, серебра, цинка, кадмия, никеля, железа (в определенных условиях нерастворимыми становятся и аноды из железа, никеля, свинца), при электролизе они окисляются сами. Me - ne→ Me n+ Рассмотренные правила сведены в таблицу 2: Таблица 2. Анодные процессы в водных растворах
Решение типовых задач Задача 1. Написать уравнение электролиза раствора KCl, если анод нерастворимый. Р  ешение: KCl↔K+ +Cl- ешение: KCl↔K+ +Cl-Катод (-) Анод (+) 2H2O+2e↔ H2↑+2OH 2Cl-2e↔Cl2 Суммарное ионное уравнение: 2Н2О + 2С1 → Н2↑ + С12↑ + 2ОН- Суммарное молекулярное уравнение: 2КС1 + 2Н2О→ 2Н2↑ + С2↑+ 2КОН Вторичный продукт электролиза Задача 2. Написать уравнение реакции электролиза водного раствора AgNO3, если а) анод нерастворимый; б) анод растворимый, серебряный. Решение: а) анод нерастворимый AgNO3↔ Ag + + NO3- катод(-)…………………………………….анод(+) A  g++1e→Ag0 2H2O-4e→O2+4H+ g++1e→Ag0 2H2O-4e→O2+4H+Суммарное уравнение процессов: 4AgNO3 + 2H2O→4Ag + О2+4HNO3 Вторичный продукт электролиза б) анод растворимый, серебряный к  атод(-) анод(+) атод(-) анод(+)A  g++1e→Ag Ag0-1e→Ag+ g++1e→Ag Ag0-1e→Ag+Суммарное уравнение электролиза с растворимым анодом написать нельзя. Расчет количества веществ, разложенных или образовавшихся в процессе электролиза, производится по закону Фарадея. Теоретически массы веществ, испытавших изменение при электролизе, определяются 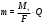 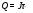 Q – количество прошедшего электричества m – масса вещества, г. 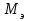 - химический эквивалент вещества, г. - химический эквивалент вещества, г.J– сила тока, А  - время электролиза, сек. - время электролиза, сек.Пример: Сколько меди выделяется при пропускании через раствор ее соли тока силой 6А, в течение 1 часа, если выход по току составляет 98%? m(Си)факт = m(Си)теор*0,98 = 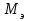 (Cu)*J*τ*0,98 /96500= 32*6*3600*0,98/96500 =7г.. (Cu)*J*τ*0,98 /96500= 32*6*3600*0,98/96500 =7г.. Следовательно, на катоде выделится 7 грамм меди. 4. ОБЪЕКТ ИССЛЕДОВАНИЯ. Лабораторная установка для проведения процесса электролиза с растворимым медным анодом. 5. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1. В каких случаях образуются вторичные продукты при электролизе? 2. В какой последовательности и выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni2+, Cr2+,Fe3+? 3. Какой силы должен быть ток, чтобы при пропускании его через расплав MgSO4 выделить на катоде 6 г. магния за 10 часов? Написать уравнения электродных процессов. 4. Через последовательно соединенные электролитические ванны с платиновыми электродами пропустили ток. В первой ванне раствор сульфата натрия, во второй-раствор нитрата серебра, а в третьей - раствор соляной кислоты. Какие продукты выделились на электродах во всех трех ваннах и сколько их получилось по массе, если в первой ванне выделится на катоде 1 мг. водорода? 5. Через водный раствор NaCl (электроды угольные) пропускали ток сначала при перемешивании раствора, а затем без перемешивания, отделив в последнем вторичные продукты. Написать уравнения электродных процессов для двух случаев. 6. ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ И ПОРЯДОК ВЫПОЛНЕНИЯ ОПЫТА. . Электролиз водного раствора сульфата меди с медным анодом. Опыт проводите в стакане, который закрывается эбонитовой крышкой, снабженной двумя клеммами для закрепления электродов (см. рис. 1). Р             3 2 аствор электролита А     нод. нод.К    атод. атод.    1       Рис. 1. Электролизный стакан. Раствор электролита Анод Катод Тонкий медный электрод тщательно зачистите абразивным порошком, промойте проточной водой, высушите фильтрованной бумагой и взвесьте на технических весах с точность до 00,1 гр. Закрепите с помощью зажимов оба медных электрода в крышке стакана. В стакан налейте ¾ его объема раствор состава: CuSO4*5H2O-150 г/л. H2SO4-50г/л. С2H5OH-50г/л. Опустите электроды в раствор. Электроды соедините с полюсами источника тока. Включите, отметив по секундной стрелке часов время и ток в цепи электролизера. Быстро при помощи реостата установите силу тока 0,5-1,5 А, поддерживайте её постоянной. Составьте схему электролиза (см. рис. 2) и уравнения реакций, протекающих на катоде и аноде. По истечении 20 минут (в случае резкого падения тока электролиз прекратить) освободите из зажимов катод, вымойте его в проточной воде, осторожно просушите фильтрованной бумагой и снова взвесьте на технических весах. Все количественные параметры электролиза внесите в таблицу 3. Таблица 3.
              А            V       катод Анод Рис. 5. Схема процесса электролиза. Пользуясь полученными данными, по формуле Фарадея, рассчитайте теоретически возможное количество восстановленной на катоде меди. Считая, что масса растворенной с анода меди точно равна её количеству, осажденному на катоде, определите для этого процесса выход по току. 7. РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА. При проведении эксперимента следить за показаниями приборов. 8. СОСТАВЛЕНИЕ ОТЧЕТА. 1. Порядок проведения опыта. 2. Расчеты. 3. Ответы на контрольные вопросы. 4. Вывод 5. Решить предложенный вариант 9. СПИСОК ЛИТЕРАТУРЫ. 1. Глинка Н.Л. Задачи и упражнения по общей химии. Москва: Интеграл – пресс, 2001 – 2006,95 -102 с. 2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004, 204 -212 с. 3. Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических ( нехимических) специальностей.- Северодвинск: Севмашвтуз, 2009г., часть 1. 10. РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ. 1. Соблюдайте осторожность при работе с ареометром. 2 Не оставляйте на рабочих местах грязную посуду. | |||||||||||||||||||||||||||||||||||||||||||||||


 -, Br-, S2- , Сl- , ОН- , SO42- , NO3- , F-
-, Br-, S2- , Сl- , ОН- , SO42- , NO3- , F-