|
|
лекции. Лекция 3 Реакции ионного обмена. Лекция 3 Реакции ионного обмена в водных растворах электролитов Реакции в водных растворах|
Лекция №3 Реакции ионного обмена в водных растворах электролитов
результате диссоциации электролитов, и поэтому они называются – реакциями ионного обмена.Реакции ионного обмена идут до конца только в следующих случаях: 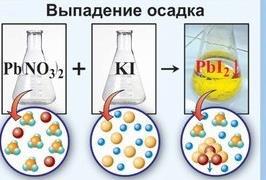
1.Образуется осадок ↓.
|
|
|
|
|
|
|
|
|
|
|
|
CuSO4 +2 NaOH → Cu(OH)2↓+ Na2SO4
|
|
|
|
|
|
|
|
|
|
|
|
р
|
|
|
|
|
р
|
|
н
|
р
|
|
|
|
Cu2++
|
SO
|
4
|
2-
|
|
+
|
2 Na
|
++2OH- → Cu(OH)2↓+
|
2Na++SO
|
4
|
2-
|
|
|
|
|
|
|
Cu2++
|
2OH- → Cu(OH)2↓
|
|
|
|
|
|
|
|
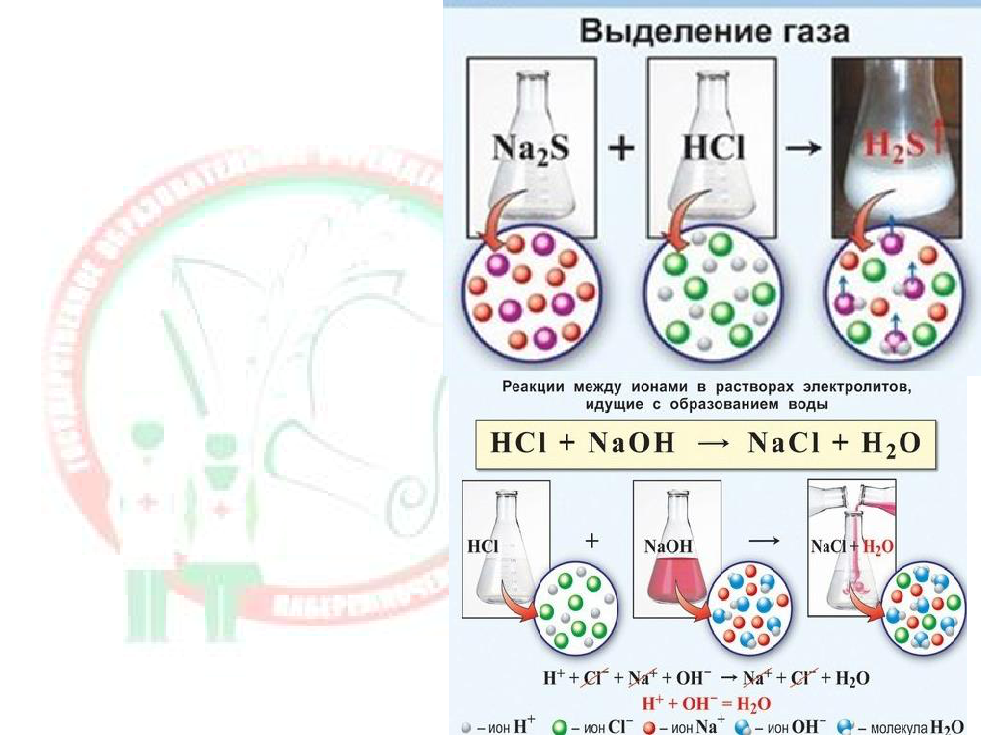
2.Если выделяется газ↑.
|
|
|
|
|
|
|
|
Na2CO3 +2HCl→2NaCl +H2CO3 (CO2↑+H2O)
|
|
|
|
|
|
|
|
р
|
|
|
|
|
р
|
|
р
|
|
|
|
|
|
|
|
2Na+
|
+CO3
|
2- +2H++
|
2Cl-
|
→
|
2Na++2Cl-
|
+ CO2↑+H2O
|
|
|
|
CO2↑+H2O → CO2↑+H2O
|
|
|
|
|
|
|
|
3.Если образуется слабый электролит (
|
|
|
|
малодиссоциирующее вещество).
|
|
|
|
|
|
|
|
CH3COONa + HCl→CH3COOH +NaCl
|
|
|
|
|
|
|
|
|
|
р
|
|
|
|
|
|
|
|
р
|
слабый электролит
|
р
|
|
CH3COO-+
|
Na+
|
+ H++
|
Cl-
|
→CH3COOH +
|
Na++Cl-
|
|
|
|
|
|
|
CH
|
3COO- + H+ →CH3COOH
|
|
|
|
|
|
|
|
|
|
(Вода является слабым электролитом)
|
|
|
|  При отсутствии ионов, которые, связываясь между собой, образуют осадок, газ или слабый электролит, реакция является обратимой. Обратимая реакция: KNO 3 +NaCl ↔ KCl + NaNO 3K ++NO 3- +Na ++Cl - ↔ K ++Cl - + Na ++NO 3-
растворе присутствует смесь ионов, так как нет ионов способных связываться между собой.
Составление реакций ионного обмена
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алгоритм
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.Записать уравнение реакции в
|
|
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCL
|
|
молекулярном виде:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. По таблице растворимости определить
|
|
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCL
|
|
растворимость каждого вещества
|
|
|
р
|
|
р
|
н
|
р
|
|
(Приложение1):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.Записать уравнения диссоциации
|
|
|
|
|
|
|
|
2+
|
|
-
|
|
|
|
|
|
|
BaCl2 ↔ Ba
|
+2Cl
|
|
|
|
|
|
исходных веществ и продуктов реакции:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+
|
|
-
|
|
|
|
|
|
|
|
2NaCL↔ 2Na +2CL
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+
|
|
2-
|
|
|
|
|
|
|
|
Na2SO4 ↔ 2Na +SO4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.Составить полное ионное уравнение
|
|
2+
|
-
|
|
|
+
|
|
2-
|
+
|
|
|
Ba
|
+2Cl + 2Na +SO4
|
|
→ BaSO4↓ + 2Na
|
|
реакции:
|
|
|
|
|
|
|
|
-
|
|
|
|
|
|
|
|
|
|
|
|
|
+2CL
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Найти одинаковое ионы в левой и
|
|
2+
|
-
|
|
|
+
|
|
2-
|
+
|
|
|
|
Ba
|
+2Cl
|
+ 2Na +SO
|
|
→ BaSO ↓ + 2Na
|
|
правых частях подчеркнуть их и сократить
|
|
|
|
|
|
|
|
4
|
|
4
|
|
|
|
-
|
|
|
|
|
их:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+2CL
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.Записать сокращенное ионное уравнение
|
|
2+
|
|
|
|
2-
|
|
|
|
|
|
|
|
|
|
Ba
|
+ SO4
|
|
→ BaSO4↓.
|
|
реакции:
|
|
|
|
|
|
|
|
7.Сделайте вывод
|
|
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCL
|
|
|
|
(молекулярное уравнение )
|
|
|
|
Ba2++2Cl- + 2Na++SO4
|
2- = BaSO4↓ + 2Na+
|
|
|
|
+2CL- (полное ионное уравнение)
|
|
|
|
Ba2+ + SO4
|
2-
|
= BaSO4↓. (сокращенное
|
|
|
|
ионное уравнение
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Справка:1.Формулы, всех растворимых сильных электролитов, которые нацело распадаются на ионы (сильных кислот, сильных оснований, солей) записывают в виде
ионов.
NaOH = Na + + OH-
2.Формулы слабых электролитов пишут в молекулярной форме
3.В молекулярном виде изображают формулы веществ, если они газообразные или нерастворимые в воде
4.При этом выпадение осадка в реакции отмечают↓, а выделение газа↑. |
|
|
 Скачать 0.59 Mb.
Скачать 0.59 Mb.



