лабораторная. Лабораторная работа. Гальванический элемент
 Скачать 30.38 Kb. Скачать 30.38 Kb.
|
Лабораторная работа.ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ.ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВЦель работы: изучение принципа действия гальванического элемента и процессов электролиза водных растворов некоторых солей. Выполнение работы. Опыт 1. Изготовление медно − цинкового гальванического элемента В один микростаканчик налейте почти доверху 1 М раствор сульфата цинка и опустите цинковый стержень, в другой налейте 1 М раствор сульфата меди(II) и опустите медный стержень. Соедините растворы электролитическим ключом, заполненным насыщенным раствором хлорида калия, а опущенные стержни – проводником первого рода с гальванометром. Наблюдайте отклонение стрелки последнего, указывающее на возникновение электрического тока, обусловленного различной величиной электродных потенциалов цинка и меди. Запишите данные опыта по следующей форме. Результаты опыта
Опыт 2. Электролиз водных растворов солей с нерастворимым анодом Опыты по электролизу водных растворов как с нерастворимыми (инертными) электродами, так и с растворимым анодом проводите в электролизере, представляющем собой U-образную трубку высотой 5 – 6 см и диаметром 0,6 см. 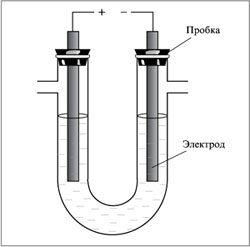 Рисунок 1. Общая схема электролизера. Электродами служат графитовые стержни и кусочки проволоки из соответствующих металлов, вставленные в резиновые пробки (рисунок 1). Пробки в электролизер вставляйте неплотно. Источником тока является ток от сети, поданный через выпрямитель. Во всех опытах электролизер заполните раствором электролита на 2/3 своего объема и закрепите в штативе. Электролизер и электроды перед каждым опытом тщательно промывайте дистиллированной водой. Электролиз хлорида олова (II) Заполните электролизер раствором хлорида олова (II). В оба колена опустите графитовые электроды и соедините их с источником постоянного тока. Через 3 – 4 мин пропускания тока выньте из электролизера графитовый анод, прибавьте в раствор 3 – 4 капли раствора иодида калия и столько же крахмального клейстера и наблюдайте изменение окраски раствора. Запишите данные опыта по следующей форме. Результаты опыта
Электролиз иодида калия Налейте в пробирку на 3/4 ее объема раствор иодида калия и добавьте по 5 – 6 капель фенолфталеина и крахмального клейстера. Перемешайте раствор и перелейте в электролизер. Опустите в оба колена электролизера графитовые электроды и подключите их к источнику постоянного тока. Запишите результаты опыта по следующей форме. Результаты опыта
Электролиз соли меди(II) с медным анодом Налейте в электролизер раствор сульфата меди. Опустите в одно колено электролизера графитовый электрод и соедините его с катодом постоянного источника тока. В другое колено опустите медный электрод и присоедините его к положительному полюсу (анод). Запишите результаты опыта по следующей форме. Результаты опыта
Задания для самоконтроля Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, в другом — анодом. Напишите уравнения процессов, протекающих во время работы элементов, и вычислите ЭДС при использовании 1 М растворов солей.
Какие процессы происходят на электродах цинкового концентрационного гальванического элемента, если один из них погружен в 1М раствор сульфата цинка, а другой – в 10─3 М раствор сульфата цинка? В каком направлении движутся электроны во внешней цепи? Составьте схему данного гальванического элемента и рассчитайте его ЭДС.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе: а) раствора серной кислоты (анод − железный); б) расплава нитрата серебра (электроды угольные). Сколько литров газа выделится в варианте “б”, если электролиз проводить в течение 30 мин при силе тока 13 А? Выход по току составляет 91 %.
|

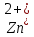 (0,1
(0,1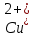 (0,001
(0,001