Урок "Электролиз растворов и расплавов"
 Скачать 110.31 Kb. Скачать 110.31 Kb.
|
|
Урок "Электролиз растворов и расплавов". 11 класс (подготовка к ЕГЭ) учитель химии МАОУ «Лицей 29» г. Тамбов Дегтярева Елена Эдуардовна. Цель: сформировать у учащихся представление об электролизе водных растворов и расплавов электролитов. Задачи: расширяют знания об электролизе как окислительно-восстановительном процессе; научить учащихся определять процессы, происходящие на электродах, составлять суммарные уравнения реакции электролиза. углубить знание окислительно-восстановительных процессов, понимание практического значения электролиза в жизни человека. разобрать задания 22 и 32 ЕГЭ по теме «Электролиз». Тип урока: изучение нового материала. Ход урока: Учитель: При изучении темы «Способы получения металлов» мы говорили об электрометаллургии. Учитель: Что такое электрометаллургия? Ученик: Электрометаллургия – это восстановление металлов в процессе электролиза расплавов или растворов солей. Электролизом получают многие металлы, щелочи, водород, кислород, органические вещества и др. Учитель: Что такое электролиз? Движение ионов в растворе или расплаве электролита является хаотическим, беспорядочным. Но если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться упорядоченно к электродам: катионы – к катоду, анионы – к аноду. П 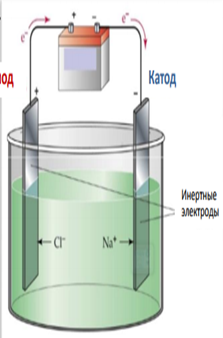 рибор, в котором проводят электролиз, называется электролизёром или электролитической ванной (рис. 1). рибор, в котором проводят электролиз, называется электролизёром или электролитической ванной (рис. 1). Н Анод а катоде, отрицательно заряженном электроде (-), происходит процесс восстановления, на аноде, положительно заряженном электроде (+) - процесс окисления. Восстановительное и окислительное действие электрического тока сильнее действия химических восстановителей и окислителей. Это явление называется электролизом. Рис. 1. Электролизер. Таким образом, электролиз - это совокупность ОВР, протекающих на электродах в растворах или расплавах электролитов при прохождении постоянного электрического тока. Сущность электролиза заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно. На характер течения электродных процессов при электролизе большое влияние оказывает состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура и т.д.). Различают электролиз расплавов и растворов электролитов. В последнем случае в процессе электролиза будут участвовать молекулы воды. Для определения результатов электролиза существует ряд правил, которые вы должны выучить. Запишем их в тетрадь. Процессы идущие на катоде (восстановление). 1. В расплавах катионы металлов восстанавливаются до свободного металла эл. ток  Мn+ + nе М0 Мn+ + nе М02. В растворах (процесс на катоде не зависит от материала электрода, а зависит от активности металла). а) Если металл расположен в ряду напряжений до Al включительно, то на катоде идёт процесс восстановления воды: эл. ток 2Н2О +2е → Н2 + 2ОН- б) Если металл расположен в ряду напряжений между Al и Н2 то на катоде идут одновременно процессы восстановления воды и катионов металла:  эл. ток Мn+ + nе М0 эл. ток 2Н2О +2е → Н2 + 2ОН- в) Если металл расположен в ряду напряжений после Н2, то на катоде идет процесс восстановления катионов металла: эл. ток  Мn+ + nе М0 Мn+ + nе М03 эл. ток . При электролизе растворов кислот идет процесс восстановления ионов водорода: 2Н+ +2е → Н20 Процессы, идущие на аноде (окисление). 1. В расплавах анионы бескислородных кислот окисляются до соответствующего простого вещества, например: 2  эл. ток Cl- - 2e Cl20 К эл. ток ислородсодержащие анионы выделяют кислород и превращаются в один из оксидов, например: SО42- - 2е → SО2 + О20↑ 2. В растворах (процесс на аноде зависит от материала электрода). Аноды могут быть двух видов растворимые (железо, медь, цинк, серебро и металлы . которые окисляются в процессе электролиза) и нерастворимые , или инертные (графит, платина). а эл. ток ) Если анод растворимый, то независимо от природы аниона, всегда идёт окисление металла анода, например: C  u0 – 2e Cu2+ u0 – 2e Cu2+б) Если анод инертный. • эл. ток В случае бескислородных анионов (кроме фторидов) идет окисление анионов: 2  Cl- - 2e Cl20 Cl- - 2e Cl20• эл. ток В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется, остается в растворе:  2Н2О + 4е O2 + 4Н+ 2Н2О + 4е O2 + 4Н+3 эл. ток . При электролизе растворов щелочей идет окисление гидроксид ионов: 4  ОН- - 4е О20 + 2Н2О. ОН- - 4е О20 + 2Н2О.4. При электролизе расплавов оксидов на аноде окисляется кислород: 2  О2- - 4е О20 О2- - 4е О20Рассмотрим схемы электролиза расплавов и растворов электролитов и сравним их. Схема процесса электролиза расплава NаСℓ NaСl → Nа+ + Cℓ- (процесс диссоциации) (-) катод: Nа+ Nа+ + е → Na 2 восстановление (+) анод: Сℓ- 2Сℓ- - 2е → Сℓ2 1 окисление эл. ток  Суммарное ионное уравнение: Nа+ +2Сℓ- 2Na + Сℓ2 Суммарное ионное уравнение: Nа+ +2Сℓ- 2Na + Сℓ2Молекулярное уравнение электролиза расплава NаСℓ эл. ток 2NаСℓ → 2Na + Сℓ2. Электролизом расплавов солей получают щелочные металлы. Схема электролиза раствора хлорида натрия с угольными электродами. NaСℓ → Nа+ + Cℓ- (-) катод Nа+, Н2О 2Н2О +2е → Н2 + 2ОН- 1 восстановление (+) анод: Cℓ-, H2O 2 Cℓ- - 2е → Cℓ2 1 окисление эл. ток Суммарное ионное уравнение: 2 Cℓ-+ 2Н2О → Н2↑ + 2OH- + Сℓ2↑. эл. ток Суммарная схема процесса электролиза 2 NaСℓ + 2Н2О → Н2↑ + 2NaOH + Сℓ2↑. Схемы электролиза расплава и раствора NaСℓ существенно отличаются. В результате электролиза водного раствора NaСℓ на катоде выделяется водород, на аноде – хлор, а при катодном пространстве образуется гидроксид натрия. Сравним схемы электролиза расплава и раствора Na2SО4. Схема электролиза расплава сульфата натрия может быть представлена следующим образом Na2SО4 → 2Nа+ + SО42- (-) катод: Nа+ Nа+ + 1е → Nа0 4 (+) анод: SО42- 2 SО42- - 4е → 2SО3 + О2 1 эл. ток 4Nа+ + 2 SО42- → 4Nа0 + 2SО3↑+ О2↑ эл. ток 2Na2SО4 → 4Nа + 2SО3↑+О2↑ . Электролиз раствора сульфата калия с угольными электродами. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет восстанавливаться вода, выделяться водород и накапливаться ионы ОН-. У анода выделяется кислород и накапливаются ионы Н+. При перемешивании раствора он будет нейтральным. K2SO4 ® 2K++ SO42-  (-) катод К+ , Н2О 2H2O + 2e H2 + 2OH- 2 (-) катод К+ , Н2О 2H2O + 2e H2 + 2OH- 2  эл. ток (+) анод: SO42- , Н2О 2H2O - 4e O2 + 4H+ 1  6H2O 2H2 +4OH- + O2 + 4H+ 6H2O 2H2 +4OH- + O2 + 4H+ эл. ток 2H2O 2H2 + O2 По сути, электролиз раствора K2SO4 сводится к уравнению электролиза воды. И тем не менее соль играет в процессе электролиза свою роль: она придает раствору электропроводность, без чего процесс электролиза происходил бы значительно медленнее. Рассмотрим электролиз раствора сульфата цинка с инертными электродами. ZnSO4 ® Zn2+ + SO42- (-) катод Zn2+ , Н2О (+) анод: SO42- , Н2О   Zn 2+ + 2e Zn0 2H2O - 4e O2 + 4H+ Zn 2+ + 2e Zn0 2H2O - 4e O2 + 4H+ эл. ток 2H2O + 2e H2 + 2OH- Суммарное уравнение ZnSO4 + 2H2O Zn + H2↑ + O2 ↑+ H2SO4. В результате электролиза ZnSO4 на катоде протекают два параллельных процесса и восстановление цинка и восстановление молекул воды, так как цинк в ряду напряжений металлов находится между Al и Н2. Электролиз раствора нитрата меди с инертными электродами: Cu( NО3)2®Cu2++ 2NO3- (  -) катодCu2+ , Н2ОСu2++ 2eCu2 -) катодCu2+ , Н2ОСu2++ 2eCu2  эл. ток (+) анод: 2NO3- , Н2О 2H2O + 4eO2 + 4H+ 1  эл. ток Сu2+ + 2H2O2Cu + O2 + 4H+ С  уммарное уравнение электролиза: 2Cu(NO3)2 + 2H2O 2Cu + O2 + 4HNO3 уммарное уравнение электролиза: 2Cu(NO3)2 + 2H2O 2Cu + O2 + 4HNO3Электролиз раствора нитрата меди с растворимым медным анодом электродами: Cu( NО3)2®Cu2++ 2NO3- (  -) катод:Cu2+ , Н2ОСu2++ 2eCu -) катод:Cu2+ , Н2ОСu2++ 2eCu (  эл. ток +) анод (Сu): Сu0- 2eCu2+ C  u(анод) C u(анод) C u(катод) u(катод) Электролиз в данном случае сводится к растворению металла анода и выделению его на катоде. Такую схему электролиза с растворимым анодом используют для получения металлов высокой чистоты (рис.2) и для покрытия одного металла слоем другого. 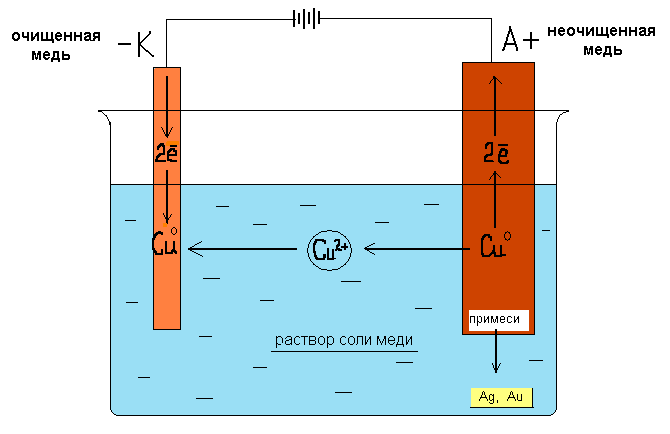 Рис. 2 Электролитическое рафинирование (очистка) меди. Электролиз солей карбоновых кислот (уравнение А. Кольбе) СН3СООNa →СН3СОО- + Na+ (  -) катод: Na+, Н2О 2H2O + 2e H2 + 2OH- -) катод: Na+, Н2О 2H2O + 2e H2 + 2OH-(  +) анод: 2СН3СОО- -2е СН3-СН3 + 2СО2 +) анод: 2СН3СОО- -2е СН3-СН3 + 2СО2 эл. ток 2СН3СОО- + 2H2O H2 + 2OH- + СН3-СН3 + 2СО2  эл. ток 2СН3СООNa + 2H2O H2 + 2NaOH + СН3-СН3 + 2СО2 Анион карбоновой кислоты окисляется на аноде, образуя СО2 и свободный алкильный радикал. Алкильные радикалы димеризуются на поверхности анода. На катоде восстанавливаются молекулы воды, выделяется водород, при анодном пространстве образуется гидроксид натрия. Количественные характеристики электролиза С количественной стороны процесс электролиза был впервые изучен в тридцатых годах Х1Х века английским физиком Фарадеем, который установил два закона электролиза: а) 1 закон Фарадея масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ, пропорциональна количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ; б) 2 закон Фарадея при пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах пропорциональна их химическим эквивалентам. Оба закона объединяются общей формулой: m = MэJt/F = MэJt/96500 = Q/96500, где m – масса окисленного или восстановленного вещества, г; Mэ – эквивалентная масса вещества (г/моль), Q = Jt – количество электричества, прошедшего через электролит, Кл; J – сила тока, А; t – время, сек; F = 96500 – постоянная Фарадея. Mэ = M/n , Где n – число отдаваемых или принимаемых электронов. m = M Jt/F n При практическом проведении электролиза расход тока превышает количество его, рассчитанное согласно закону Фарадея. Происходит это вследствие протекания тех или иных побочных процессов, поэтому в электрохимии используют понятие выход по току (h). Отношение массы полученного веществ(mпракт) к массе, теоретически вычисленной (mтеор), называется выходом по току: h =m практ ×100% /m теор Решим примеры заданий ЕГЭ по теме «Электролиз». В тестовом задании 22 не требуется написание схем электролиза, достаточно знать, какие процессы протекают на катоде и на аноде. 1. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Решение А) Натрий - активный металл, поэтому на катоде будут восстанавливаться молекулы воды, с выделением водорода. На аноде идёт окисления молекул воды, с выделением кислорода, так как SO42- - кислородсодержащий анион. Ответ – 4. Б) На катоде выделяется водород. На аноде – кислород, так как фторид анион не окисляется на аноде. Ответ – 4. В) На катоде выделяется водород. На аноде – хлор, так как Cl- - бескислородный анион который окисляется на аноде до свободного хлора. Ответ – 3. Г) На катоде выделяется водород. На аноде – кислород, ОН- - окисляется с выделением кислорода. Ответ – 4. Ответ 4434. 2. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Ответ: 6631 3. Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Литий – активный металл, поэтому его можно получить только электролизом расплава его соли. Ответ - 2 Б) Фтор не окисляется на аноде в растворе, поэтому его можно получить только из расплава его соли. Ответ - 2 В) Серебро неактивный металл, поэтому его можно получить электролизом раствора его соли. Ответ - 4. Г) Магний– активный металл, поэтому его можно получить только электролизом расплава его соли. Ответ - 6 Ответ: 2246 Знание темы «Электролиз» может понадобиться при выполнении заданий ЕГЭ по химии части С (задание 32). Здесь от учащихся уже требуется умение составлять уравнение процесса электролиза 4. При взаимодействии оксида алюминия с азотной кислотой образовалась соль, которую высушили и прокалили. Образовавшийся при прокаливании твердый остаток подвергли электролизу в расплавленном криолите. Полученный при электролизе металл нагрели с концентрированным раствором, содержащим нитрат калия и гидроксид калия, при этом выделился газ с резким запахом. Составьте уравнения четырех описанных реакций. Решение 1. При взаимодействии оксида алюминия с азотной кислотой образовалась соль: Al2O3 + 6HNO3 = = 2Al(NO3)3 + 3H2O. 2. Соль высушили и прокалили: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2. 3. Образовавшийся при прокаливании твердый остаток подвергли электролизу в расплавленном криолите. (-) катод: Al 3+ ; Al 3+ + 3e → Al0 4 (+) анод: : О2– ; 2О2– – 4e → О20 3 электролиз расплава 4Al3+ + 6О2– → 4Al + 3O2, 2  Al2O3 4Al + 3O2↑. Al2O3 4Al + 3O2↑.4. Полученный при электролизе металл нагрели с концентрированным раствором, содержащим нитрат калия и гидроксид калия, при этом выделился газ с резким запахом: 8Al + 3KNO3 + 5KOH + 18H2O = = 8K[Al(OH)4] + 3NH3. 5. Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, прореагировало с сероводородом. Образовавшееся твердое вещество сплавили с алюминием и продукт растворили в воде. Составьте уравнения четырех описанных реакций. Решение 1. Вещество получено на аноде при электролизе раствора йодида натрия с инертными электродами. NaI→ Nа+ + I- (-) катод Nа+, Н2О 2Н2О +2е → Н2 + 2ОН- 1 восстановление (+) анод: I-, H2O 2I- - 2е → I2 1 окисление эл. ток 2 I-+ 2Н2О → Н2↑ + 2OH- + I2↑. эл. ток 2 NaI + 2Н2О → Н2↑ + 2NaOH + I2↑. 2. Полученное вещество прореагировало с сероводородом: I2 + H2S = S + 2HI. 3. Образовавшееся твердое вещество сплавили с алюминием: 3S + 2Al = Al2S3. 4. Продукт растворили в воде: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S. Домашнее задание: учить составленный конспект. Учебник пар.21. Решить задачи на закон Фарадея: 1. Ток силой 6 А пропускали через водный раствор серной кислоты в течение 1,5 ч. Вычислите массу разложившейся воды и объем выделившихся газов (н.у.). (Ответ. 3,02 г H2O; 3,76 л Н2 и 1,88 л O2.) 2. Ток силой 2,5 А, проходя через раствор электролита, за 30 мин. выделяет из раствора 2,77 г металла. Определите металл. (Ответ. Олово.) Используемая литература: 1. О.С. Габриелян Химия. Материалы для подготовки к единому государственному экзамену вступительным экзаменам в вузы / О.С. Габриелян, И.Г. Остроумов. – М. Дрофа, 2008. – С. 429- 433. 2. И.В. Тригубчак «Содержание и методика преподавания темы «Электролиз» / Учебно-методический журнал для учителей химии и естествознания. №7-8, 2013 г. С.12. 3. https://scienceforyou.ru/trenirovochnye-varianty-dlja-podgotovki-k-egje |
