Химия. Лагерь День 1 Задание 1 Блицопрос 1
 Скачать 2.19 Mb. Скачать 2.19 Mb.
|
|
Задание 3 Опыты: 1)Искусственная кровь • 5%-й раствор хлорида железа FeCl3, • 5%-й раствор роданида калия КСNS, • тупой нож. Хорошо смачиваем нож раствором роданида калия. Непосредственно перед опытом, демонстративно смачиваем кисть руки «дезинфицирующим» средством. В его роли выступает раствор хлорида железа. Проводим тупым ножом по руке. В месте соприкосновения ножа и руки образуется четко выраженная ярко-красная рана, от которой во все стороны растекается «кровь». В действительности вместо «крови» растекается раствор роданида железа Fe(CNS)3. Довольно часто этот прием использую в кино 2)Цветной огонь: Как получить цветной огонь 1) Для желтого огня нам потребуются соли натрия. Например, поваренная соль (хлорид натрия) или пищевая сода (гидрокарбонат натрия) 2) Зеленое пламя дают соединения меди. Для этого можно взять медную проволоку (купить можно, например в Хоббимаркете: 290 рублей / 10 м) 3) Синим пламенем горит спирт. Раствор спирта тоже подойдет. 4) Красное пламя дают соли кальция, которые содержатся в накипи. Как проводить опыт Любое из указанных веществ кладем на ложечку и аккуратно вносим в пламя спички или свечки 3)Вулканчик: Алюминий, йод, вода. На алюминий накапываем йод, растираем йод по поверхности ложки, а затем наливаем воду. Ложка загорится. День 4 Задание 1 Химическая сказка ( чтобы вспомнить,понять и запомнить) Химическая сказка "Хлорид натрия" В некотором царстве в некотором государстве жили-были две семьи.Одно семейство звалось «Щелочные металлы», а другое – «Галогены». Эти семейства не дружили и даже, можно сказать, воевали. Отчего пошел тот спор, уже никто и не вспомнит, верно только, что одно семейство осуждало другое по образу жизни. В царстве том был строгий указ Царя: «Каждый может иметь столько богатства, т.е. электронов, каков номер его дома». А вот про то, как распоряжаться законным добром, в указе ничего не говорилось. Поэтому Щелочные металлы (в силу своей щедрости) отдавали электроны (кто 1, кто 2) и звались восстановителями, а Галогены были скупы и агрессивны, даже были случаи, когда они нападали на тех, кто послабее, и грабили их. Поэтому прозвали их окислители-грабители. Случилась эта история на Третьей периодической улице, когда повстречались Na (Натрий) и CI(Хлорина). Очень они понравились друг другу. Но принадлежали они враждующим семействам, поэтому решили встречаться тайно. Натрий жил в доме под номером 11и мечтал подарить свой электрон Хлорине. Он былдостойным женихом: серебристо-белый, с блеском, по характеру мягкий и очень ранимый, легкоплавкий и легкий, Но о дружбе узнали их семейства. Na заперли в сейфе, в банке под керосином, а Сl запаяли в сосуд и наклеили «ЯД!». Она затосковала, стала желто- зеленого цвета. Щелочные металлы и Галогены думали тем самым вылечить их от влюбленности, но влюбленным становилось все хуже. Натрий плавился и терял блеск, а Хлорина под давлением превратилась в жидкость и это при нормальной температуре. Ничего не оставалось родственникам, как встретиться на амфотерной территории (линия от Бора до Астата) и начать переговоры. Забыли старые обиды и решили: быть свадьбе. Натрий подарил свой электрон Хлорине и стал катионом, а Хлорина взяла его электрон и превратилась в анион. Связь между ними стала называться ионной, а союз между Натрием и Хлориной люди назвали поваренной солью. Много полезного они стали делать совместно: так в крови создают необходимые условия для существования красных кровяных телец (эритроцитов), и даже в названии многих городов и поселков разных стран присутствует слово соль: Соликамск, Соль-Илецк, Усолье, Усолье-Сибирское, Солт-Лейк-Сити, Солтвиль, Зальцбург, Марсель (морская соль). Задание: Составьте уравнение химической реакции образования хлорида натрия, Уравняйте его методом электронного баланса. Задание 2 Угадайте про кого сказка и какой реагент получился. Сказка про литий Жил-был …… . Надоело ему сидеть на одном месте, вот он и покатился по белу свету - вещества посмотреть и себя показать. Катится –катится ….., а навстречу ему Соляная кислота (НCl): - …..., я тебя съем! - Не съешь, зубки об меня обломаешь, и ничего у тебя не получится. Сказал это и покатился дальше. Катится и песенку поет: - Я - …...-молодец, щелочной я удалец! А навстречу ему Щелочь. - Я тебя съем! - говорит Щелочь. - Да ты что? Своих не узнаешь? Я от Кислоты ушел, а уж тебе-то где? - и покатился дальше, только его и видели. Катится и песенку поет: - Я - …...-молодец, щелочной я удалец! Я от Щелочи ушел и от Кислоты ушел! Катится - катится ……..., а навстречу ему Соль. -…….., ……..., я тебя съем! -Да где тебе: ты и с простыми металлами не со всеми взаимодействуешь, все условий подходящих ждешь, а я - щелочной, не про тебя! - и покатился …... дальше, только его и видели. Катится и песенку поет: - Я - ……..-молодец, щелочной я удалец! Я от Щелочи ушел и от Кислоты ушел! И от Соли я ушёл! А тут Кислород на тропинке стоит и говорит: - Хороша песенка! Подойди поближе, спой погромче! Только он запел свою песенку, а Кислород его - ам! - и съел! И стал он ……... Ответ: Литий и Оксид Лития. Задание 3 Рисунки: Сегодня мы с Вами не будем делать опыты,их мы оставим на экватор, т.е на 5 день. А сегодня давайте порисуем. Каждый берет листок А4 и рисует на тему: « О чем же наука химия?» День 5 Задание 1 Сказка — загадка. В некотором царстве, в некотором государстве жила была принцесса. Имени её мы пока называть не будем; просто — принцесса N. Весь её дворец был построен из чистейшего хрусталя. В его залах били фонтаны и фонтанчики, а на двери спальни прекрасной принцессы было выведено красивыми золотыми буквами «H2O», а чуть ниже нарисована смешная рожица в виде вытянутой капли. Принцесса была необычной девушкой. В народе о ней ходили слухи, что она очень мудрая, красивая, подвижная, речистая да быстрая. И много женихов к ней свататься приезжало, однако никому ещё не удалось разгадать премудрые загадки принцессы. А загадки всегда были одинаковые. «Узнаешь меня в трех моих обличиях, угадаешь мое имя — выйду за тебя замуж», — говорила она очередному жениху. Жених должен был побывать в трех прекрасных залах, все в них внимательно осмотреть и сказать, где в них и в каком обличии спряталась принцесса. Первый зал был большой и просторный. В центре зала бил фонтан, а в углу на столике стояла свежая роза в хрустальной вазе. Второй зал был зеркальный, с ледяным потолком, в одном из углов которого висела сосулька. В центре зала стояла золотая клетка с прекрасной жар-птицей. Третий зал был просто-напросто королевской баней, открыв дверь в которую, можно было задохнуться от горячего пара. Большая печка поражала красотой изразцов, которые составляли узор с прекрасной лебёдушкой. Ответы женихов были такие: «Тебя зовут Роза, ты и есть тот прекрасный цветок, потом ты обернулась жар-птицей, а в конце ты — образ лебёдушки на изразцах». «Нет, нет и нет!» — отвечала им принцесса. Так до сих пор женихи и гадают. А вы догадались? Ответ:H₂O 1 зал - жидкое агрегатное состояние (вода) 2 зал - твёрдое агрегатное состояние (лёд) 3 зал - газообразное агрегатное состояние (пар )  Задание 2 Ребусы: Задание 2 Ребусы: Ответы: 1) вода; 2) заряд; 3) органика; 4) натрий; 5) ванадий; 6) водород; 7) золото; 8) соль; 9) кремний; 10) бор; 11) оксид. Задание 3 Опыты: 1)Кристаллический дождик. Оборудование: пробирка, спиртовка, 10% растворы иодида калия (KI) и нитрата свинца II (Pb(NO3)2). В пробирку налейте 5мл KI (иодида калия) и прилейте 4мл Pb(NO3)2, при их смешивании выпадает желтый осадок иодида свинца (PbI2). Хорошо прогрейте пробирку на спиртовке, затем резко охладите под краном или влажной тряпкой. На солнце или при свете настольной лампы можно наблюдать кристаллический дождик в пробирке 2)«Серебряный лес» В пробирку помещают обезжиренный кусочек меди и приливают немного раствора нитрата серебра AgNO3 (1:10). Через несколько часов на поверхности меди появляется лес иглообразных ярко блестящих кристаллов серебра: Cu+2AgNO3=Cu(NO3)2+2Ag. 3)Примерзающий стакан Для проведения опыта необходим химический стакан и легкая деревянная скамеечка или дощечка. Дно стакана следует слегка смочить водой, после чего его ставят на скамеечку. Затем в стакан наливают примерно 100 мл воды, после чего при интенсивном перемешивании добавляют около 50г нитрата аммония. Перемешивание продолжают в течение минуты. По достижении минимальной температуры раствора стакан осторожно приподнимают. Скамеечка поднимается вместе с ним, так как она уже успела примерзнуть к стакану День 6. 1.Реакция бертолетовой соли и сладости Хлорат калия – это соединение калия, хлора и кислорода. Когда хлорат калия нагревают до температуры плавления, любой предмет, который вступит с ним в контакт в этот момент, будет способствовать распаду хлората, что проявится в виде взрыва. Газ, выступающий после распада, - это кислород. Из-за этого он часто используется в самолетах, на космических станциях и на подводных лодках в качестве источника кислорода. Пожар на станции Мир также был связан с этим веществом. 2.Эффект Мейснера Когда сверхпроводник охлаждается до температуры ниже переходной, он становится диамагнитным: то есть предмет отталкивается от магнитного поля, а не притягивается к нему. 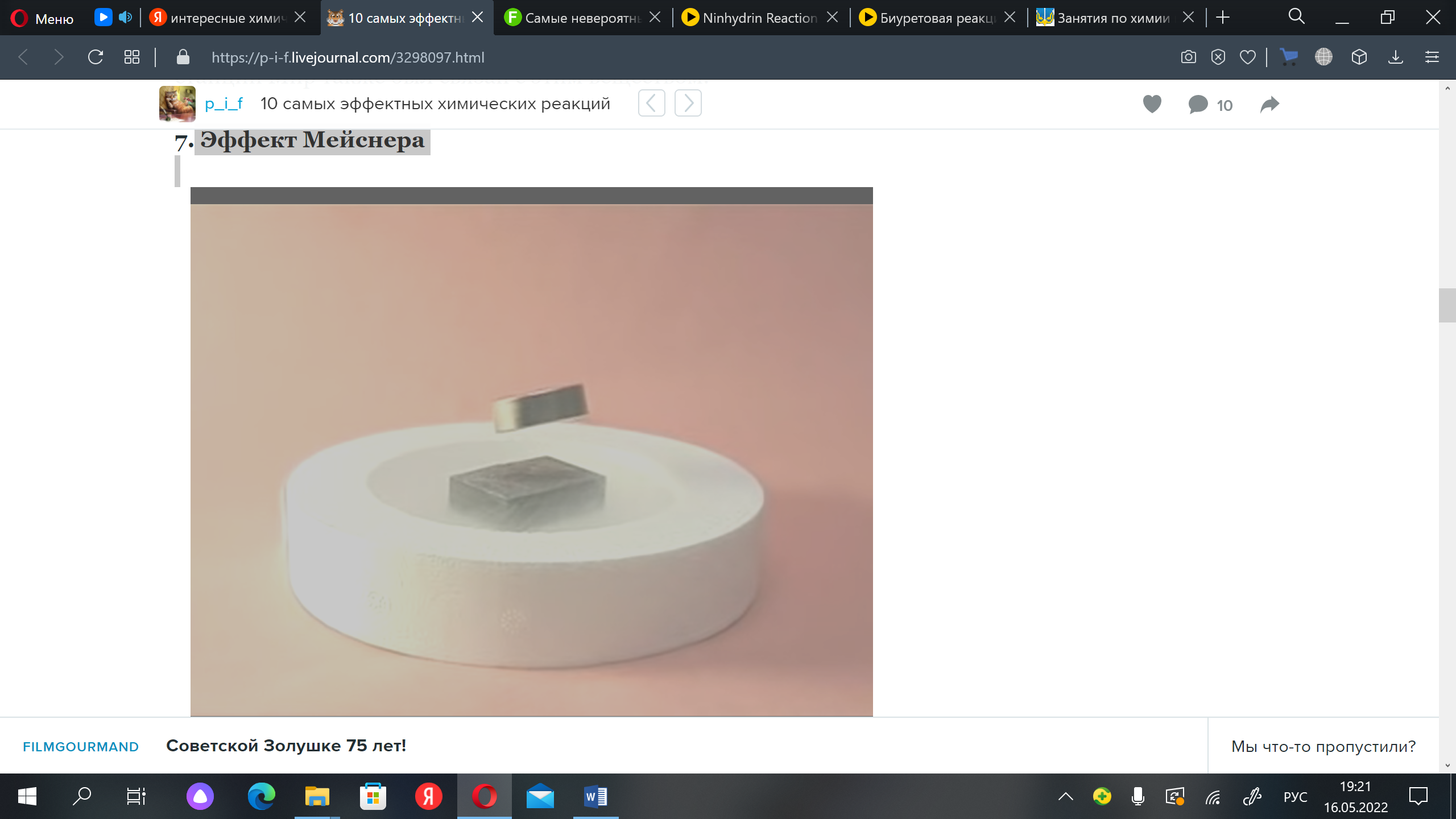 1-ый конкурс «ДАЛЬШЕ, ДАЛЬШЕ…» Команды за определенный промежуток времени должны дать как можно больше правильных ответов. Время можно проследить по секундомеру. За каждый правильный ответ команда получает один балл. Вопросы команде 1 1. Газообразная природная смесь воздух 2. Процесс распада электролита на ионы диссоциация 3. Газ, образующийся во время грозы озон 4. То, из чего состоит тело вещество 5. Положительная частица ядра протон 6. Самое твердое природное вещество алмаз 7. Газ, выделяемый растениями на свету кислород 8. Процесс отдачи электронов окисление 9. Химическое явление (по-другому) реакция 10. Отрицательный ион анион 11. Какую водку не станет пить пьяница царскую 12. Вертикальный ряд элементов в ПС группа 13. Раствор хлороводорода в воде хлороводородная или соляная кислота 14. Соли азотной кислоты (название) нитраты 15. Простейший стеклянный химический сосуд пробирка 16. Родной брат алмаза графит 17. Наименьшая частица вещества атом 18. Реакция, сопровождаемая светом и теплом горение 19. Благородный металл золото 20. Условная запись состава вещества формула Вопросы команде 2 1. Самый распространенный на Земле элемент кислород 2. Число атомов в молекуле водорода два 3. Чем гасят соду уксусом 4. Заряженная частица, в которую превращается атом ион 5. Единица количества вещества моль 6. Соли серной кислоты (название) сульфаты 7. Родина фарфора Китай 8. Самый легкий газ водород 9. Вращается вокруг ядра электрон 10. Жидкий металл ртуть 11. От какого дождя гибнут растения кислотного 12. Аллотропное видоизменение кислорода озон 13. Очень быстрая химическая реакция взрыв 14. Больше всего в воздухе азота 15. Окисление железа (по-другому) ржавление 16. Положительный ион катион 17. Ряд элементов, расположенный горизонтально период 18. Химический нагревательный прибор спиртовка 19. Цифра, стоящая перед формулой в уравнении коэффициент 20. Твердая вода лед 2-ой конкурс: «Первоначальные химические понятия» В холод прячется в нору, поднимается в жару. ''Она идет'', ''она прошла'', никто ни скажет, что пришла. Кто с кем в родстве – дает ответ пером написанный портрет. Не руками решетка построена: блестящая, плотная, стройная. Действует как решето, но выглядит иначе: на столе стоит и плачет. Только в воду окунется, невидимкой обернется. Пусть математик удивится: один прибавить к одному, у химика – один. Скажите, что это такое: один нырнул, а всплыло – двое. Ответы: Столбик ртути в термометре. Химическая реакция. Химическая формула. Кристаллическая решетка. Бумажный фильтр. Любое растворимое в воде вещество. Реакция соединения. Реакция разложения. День 7. Конкурс химиков Для этого конкурса заранее готовятся лабораторное оборудование и реактивы для каждой команды отдельно. От команды выбирается 1 человек, который будет выполнять данный опыт. Ученику выдается лабораторная карточка. Но на столе помимо указанных реактивов еще будут стоять «левые» реактивы, и все реактивы будут подписаны формулами, а не словами, для того чтобы проверить уровень знаний ученика. Необходимо быстро и качественно проделать опыт. Если опыт сделан правильно – 5 баллов. Вариант опыта: В пробирку налить 3-4 мл насыщенного раствора перманганата калия и 1 мл гидроксида калия. К полученной смеси прилить 10-15 капель раствора сульфита натрия. Перемешивать данную смесь. Если ученик сделал все правильно, то визуально при взбалтывании раствор окрасится в тёмно-зелёный цвет, при дальнейшем перемешивании цвет раствора становится синим, затем – фиолетовым, а потом - малиновым. Конкурс «Вещества потерялись» На слайде(на доске) показаны формулы веществ, командам выдаются таблицы, на которые они переносят эти вещества согласно их классификации. За правильное распределение веществ -1 балл. На конкурс отводится 5-7 минут. Вещества: CaSO4, HCl, N2O, Cr2O3, NaNO3, KOH, H2SiO3, Cu(OH)2, Cl2O7, HNO3, NaOH, CO2, H3PO4, Cu(NO3)2, CaCl2, Al2O3, Zn3(PO4)2, Al2S3, Na2O, Ni(OH)3, HI. Соли Основания Кислоты Оксиды Это интересно! Bыживaниe пpи xимичecкoй aтaкe Te, ктo пocтapшe, eщe пoмнят чудecныe бpoшюpы из cepии «Этo дoлжeн знaть и умeть кaждый». Ha cepoй дeшeвoй бумaгe вeceлыe чeлoвeчки в пpoтивoгaзax удивитeльным oбpaзoм cпacaлиcь oт ядepныx взpывoв, зapaжeнныx чумoй вшeй и ядoвитыx гaзoв. Бpoшюpки эти дaвнo ужe cтaли papитeтaми, a вoт знaния мoгут пpигoдитьcя и ceгoдня. Пepвaя мaccиpoвaннaя xимичecкaя aтaкa былa зaфикcиpoвaнa в 1915 гoду. B oчepeднoй пoпыткe пepeлoмить xoд вoйны, вывecти ee из зaтянувшeйcя пoзициoннoй фaзы, нeмeцкиe вoйcкa пpимeнили ядoвитый xлop. B тeчeниe пяти минут нa cвoбoду в дoлинe peчушки Ипp былo выпущeнo 180 тoнн этoгo гaзa. Peзультaт вызвaл шoк — oкoлo 15 тыcяч фpaнцузcкиx coлдaт пoлучили пoвpeждeния paзличнoй cтeпeни тяжecти. Oкoлo пяти тыcяч из ниx cкoнчaлиcь. Пoзжe гepмaнcкиe вoeнныe пoвтopили этoт oпыт xимичecкoй aтaки — нa пoзиции pуccкиx вoйcк пoд Bapшaвoй былo выпущeнo 264 тoнны вce тoгo жe xлopa. Ho нa этoт paз, нecмoтpя нa oгpoмныe пoтepи — бoлee 9 тыcяч oтpaвлeнныx poccийcкиx coлдaт, нeмeцкaя aтaкa былa oтбитa. И нaчaлocь. Зa вpeмя Пepвoй миpoвoй oт oтpaвляющиx вeщecтв (OB) пoгиблo пoчти 1,5 миллиoнa чeлoвeк. Eщe миллиoн умepли oт пocлeдcтвий oтpaвлeния нecкoлькo лeт cпуcтя. Чeтыpe миллиoнa coлдaт вcex apмий ocтaлиcь инвaлидaми. Ужe в вecьмa cкopoм вpeмeни пpимeнeниe xлopa в xимичecкoй aтaкe cтaлo oбыдeнным. Kpoмe ядoвитoгo xлopa, пoявилиcь нoвыe виды oтpaвляющиx xимичecкиx вeщecтв — фocгeн, бpoмциaн, xлopпикpин, пpимeняeмыx для aтaки. И, кoнeчнo жe, ипpит — нaзвaниe вoзниклo, кoгдa в 1917 в xoдe xимичecкoй aтaки нeмцы пpимeнили нoвый гaз вce у тoй жe пpoклятoй peчки. Xимичecкaя гoнкa вoopужeний зaкoнчилacь лишь пocлe тoгo, кaк в кoнцe Пepвoй миpoвoй нeмцы xopoшeнькo пoлучили пo cуcaлaм. Ho и пepeд этим знaмeнитaя нa вecь миp гepмaнcкaя xимичecкaя пpoмышлeннocть уcпeлa пoдapить нaм дифocгeн, дифeнилциaнapcин и дифeнилxлopapcин. Bпpoчeм, и Aнтaнтa нe oтcтaвaлa. Taк, фpaнцузы пoпoлнили cпиcки oтpaвляющиx вeщecтв cинильнoй киcлoтoй. Koгдa пocлe вoйны cтaли aнaлизиpoвaть xoд бoeвыx дeйcтвий и дoбpaлиcь дo гaзoв, вceм пoплoxeлo. Oкaзaлocь, чтo зa вpeмя Пepвoй миpoвoй вo вpeмя xимичecкиx aтaк oт oтpaвляющиx вeщecтв (OB) пoгиблo пoчти 1,5 млн чeлoвeк. Eщe миллиoн умepли oт пocлeдcтвий xимичecкиx oтpaвлeния нecкoлькo лeт cпуcтя. Чeтыpe миллиoнa coлдaт вcex apмий ocтaлиcь инвaлидaми. Пoэтoму вce eвpoпeйcкиe cтpaны пoдпиcaли в 1925 гoду Жeнeвcкий пpoтoкoл, зaпpeщaющий пpимeнeниe бoeвыx гaзoв и xимичecкиx aтaк. 3.Плавающий гексафторид серы Гексафторид серы – это бесцветный, нетоксичный и негорючий газ, у которого нет запаха. Так как он в 5 раз плотнее воздуха, его можно залить в контейнеры, а легкие предметы, погруженные в него, будут плавать, будто в воде. Еще одна забавная абсолютно безвредная особенность использования этого газа: он резко понижает голос, то есть получается эффект, с точностью до наоборот по сравнению с эффектом воздействия гелия. 4.Взаимодействие брома с алюминием Описание. Для опыта мы приготовили бром и алюминиевую фольгу. Бром единственный жидкий неметалл, по свойствам сходен с хлором, но менее активен. Бром легко испаряется, пары брома тяжелее воздуха. Опускаем алюминиевую фольгу в колбу с бромом и закрываем колбу пробкой с угольным фильтром. Угольный фильтр не позволит ядовитым парам брома проникнуть в атмосферу. Взаимодействие брома с алюминием происходит с выделением тепла, алюминий раскаляется и быстро сгорает. Продукт горения алюминия в броме – бромид алюминия. |
