Химия. Лагерь День 1 Задание 1 Блицопрос 1
 Скачать 2.19 Mb. Скачать 2.19 Mb.
|
|
День 8. Конкурс № 4. «Агент 007» Ведущий: Вызываются по одному участнику от каждой команды. Им выдаются карточки. За 1 минуту участник команды должен подсчитать, сколько раз повторно записаны знаки тех химических элементов, которые указаны в задании. Побеждает тот участник, который правильно и быстрее остальных справился с заданием. 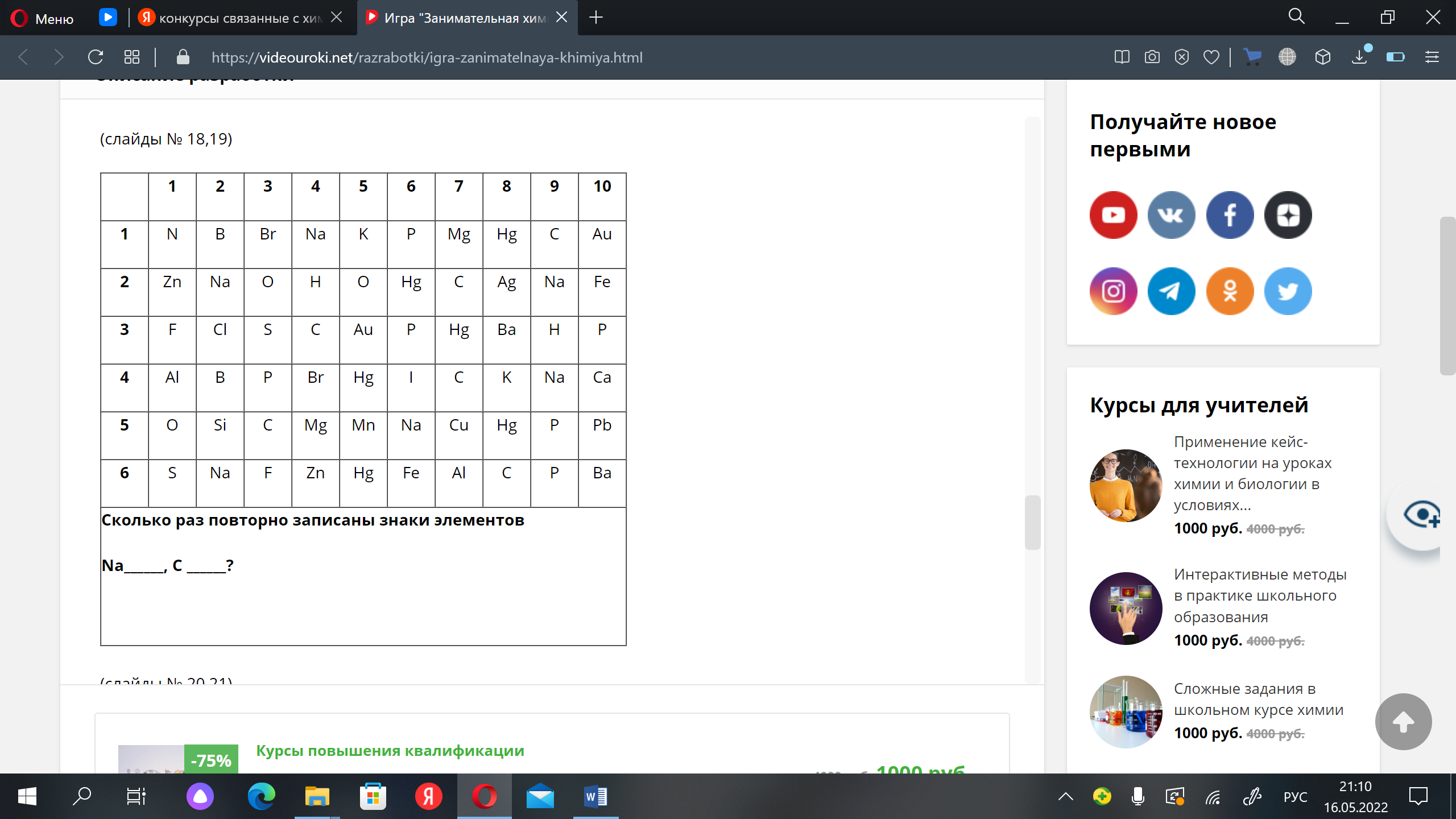 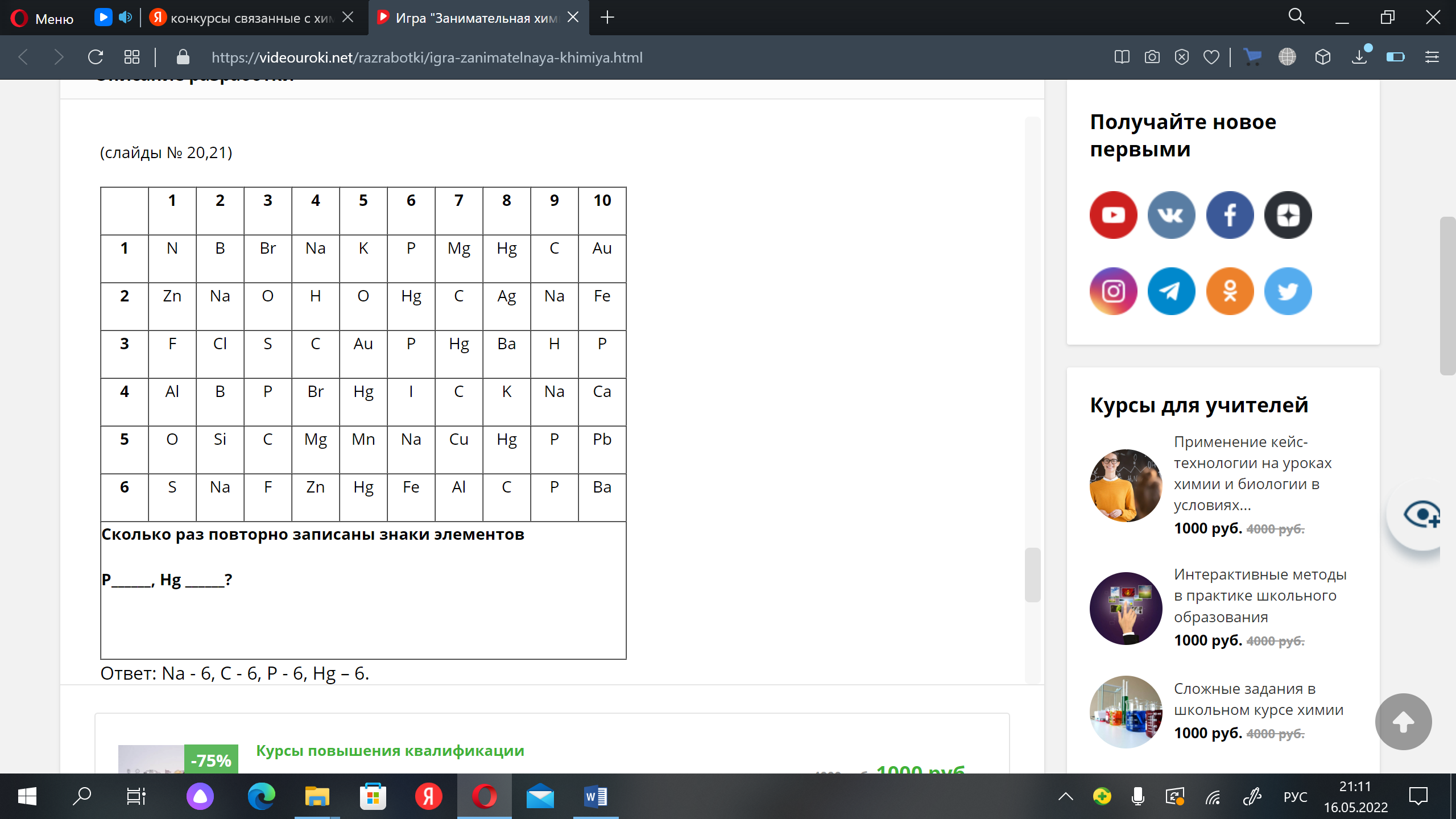 5.Взаимодействие глицерина с кристаллическим перманганатом калия К растертому в тонкий порошок перманганату калия прильем немного глицерина. Через некоторое время над смесью появляется дымок, а затем происходит загорание глицерина. Под действием сильных окислителей глицерин сгорает с образованием углекислого газа и воды. 2 С3Н8О3 + 7 О2 = 6 СО2 + 8Н2О Оборудование: огнезащитная прокладка, фильтровальная бумага, шпатель. Техника безопасности. Соблюдать правила пожарной безопасности. Не допускать попадания перманганата калия на одежду и кожу. Конкурс «Кто больше?» На доске закреплены карточки с различными знаками. Командам, необходимо используя эти знаки, составить как можно больше химических формул и дать названия полученным веществам (формулы не должны повторяться). За правильную формулу вещества и название –2 балла. На выполнение задания 5–7 минут. Варианты карточек: K SO3 Zn OH Cl Mg H Ca S CO3 I PO4 6. Молния в цилиндре Красивый химический опыт в результате, которого получается мини-гроза в пробирке с громом и молниями. Для проведения эксперимента понадобятся следующие приборы и вещества: металлический штатив, стеклянный цилиндр или пробирка, стакан с водой, тонкая палочка из стекла, пипетка, концентрированная серная кислота, денатурированный спирт, марганцовокислый калий. Сначала необходимо закрепить пробирку в металлическом штативе. Далее, под нее устанавливаем стакан с водой так, чтобы жидкость прикрыла 2/3 цилиндра. Следом в пробирку необходимо вставить тонкую палочку из стекла так, чтобы она концом прикасалась ко дну, при этом, не затрагивая стенки пробирки. Далее, выливаем 4 мл серной кислоты в пробирку. Делать это необходимо аккуратно, выливая ее по палочке, чтобы кислота не прикоснулась к стенке сосуда. Если это произойдет, то опыт не удастся. Затем набираем 10 мл спирта в пипетку и не торопясь выливаем его в пробирку. Получится два слоя, которые будет отчетливо видно, произойдет это из-за разного удельного веса веществ. И, наконец, делаем грозу – добавляем в пробирку кристалл марганцовокислого калия, который задержится на границе двух веществ и начнет «стрелять», образуя искры и характерный звук, это и будет напоминать грозу. День 9. Может ли гореть вода? Вода состоит из атомов молекул кислорода и водорода. Поскольку всякое соединение с кислородом свидетельствует о способности вещества к горению, вода не является исключением. Таким образом, вода представляет собой удивительного свойства соединение, уже «сгоревшее». Встречалось ли вам когда-либо такое явление, как горящая вода? Оказывается, если создать условия высокой температуры, достигающей нескольких тысяч градусов, вода, попадая в эпицентр огня, начинает распадаться на молекулы кислорода и водорода, участвующих в горении. Именно это учитывается пожарными, когда они принимаются за тушение горящего пластика, топлива, которые нагреваются до высочайшей температуры. В таких случаях пожарные прибегают к тушению огня сильной пеной. Известно также, что в устройстве самолетов, в двигателях турбин предусматриваются специальные распылители, которые впрыскивают в очаг локального возгорания распыленную воду. Так создается форсажный режим, за счет которого увеличивается сгорание в камере, а также возрастают обороты и мощность турбин. Такие меры считаются временными, они применяются лишь в период разгона и взлета самолета. Таким образом, вода имеет свойство не только гасить огонь, но и гореть при некоторых условиях. 7. «Золотой» дождь — химический опыт Золотой дождь. Разумеется, что для проведения химического опыта «золотой дождь» нам не понадобится золото. Ну и само собой мы не будем использовать дождь. Свое название реакция получила за эффектную игру света c выпадающим осадком йодида свинца (II), который кристаллизуется в растворе виде золотых хлопьев. Данный опыт косвенно зависит от температуры. Что интересно, осадок йодида свинца (II) обозначен в таблице растворимости, как нерастворимое в воде вещество. Но на самом деле,при повышении температуры растет и его растворимость. Думаю, не стоит объяснять, что данная реакция используется в химии не для того, чтобы получить красивый осадок. Она является качественной реакцией на катионы свинца Pb2+. Есть много способов получить «золотой» дождь», но все они основываются на реакции взаимного обмена. Катионы металла одной соли обмениваются с другими, в зависимости от их активности. Мы рассмотрим взаимодействие нитрата свинца II и йодида калия. Для опыта необходимо: Соль свинца (в нашем случаи нитрат, Pb(NO3)2) Йодид калия (KI) Уксусная кислота Вода Уксусная кислота нам понадобиться, чтобы предотвратить процесс гидролиза, который происходит при смешивании нитрата свинца (II) с водой. Ниже приведена реакций этого неблагоприятного процесса: Pb(NO3)2 + H2O = PbOH(NO3) + HNO3 Готовим два раствора, с эквивалентными количествами нитрата и йодида. Для этого, берем два стакана, и в одном растворяем в воде нитрат с небольшим добавлением уксусной кислоты. В другом же стакане просто растворяем йодид калия. Важно учитывать, что вода должна быть очень горячей! После этого смешиваем два приготовленных раствора. Так как вода у нас горячая, образующий осадок иодид свинца II может раствориться в воде. Pb(NO3)2 + 2KI => 2KNO3 + PbI2 По мере остывания раствора начнут выпадать кристаллики «золотого дождя», которые будут плавать в воде. К тому же, чем медленнее охлаждение, тем больше и красивее будут кристаллы. Золотой дождь P.S. главное, чтобы было хорошее освещение, т.к. в противном случае опыт будет менее эффектным. Запах книг. Все мы прекрасно знаем ни с чем не сравнимый запах книг только что вышедших из печатного станка. Её свежий запах радикально отличается от запаха книг из старой дедушкиной библиотеки. Но и старые и новые книги пахнут очень приятно. Попробуем описать формулу аромата книг с помощью химии. И у старых и у новых книг есть свои характерные запахи, которые обуславливаются сотнями летучих органических веществ. Некоторые из этих веществ (в основном характерные для старых книг) образуются в результате процессов разрушения бумаги, некоторые — вещества, применяющиеся при обработке бумаги, а также типографской краски и клея. Запах старых книг При старении книг медленное разрушение целлюлозы (а иногда и лигнина), входящих в состав бумаги, приводит к образованию летучих органических веществ. На запах старой книги влияет её возраст — за это время разрушение бумаги зашло очень далеко. К тому же, чем старше книга, тем больше в ней было лигнина. Основные вещества определяющие запах старых книг: толуол — сладковатый запах, ванилин — запах ванили, 2-этилгексанол — цветочный запах, этилбензол — сладковатый запах, бензальдегид — миндальный запах, фурфураль — миндальный запах. Запах новых книг Запах разных новых книг очень сильно отличается друг от друга. На него оказывает влияние состав типографской краски и клеевых композиций, а также способ отбелки бумаги. Наиболее распространённым типографским клеем сейчас является сополимер этилена и винилацетата. Для отбелки бумаги используется много способов — хлорный, перекисный, озоновый, и вещества для отбелки могут разлагать целлюлозу с образованием характерных летучих веществ. 8.Египетская ночь Реактивы и оборудование: крахмал; иодид калия; тиосульфат натрия; перекись водорода; кислота (серная, уксусная); вода; два химических стакана; мензурка; стеклянная палочка для перемешивания. Пошаговая инструкция Смешайте примерно 0.2 г крахмала и немного холодной воды. Добавьте горячую воду для растворения крахмала. Разбавьте полученный раствор примерно до 800 мл. Добавьте 50 г иодида калия и 10 г тиосульфата натрия. «Раствор А» готов! «Раствор Б» — это смесь 30%-ной перекиси водорода и слегка подкисленной воды. Этот раствор может иметь любую концентрацию: время реакции зависит от концентрации перекиси водорода. Быстро смешайте растворы «А» и «Б» — полученный раствор резко станет темно-синим! Пояснение процесса В данном эксперименте протекают три основные реакции. Сначала происходит медленное взаимодействие перекиси водорода и ионов йода в присутствии ионов Н⁺. В результате образуется молекулярный йод. Затем йод взаимодействует с тиосульфатом натрия. Это приводит к образованию трииодид иона, который расходуется быстрее, чем образуется. Когда тиосульфат заканчивается, эта реакция останавливается и полученный трииодид-ион образует темно-синий комплекс с крахмалом. Повышение концентрации Н⁺ приводит к сокращению задержки изменения цвета. Увеличение концентрации тиосульфата оказывает обратный эффект. 9.Химические рифы Создайте риф в чашке Петри! Пошаговая инструкция Реакция протекает в водном растворе. 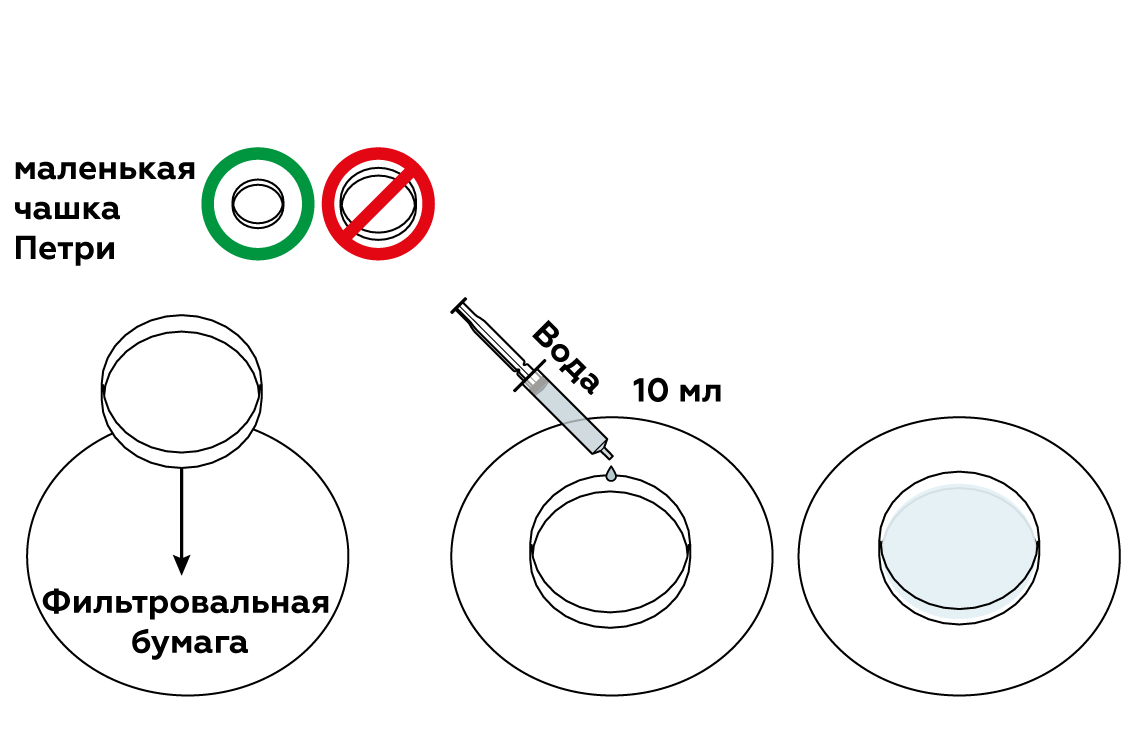 Понадобится совсем немного сульфата меди и гексацианоферрата калия. 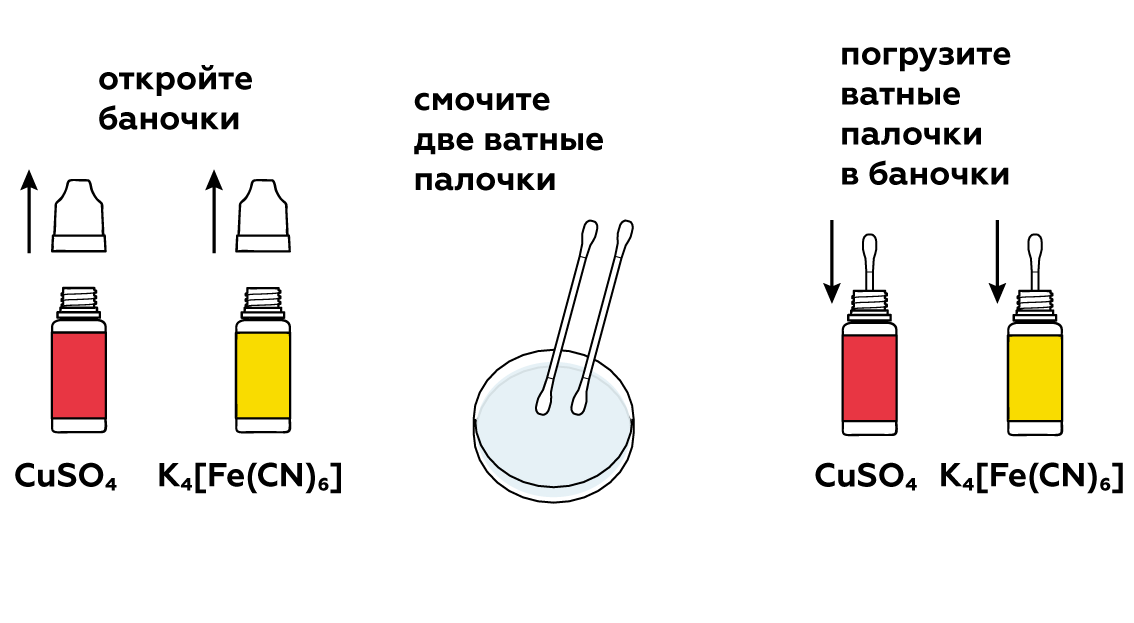 Нужно, чтобы кристаллы растворились в воде. 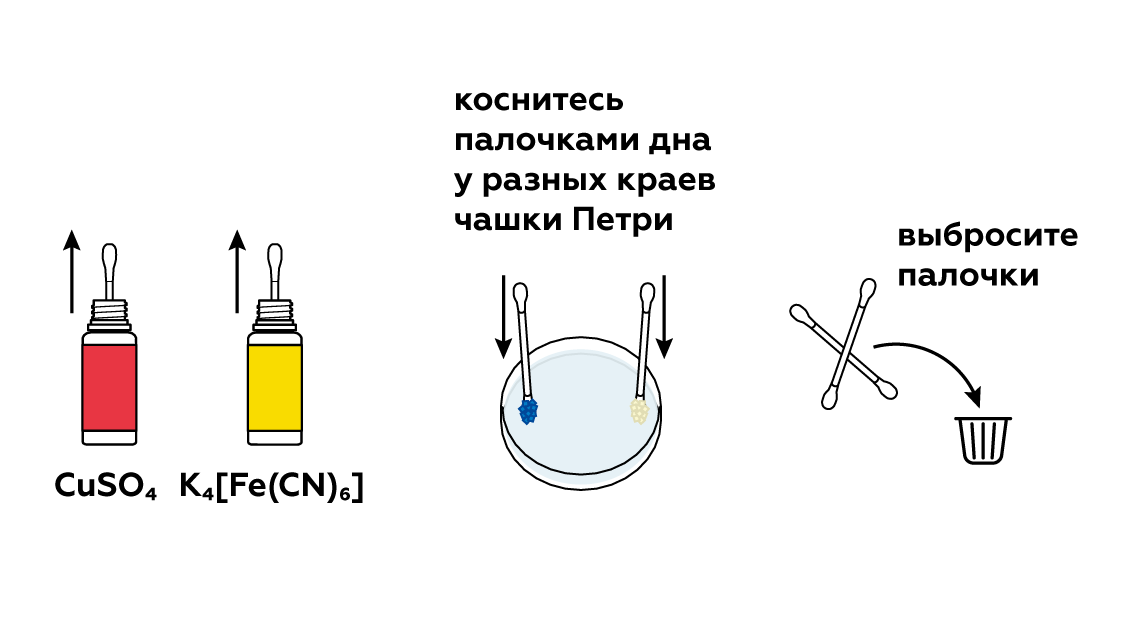 Встретившись, растворенные вещества вступят в реакцию, и между ними образуется расплывчатый коричневый «риф». 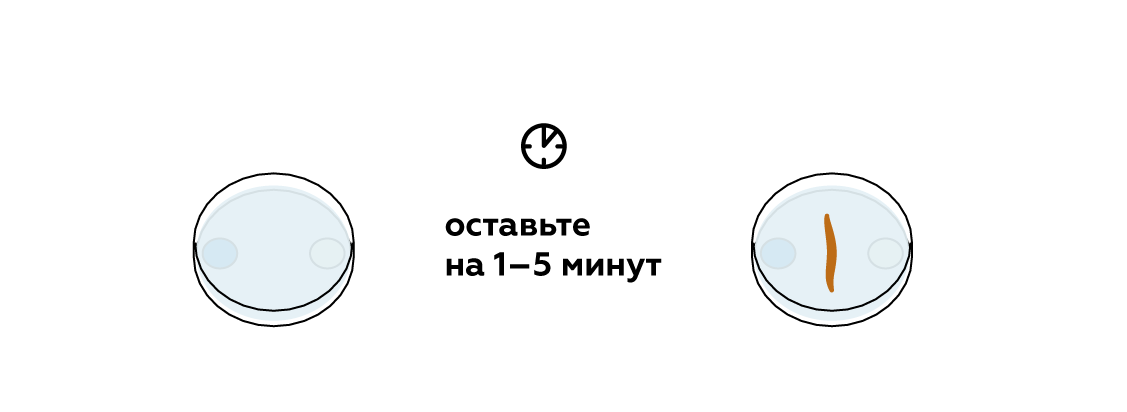 Чтобы получить разные «рифы», поэкспериментируйте с различными сочетаниями CuSO4, K4[Fe(CN)6], Na2CO3 и NH4Fe(SO4)2. Можно даже создать четыре разных «рифа» сразу! Возьмите для этого большую чашку Петри и не забывайте мыть ее после каждой попытки. Утилизация Твердые отходы эксперимента утилизируйте вместе с бытовым мусором. Растворы слейте в раковину и затем тщательно промойте ее водой. Что произошло Глядя на химическую формулу молекулы, например, CO2 , несложно догадаться из чего она состоит — одного атома углерода С и двух атомов кислорода О . Значит ли это, что в баночке CuSO4 много молекул CuSO4? А вот и нет! Молекулы CuSO4 не существует — это соединение состоит из двух отдельных частиц: ионов Cu2+ и SO4(2−) Подобные соединения называют ионными. В твердом состоянии все их ионы уложены вместе, но как только соединение попадает в воду, ионы уходят в «свободное плавание». Некоторые комбинации ионов (например, CuSO4) легко распадаются (растворяются) в воде, а другие разделить не так-то просто. Кристаллы CuSO4 и K4[Fe(CN)6] в воде растворяются и диссоциируют на ионы. Но когда ионы Cu2+ встречают ионы [Fe(CN)6]4− в чашке Петри, они соединяются друг с другом и образуют коричневый Cu2[Fe(CN)6] , частицы которого растворяются очень неохотно. Именно из этих частиц и сделан наш чудесный «риф». Попробуйте сочетать различные соединения, чтобы узнать, какие из них подходят для создания «рифов». Особенно красивы голубые «рифы» из Fe4[Fe(CN)6] ! Как образуются рифы? Рифы появляются благодаря образованию нерастворимого вещества Cu2[Fe(CN)6] в результате реакции между сульфатом меди(II) CuSO4 и гексацианоферратом(II) калия K4[Fe(CN)6]: K4[Fe(CN)6] + 2CuSO4 → Cu2[Fe(CN)6]↓ + 2K2SO4 Только первоначально они растворяются в воде и распадаются на ионы: CuSO4 → Cu2+ + SO42− K4[Fe(CN)6] → [Fe(CN)6]4− +4K+ Такая реакция называется реакцией ионного обмена. Когда ионы с противоположными зарядами встречаются, образуется коричневый осадок Cu2[Fe(CN)6], который вы и наблюдаете в середине чашки Петри. Развитие эксперимента Попробуйте по-разному сочетать реагенты: сульфат меди CuSO4, гексацианоферрат(II) калия K4[Fe(CN)6], карбонат натрия Na2CO3 и сульфат железа(III)-аммония NH4Fe(SO4)2 (железоаммонийные квасцы). Еще вы можете провести этот опыт в большой чашке Петри и попробовать вырастить сразу четыре разных рифа! День 10.  1. Соединения, состоящие из ионов металла и кислотного остатка. 2. Кислоты, содержащие в своем составе только один катион водорода. 3. Соединения, состоящие из двух элементов, один из которых кислород, в степени окисления -2. 4. Соли, содержащие в своем составе не замещенные на металл ионы водорода. 5. Кислоты, в состав которых входит кислород. 6. Соли, содержащие в своем составе помимо металла и кислотного остатка так же гидроксогруппы (OH). 7. Соединения, содержащие один или несколько атомов водорода и кислотный остаток. 8. Оксиды, которые при взаимодействии с водой образуют соли. 9. Сложные соединения, состоящие из катиона металла и одной или нескольких гидроксогрупп (ОН) 10. Группа солей, состоящих только из катиона металла и кислотного остатка (не содержащих иона водорода и гидроксогрупп). 11. Растворимые в воде основания. ОТВЕТЫ. 1. соли 2. одноосновные 3. оксиды 4. кислые 5. кислородные 6. основные 7. кислоты 8. кислотные 9. основания 10. средние 11. щелочи 10. Химические опыты с селитрой: огненная надпись Эффектный химический опыт можно провести, имея калийную селитру. Напомню, что селитры - это сложные вещества - соли азотной кислоты. В данном случае нам понадобится калиевая селитра. Её химическая формула KNO3. На листе бумаги нарисуйте контур, рисунок (для большего эффекта пусть линии не пересекаются!). Приготовьте концентрированный раствор нитрата калия. Для сведений: в 15 мл горячей воды растворяется 20 г KNO3. Затем с помощью кисти пропитываем бумагу по нарисованному контуру, при этом не оставляем пропусков и промежутков. дадим бумаге высохнуть. Теперь надо коснуться горящей лучинкой какой-нибудь точки на контуре. Тотчас же появится "искра", которая будет медленно двигаться по контуру рисунка, пока не замкнёт его полностью. Вот что происходит: Калиевая селитра разлагается по уравнению: 2KNO3→ 2 KNO2 +O2. Здесь KNO2 +O2 - соль азотистой кислоты. От выделяющегося кислорода бумага обугливается и сгорает. Для большего эффекта опыт можно проводить в тёмном помещении. 11. Химические опыты: свечение растворов Химические реакциии со свечением! Реакция свечения раствора Как отмечено выше - свечение растворов - признак химической реакции. Проведём ещё один эффектный опыт, при котором у нас раствор будет светиться. Для реакции нам необходим раствор люминол, раствор перекиси водорода H2O2 и кристаллики красная кровяной кровяной соли K3[Fe(CN)6]. Люминол - сложное органическое вещество, формула которого C8H7N3O2. Люминол хорошо растворяется в некоторых органических растворителях, при этом в воде не растворяется. Свечение происходит при реакции люминола с некоторыми окислителями в щелочной среде. Итак, начнём: прилейте раствор перекиси водорода к люминолу, затем к полученному раствору добавьте горсть кристалликов красной кровяной соли. Для большего эффекта попробуйте проводить опыт в темном помещении! Как только кристаллики кровяной красной соли коснуться раствора, сразу будет заметно холодное голубое свечение, что свидетельствует о течении реакции. Свечение при химической реакции называется хемилюминисценцией Ещё один химический опыт со светящимися растворами: Для него нам потребуется: гидрохинон (раньше использовался в фототехнике), карбонат калия K2CO3 (ещё известен под названием "поташ"), аптечный раствор формалина (формальдегида) и перекись водорода. Растворите 1 гр гидрохинона и 5 гр карбоната калия K2CO3 в 40 мл аптечного формалина (водный раствор формальдегида). Перелейте эту реакционную смесь в большую колбу или бутылку емкостью не менее литра. В небольшом сосуде приготовьте 15 мл концентрированного раствора перекиси водорода. Можно использовать таблетки гидроперита - соединение перекиси водорода с мочевиной (мочевина не помешает опыту). Для большего эффекта зайдите в темную комнату, когда глаза привыкнут к темноте, слейте раствор пероксида водорода в большой сосуд с гидрохиноном. Смесь начнет вспениваться (поэтому и надо взять большой сосуд) и появится отчетливое оранжевое свечение! Химические реакции, при которых появляется свечение происходят не только при окислении. Иногда свечение возникает при кристаллизации. Самый простой способ его наблюдения - поваренная соль. Растворите поваренную соль в воде, причем соли возьмите столько, чтобы на дне стакана оставались нерастворившиеся кристаллы. Полученный насыщенный раствор перелейте в другой стакан и по каплям добавляйте к этому раствору концентрированную соляную кислоту. Соль начнет кристаллизоваться, при этом в растворе будут проскальзывать искры. Наиболее красиво, если опыт ставить в темноте! Конкурс 3. Химия + математика Капитанам команд выдается задание. На выполнение задания 5 минут. Максимальное количество баллов – 3. Командам необходимо составить формулы по названию, рассчитать молекулярную массу вещества и массовую долю химического элемента в веществе. Задание 1. Рассчитайте относительную молекулярную массу нитрата бария. Определите массовую долю азота в этом соединении. Задание 2. Рассчитайте относительную молекулярную массу сульфата калия. Определите массовую долю серы в этом соединении. Задание 3. Рассчитайте относительную молекулярную массу хлорида железа (III). Определите массовую долю железа в этом соединении. Задание 4. Рассчитайте относительную молекулярную массу фосфорной кислоты. Определите массовую долю водорода в этом соединении. Задание 5. Рассчитайте относительную молекулярную массу карбоната натрия. Определите массовую долю натрия в этом соединении. Задание 6. Рассчитайте относительную молекулярную массу фосфата лития. Определите массовую долю кислорода в этом соединении. |
