РАДИОФАРМ ЛЕКЦИЯ на коллокв. Лекарственные препараты, содержащие радиоактивные
 Скачать 404.5 Kb. Скачать 404.5 Kb.
|
|
Лекарственные формы Наибольшее распространение получили следующие готовые фармацевтические препараты: «Изотонический раствор NaI-131», «Гиппуран-I-131», «Йодокапс». Среди наборов для приготовления радиофармацевтических препаратов на основе короткоживущего радионуклида технеция 99Тс перечислим лишь некоторые: «Макротех», «Пертехнетат», «Технефор», «Технемаг», «Пирфотех». Фармакопейные радиофармацевтические препараты (ГФ Х) Приведем перечень некоторых радиофармацевтических препаратов, для которых представлены фармакопейные статьи в Европейской Фармакопее: «Йодированный [125I] альбумин для инъекций»; «Хром [51 Сг] эдетат для инъекций»; «Раствор цианокобаламина [57Со]»; «Цитрат железa [59Fe] для инъекций»; «Цитрат галлия [67Ga] для инъекций»; «Коллоидальное золото [198Аи] для инъекций»; «L-селенометионин [75Se] для инъекций»; «Натрия хромат [51Сг] стерильный раствор»; «Натрия йодида [1311] раствор»; «Ксенон [133Хе] для инъекций». Особенности стандартизации радиопрепаратов В медицинской практике применяется около 50 радиофармацевтических препаратов, на которые имеются ФС. В них отражены особенности, предъявляемые к качеству радиофармацевтических препаратов по сравнению с обычными лекарственными веществами. Они оговорены в специально разработанных «Методических указаниях по составлению проектов фармакопейных статей на радиофармацевтические препараты» и «Макете фармакопейной статьи на радиофармацевтический препарат». В ГФ XI (вып. 1, с. 55) общая статья «Радиоактивность» и в ГФ XII (часть 1с.39) ОФС 42-007307 «Радиофармацевтические препараты» В ней приведены термины и определения, единицы активности и энергии, основные ядерно-физические характеристики радионуклидов, особенности состава и свойств радиофармацевтических препаратов, а также методы их контроля, способы защиты от облучения. Определение подлинности и активности Для оценки качества радиофармацевтических препаратов устанавливают их подлинность и измеряют активность. С этой целью используют следующие параметры и константы: период полураспада (Т 1/2); удельную активность — отношение активности радионуклида в препарате к массе всего препарата или к массе элемента; объемную активность — отношение активности радионуклида в препарате к объему препарата. Показатели качества (радиоизотопная и радиохимическая чистота, химическая чистота) Определение чистоты. В отличие от других лекарственных веществ определяют радионуклидную и радиохимическую чистоту радиофармацевтических препаратов. Следует обратить внимание, что испытания на чистоту характеризуются определением не только допустимых и недопустимых примесей других элементов (химическая чистота), но и оценкой содержания других радиоактивных изотопов в препарате, ее указывают, например, в виде доли от общей радиоактивности. Таким образом, для радиофармацевтического препарата важна характеристика радионуклидного состава. С помощью радионуклидного анализа, используя различные методы, проверяют наличие радионуклидных примесей — примесей других радиоактивных нуклидов как того же, так и других элементов (%) и радиохимических примесей — примесей других химических соединений, содержащих тот же радионуклид, что и основное вещество (%). Радиохимическая чистота. Радиоактивный препарат называется радиохимически чистым, если нём не содержатся примеси радионуклидов других элементов, кроме данного на этикетке. Например, водный раствор, содержащий радионуклид 131I, в форме NaI, являете; радиохимически чистым, если в нем нет примеси радионуклидов других элементов, например 90Sr или 95Zr. Аналогично водный раствор НВг, содержащий изотопы 80Вг и 82Вг, также считается радиохимически чистым. При загрязнении, при оценке радиохимической чистоты радиофармацевтического препарата оценивают: Радиохимические примеси – это примеси химических соединений отличных от основного вещества, но содержащих тот же радиоактивный нуклид. Количество радиохимических примесей, т.е. активность содержащегося в них нуклида выражается как процентное отношение активности радиохимических примесей к общей активности основного радионуклида в препарате (%). Радиохимическую чистоту – это процентное отношение активности радионуклида в основном химическом веществе препарата к общей активности радионуклида в этом препарате (%). Например, при описании радиохимической чистоты «Раствора индия (111In) хлорида» в USP-24 (фармакопея США) указано, что в препарате должно быть не менее 95 % индия (111In) хлорида. Для определения радиохимической чистоты радиофармацевтических препаратов используют различные методы, но чаще всего хроматографию и электрофорез. Количество радиофармацевтического препарата, взятого для анализа, должно обеспечивать получение статистически достоверных результатов измерения для тех примесей, активность которых составляет не менее 0,5% от нанесенных количеств. Хроматографирование (или электрофорез) проводят либо со свидетелем — неактивным аналогом определяемого вещества, либо для обнаружения мест нахождения радиоактивных компонентов на хроматограммах (электрофореграммах) используют радиометрию или авторадиографию. Скорость счета измеряют на радиометрической установке с соответствующим детектором (в зависимости от типа и энергии излучения). Например, если радиофармацевтический препарат испускает достаточно интенсивное γ -излучение, то используют сцинтилляционный γ(квантовый) -счетчик. Измеряют скорости счета от всей хроматограммы (электрофорезограммы) и от ее участков, содержащих основное вещество и определенную радиохимическую примесь. Затем соотносят эти величины и результат выражают в процентах. Радиохимическая чистота препаратов может изменяться под влиянием различных факторов: окисления, влияния света, температуры, радиационного разложения и др. Значения радиохимической чистоты, приводимые в ФС, указывают на продолжительность срока годности данного радиофармацевтического препарата. Радионукдидная чистота. Ядерно-физически чистыерадиоактивные препараты содержат только один радионуклид. Таким образом, эти препараты одновременно являютсярадиохимически чистыми (обратное утверждение неверно). При загрязнениях определяют радионуклидные примеси – примеси других радиоактивных нуклидов (как того же, так и других элементов). Количество радионуктидных примесей выражается как процентное отношение активности примесей к активности основного нуклида на определенную дату и при необходимости время (в %). радионуклидную чистоту – это процентное отношение активности основного радионуклида к общей активности препарата, обусловленной в том числе и присутствием радионуклидных примесей как того же, так и других элементов (в %). Например, для того же препарата «Раствор индия (111In) хлорида» радионуклидная чистота характеризуется радиоактивностью примесных радионуклидов ll0In, II4In и 65Zn в количестве 3 Бк на 1 МБк. Основной радионуклид 111. Радионуклидная чистота радиофармацевтического препарата должна быть, как правило, не ниже 99,5%, т.е. допустимая измеренная величина радионуклидных примесей в течение срока годности не должна превышать 0,5%. Радионуклидная чистота не является постоянной характеристикой данного препарата, а изменяется с течением времени. Радионуклидную чистоту определяют методом ядерной спектроскопии и радиометрии с применением в случае необходимости количественного химического выделения примесей. Радионуклидный анализ при определении чистоты РФП включает три этапа: обнаружение радионуклидных примесей, идентификацию радионуклидных примесей и определение активности радионуклидных примесей. Примеси обнаруживают путем измерения энергии β- и γ-излучения и периодов полураспада для анализируемого препарата и выделенных из него отдельных примесей. По полученным данным обнаружения радионуклидных примесей, с помощью справочных таблиц идентифицируют примеси по периодам полураспада, энергии и интенсивности излучения. Активность идентифицированных примесей измеряют с помощью радиометрических установок с β- и γ-счетчиками. Конкретные методики анализа на отдельные радионуклидные примеси приведены в соответствующих ФС в тех случаях, когда анализ может быть выполнен в течение срока годности радиофармацевтического препарата. Детальный анализ радионуклидной чистоты препарата производится только предприятием-изготовителем. Напомним, активность обнаруженной примеси приводится в процентах по отношению к активности основного радионуклида (на дату проведения анализа). Количественное определение Для количественного анализа радиофармацевтических препаратов используют сравнительный способ расчета активности испытуемого препарата и эталона в идентичных условиях. Определяют удельную и относительную активность по сравнению с эталоном. В России существует система Государственного контроля качества радиофармацевтических препаратов, выпускаемых отечественной промышленностью. Его осуществляет Государственный НИИ контроля качества ЛС. Особенности качественной и количественной оценки Особенность качественной и количественной оценки радиоактивных препаратов заключается в использовании не только химических и физико-химических методов, но и радиометрического анализа. Различные способы радиометрического анализа основаны на свойстве α-, β- и γ-излучения взаимодействовать с электронами атомных оболочек и образовывать при этом положительно или отрицательно заряженные ионы. В силу своей подвижности (в воздухе или в газах) эти ионы становятся проводниками электричества. Данный принцип является конструктивной основой ряда приборов для радиометрического анализа: ионизационной камеры, счетчика Гейгера — Мюллера, сцинтилляционных спектрометров и др. Ионизационная камера — прибор, в котором один электрод закреплен на изоляторе, а другим электродом служат стенки камеры. Камера наполнена инертным газом (азот, аргон), между электродами поддерживается разность потенциалов порядка 300 В. Если к камере поднести радиоактивный изотоп, то в результате ионизации между электродами возникает импульс тока, пропорциональный степени радиоактивности. Счетчик Гейгера-Мюллера представляет собой прибор, основной частью которого является трубка, наполненная аргоном под давлением 133 гПа (100 мм рт. ст.) с примесью паров спирта. Между изолированными электродами, впаянными в трубку, поддерживается разность потенциалов около 1000 В. Под влиянием β- или γ -излучения из атомов газа выбиваются электроны, в результате чего возникает импульс тока, который регистрируется электромагнитным нумератором. Сцинтилляционные спектрометры состоят из специального вещества — фосфо'ра и кристалла, изготовленного из иодида натрия или цезия. Под действием γ-излучения в приборе возникают световые вспышки — сцинтилляции. Они попадают в фотоумножитель и преобразуются в электрический ток, который можно регистрировать. Идентификацию и количественное определение радиоактивных препаратов можно осуществлять всеми перечисленными приборами (счетчиками). Наиболее совершенными, точными и вместе с тем простыми из них являются сцинтилляционные. Они широко применяются в радиохимических лабораториях для исследования γ- и β-излучения. Хранить приборы нужно в специальных помещениях, чтобы избежать загрязнения радиоактивными веществами. Расчет содержания радиоактивных элементов довольно сложен. Поэтому для качественного и количественного анализа радиофармацевтических препаратов используют сравнительный способрасчета активностииспытуемого препарата и образцового источника излучения (эталона) в идентичных условиях. Так определяют удельную и относительную активность по сравнению с эталоном. Для выполнения испытаний используют обычно доли миллилитра раствора радиофармацевтического препарата, учитывая высокую их стоимость, малый объем выпуска, необходимость специальных условий для выполнения анализа, в частности радиоактивной защиты при работе с большими объемами. Поэтому методы, используемые для контроля качества и рекомендуемые ГФ и другими фармакопеями мира, должны давать возможность получения: надежных результатов при проведении испытаний малых количеств радиофармацевтических препаратов и в короткие промежутки времени вследствие непродолжительных сроков годности, т.е. должны быть экспрессными. Меры предосторожности, хранение, сроки годности и транспортировка Специфические свойства радиоактивных препаратов требуют соблюдения особых условий их упаковки, хранения и транспортировки. Радиоактивные вещества, не используемые в работе, должны находиться в хранилищах, где имеется защита от проникающих излучений и вытяжная вентиляция со специальными фильтрами. Для хранения предусматриваются ниши, колодцы, сейфы, защищенные бетоном, стальными или свинцовыми плитами, снижающими дозы излучений до предельно допустимых. Хранят α- и мягкие β-излучатели в контейнерах-пеналах из пластмассы. Источники жесткого β-излучения дополнительно экранируют свинцом. γ-Излучатели хранят в свинцовых или чугунных контейнерах. В этих контейнерах осуществляют и транспортировку радиоактивных препаратов. Хранение радиоактивных веществ в открытом виде (негерметической упаковке) разрешается только в строго установленных количествах. При транспортировке должны строго соблюдаться особые условия, указанные на этикетках и в сопроводительных документах (допустимые температуры, атмосферное давление, сроки доставки). При нарушении радиационной упаковки необходимо, не вскрывая защитный контейнер и не проверяя его содержимое, создать комиссию и оформить в установленном порядке акт, а также немедленно известить грузоотправителя, местные органы санитарного надзора. Если при проверке обнаружится частичное или полное отсутствие радиоактивного вещества, то должны быть приняты неотложные меры по установлению местонахождения утраченного количества вещества, выявлению причин этой недостачи и мест возможных загрязнений радиоактивными веществами. Применяя радиофармацевтические препараты, необходимо строго соблюдать технику безопасности и правила работы с радиоактивными веществами, установленные нормативными актами. Работа с радиофармацевтическими препаратами допускается только в условиях, исключающих превышение допустимых норм излучения. Халат должен надежно защищать одежду от радиоактивных загрязнений. Работать следует в косынке (шапочке), защитных очках и резиновых (хлорвиниловых) перчатках. После работы необходимо тщательно мыть руки теплой водой с мылом. Для исключения возможности загрязнения радиоактивными веществами руки и одежду периодически проверяют с помощью радиометрических приборов. Растворы радиофармацевтических препаратов упаковывают и хранят, руководствуясь требованиями ФС и специальными правилами. Растворы фармакопейных радиофармацевтических препаратов выпускают во флаконах, не только закрытых резиновыми пробками и металлическими колпаками, но и обязательно упакованных в защитные контейнеры. Флаконы должны иметь этикетку с названием препарата и изотопа, а к контейнеру прилагают паспорт, в котором указывают активность препарата и содержание в нем химических, радиохимических и радиоизотопных примесей. Хранят растворы радиофармацевтических препаратов по списку А в специальных шкафах для радиоактивных веществ, строго соблюдая ОСПОРБ-99 «Основные санитарные правила обеспечения радиационной безопасности». Срок годности радиофармацевтического препарата определяется такими факторами, как стабильность его химического и радиохимического состава; уменьшение активности с течением времени по закону радиоактивного распада, т.е. от периода полураспада и составляют от нескольких минут до нескольких суток; возрастание относительного состава долгоживущих радионуклидных примесей, имеющих периоды полураспада большие, чем у основного радионуклида. Срок хранения каждого радиофармацевтического препарата приводится в соответствующей ФС. После истечения срока годности препараты подлежат возврату на завод-изготовитель. Ни в коем случае не разрешается выбрасывать растворы радиоактивных веществ в канализацию или мусоропроводы (мусорные ящики). В последние годы в медицине все шире используются радиофармацевтические препараты, меченные позитронизлучающими радионуклидами: 11С с периодом полураспада 20 мин., 13N — период полураспада 10 мин, 15О — период полурапада 2 мин. Относительно малый период полураспада указанных радионуклидов не позволяет проводить их аналитический и радиоаналитический контроль в полном объеме и на тех методических принципах, которые используются для других радиофармацевтических препаратов (131I, 123 I, 111 I и др.). В связи с дополнительными техническими и аппаратными сложностями возникают трудности составления для них НД. Это усугубляется также небольшими объемами производства радиофармацевтических препаратов с короткоживущими радионуклидами за один технологический цикл 3-5 единиц упаковок в серии. 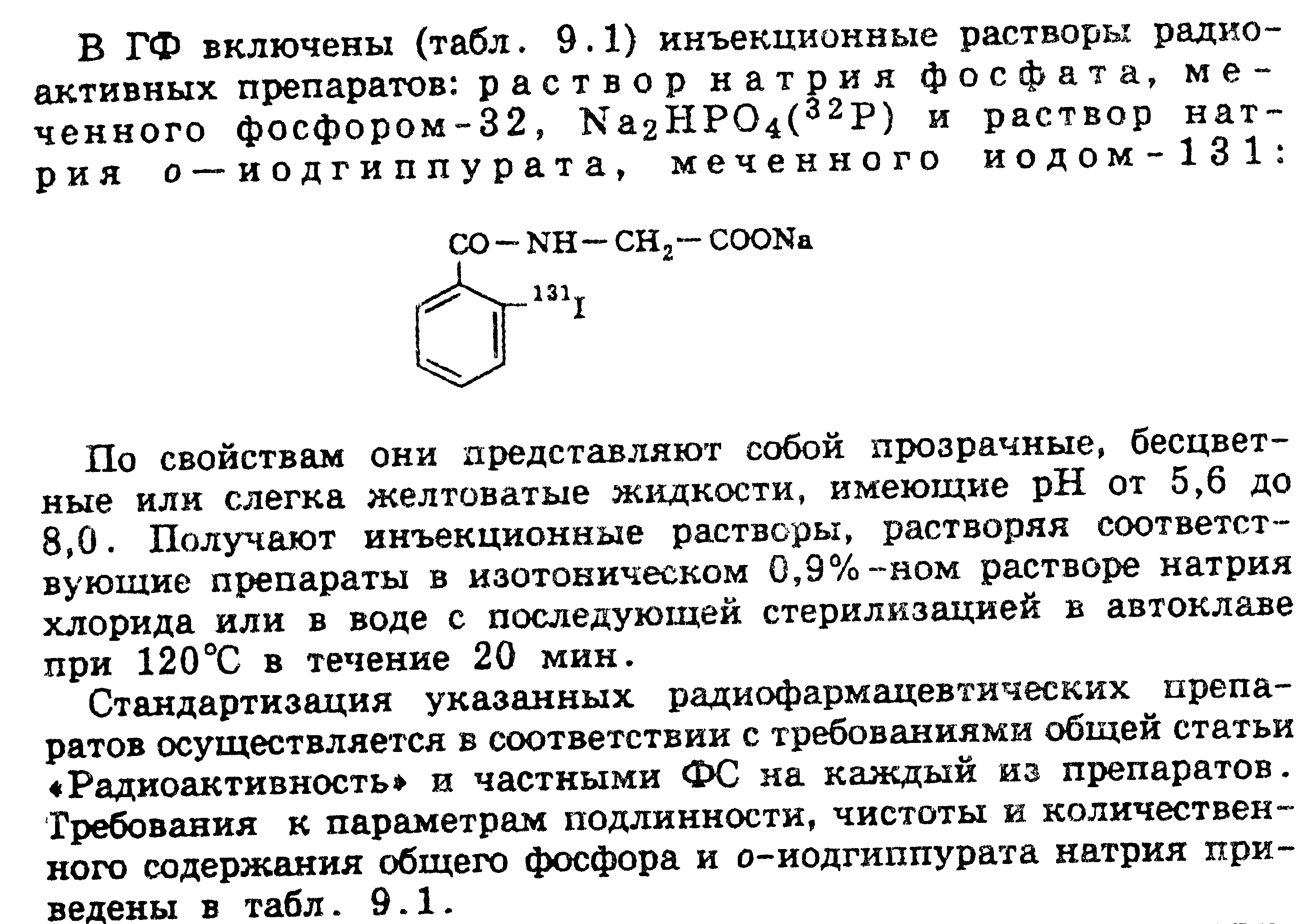 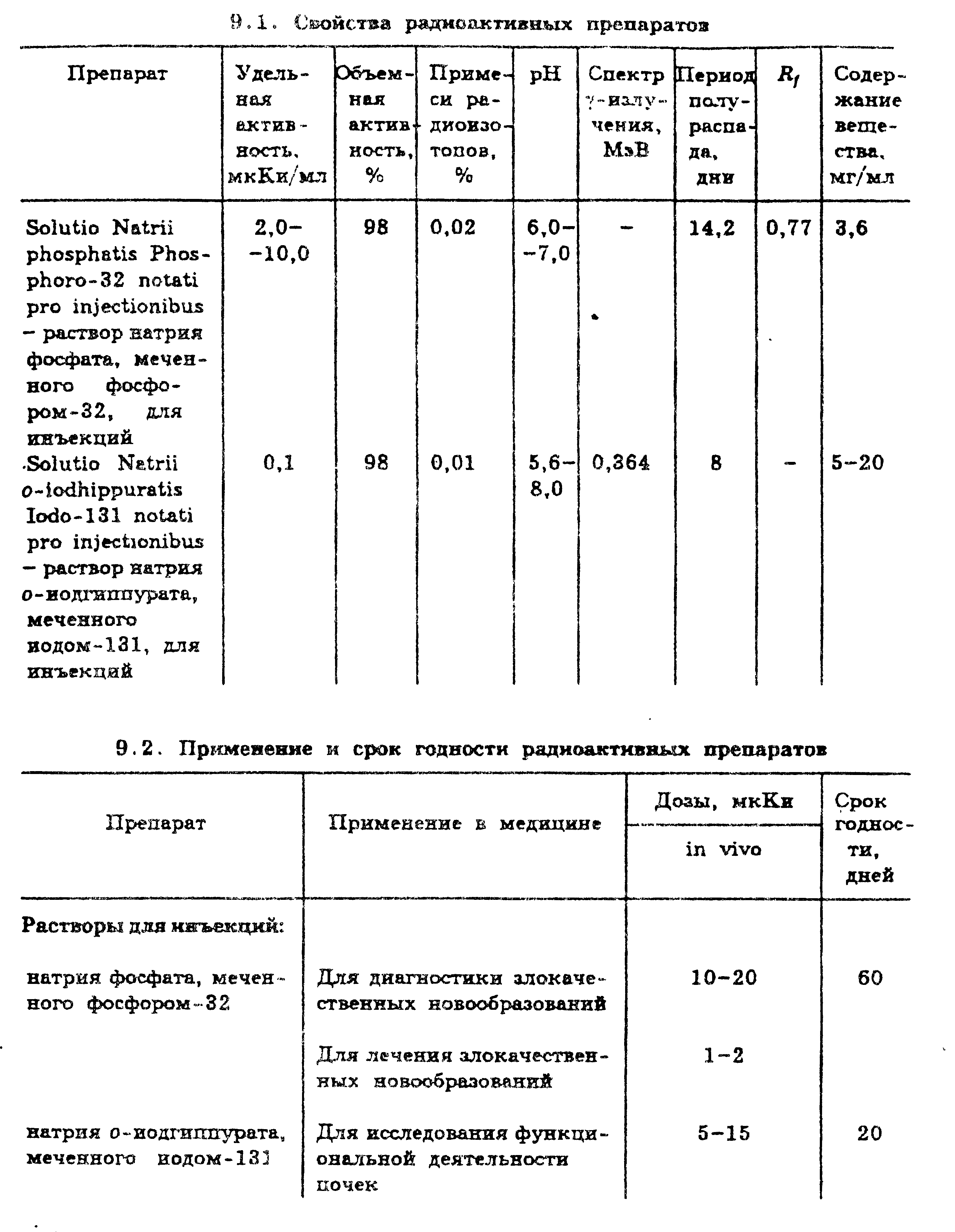 |
