Лекции по биохимии
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
Е +S<------------------- ES*-------- Eр ------- Е+ р Так как ES существует, в течение конечного промежутка времени может быть и так, что все молекулы фермента связаны в ES (при условии, что концентрация субстрата высокая - субстрат в избытке) — говорят о максимальной скорости ферментативной реакции. Теория Фишера подразумевает жёсткое соответствие между активным центром и субстратом («ключ» - «замок»), т.е. каталитический центр заранее подготовлен к форме субстрата. Теория Кошланда (теория индуцированного соответствия). Подразумевает гибкость каталитического центра, т.е. каталитически активная конформация фермента и субстрата может возникать в момент присоединения субстрата, до него геометрическое соответствие АЦ и субстрата приблизительное.   Гипотеза индуцированного соответствия предполагает между ферментом и субстратом не только геометрического соответствия, но и электрическое. Основные черты: 1. АЦ формируется из участков ППЦ и отдельных аминокислотных остатков. Субстрат соединяется с АЦ в нескольких точках, это обеспечивает высокую избирательность связывания (комплиментарность субстрата и АЦ) и ориентацию субстрата, необходимую для катализа.
Конформационные изменения могут способствовать «растягиванию», разрыву связи или сближению молекул в реакциях синтеза, тем самым, ускоряя реакцию. Специфичность.
Единица ферментативной активности За единицу фермента принимают такое его количество, какое катализирует превращение 1 ммоль вещества за 1 мин.[1 Ед]. Удельная активность фермента — число единиц фермента на массу белка в мг. В образце. Молярная активность указывает сколько молекул субстрата превращает 1 моль фермента за 1 минуту (число оборотов). Регуляция активности ферментов. Выделяют 4 типа регуляции: 1. Частичный протеолиз (Трипсиноген------ Трипсин) 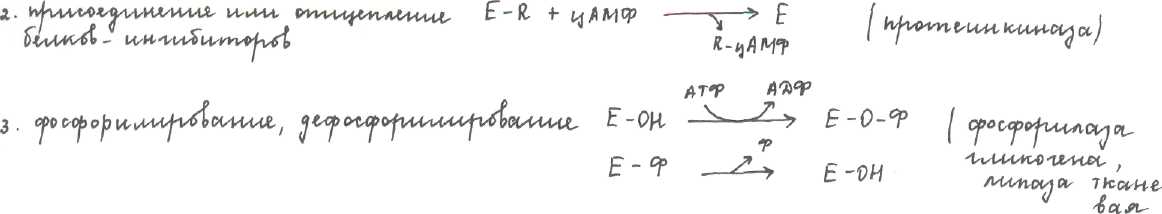 4. Аллостерическая ( фосфофруктокиназа, изицитратдегидрогеназа) «Ферменты - основа жизни» (Павлов) В обмене веществ ферменты играют первостепенную роль. В основе заболеваний лежит изменение какой-либо ферментативной реакции, если ингибировать хотя бы 1 фермент наступает смерть. Факторы, оказывающие влияние на активность ферментов.
1). Концентрация субстрата 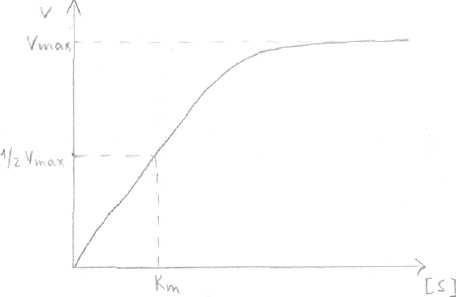 При низкой концентрации субстрата и последующем её увеличении зависимость между [субстрата] и V прямо пропорциональна. Дальнейшее увеличение концентрации субстрата приводит к снижению скорости, и наконец, наступает такое значение концентрации субстрата, после которой скорость ферментативной реакции остаётся неизменной. Это называется эффектом насыщения фермента субстратом. Для характеристики кинетики в ферментативных реакциях была вычислена константа Михаэлиса - Ментен (Michaelis&Menten), которая выражается: Km= (E)*(S)-(ES)/(ES) По сути дела Km составляет l/2Vmax . Для того, чтобы определить скорость реакции можно пользоваться уравнением: V=Vmax*(S)/(S)+Km Концентрация фермента не оказывает влияния на процесс. 2). Температура Ферменты имеют белковую природу и являются термолабильными. В некотором ограническом интервале температур (от 0°до 25° С) скорость ферментативной реакции повышается, с ростом температуры (на 10°С) скорость повышается примерно в 2 раза. При дальнейшем повышении температуры скорость реакции постепенно понижается, высокие температуры приводят к денатурации фермента - белка и необратимой утрате ферментативной активности. Для большинства ферментов оптимум температурный приближается к нормальной температуре тела. В первые часы повышенной температуры вырабатывается фермент интерферон, выполняющий защитные функции. Пониженные температуры используют в трансплантации, искусственном оплодотворении. Растительные ферменты менее чувствительны к температуре. 3). Влияние рН на активность ферментов. а) значение рН, которое соответствует максимальной активности фермента, необязательно совпадает со значением рН, характерным для нормального внутри - и внеклеточного окружения этого фермента; б) всё-таки большинство ферментов имеют оптимум рН, близкий к рН окружающей среды; в) у многих ферментов оптимум рН приближается к ИЭТ; г) для каждого фермента существует своё значение рН, при котором он проявляет максимальную активность; д) «Значение рН внутри клетки является, возможно, одним из самых важных элементов регуляции клеточного метаболизма».  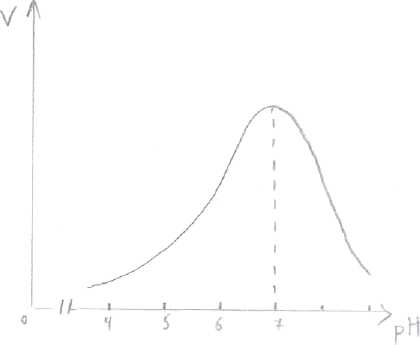 Пепсин Пепсин Трипсин 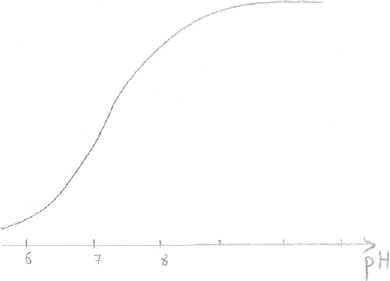 Согласно теории шведского учёного Сёренсена, влияние рН на активность ферментов определяется:
4). активаторы и ингибиторы. Активирование или ингибирование различных ферментов веществами эндогенного и экзогенного происхождения является значимым фактором регуляции обмена веществ. Ингибиторы подразделяются на обратимые и необратимые. В свою очередь обратимое ингибирование бывает 3-ёх видов: аллостерическое, конкурентное и неконкурентное. Примером необратимого ингибирования может быть действие высоких температур, резкое изменение рН, приводящее к денатурации фермента или действие тяжёлых металлов, соединений мышьяка, которые связываются с ферментом или с фермент-субстратным комплексом в АЦ или блокируют функциональные группы молекул фермента, удаленных от АЦ. В наибольшей степени ингибирующему действию тяжелых металлов подвергаются тиоловые ферменты. Диизопропилфторфосфат - это вещество образует сложный эфир с остатком серина в молекуле ацетилхолинэстеразы. Вследствие этого утрачивается способность нейрона проводить нервные импульсы (относится к сильным нервнопаралитическим средствам). Терапевтическое действие аспирина связано с ингибированием одного из ферментов, участвующего в биосинтезе простогландинов (обладает гормональными свойствами, является клеточным метаболитом). Конкурентное ингибирование. Механизм такого ингибирования в общих чертах связан с тем, что химическая природа ингибитора близка к химической природе субстрата. Например, активность сукцинатдегидрогиназы может быть подавлена низкомолекулярными дикарбоновыми кислотами, например, щавелевой или пропандиовой кислотами.  Сукцинат СукцинатВозникает комплекс фермент-ингибитор. Конкурентное ингибирование может быть снято путём увеличения концентрации субстрата. Для внутриклеточных процессов характерно обратимое ингибирование. Конкурентное ингибирование.
Конкурентное и неконкурентное ингибирование легко различить по графикам Лайнуивера-Берка. Графики представляют собой зависимость обратной скорости (1/Vo) от обратной концентрации субстрата (1/[S]). 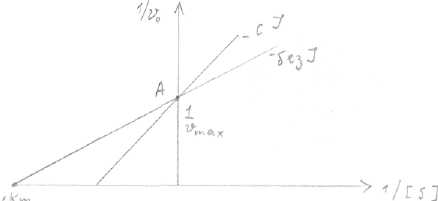 Чем выше точка А, тем Vo меньше. При бесконечно большой [S] скорость ферментативной реакции не меняется (т.А), т.к. при этом происходит полное вытеснение ингибитора из АЦ большими концентрациями субстрата, Km при этом увеличивается (т.к. она зависит от [S], а она здесь увеличивается). Неконкурентное ингибирование. Ингибитор по структуре не похож на субстрат, не конкурирует с субстратом за АЦ, а присоединяется в другом центре - аллостерическом, при этом происходит уменьшение максимальной скорости ферментативной реакции, a Km остаётся неизменной, т.к. не зависит от [фермента]. Уменьшение Vmax происходит потому, что при помощи ингибитора из ферментативной реакции выводятся молекулы фермента, меньше молекул фермента, меньше Vmax. График Лайнуивера-Берка выглядит следующим образом: 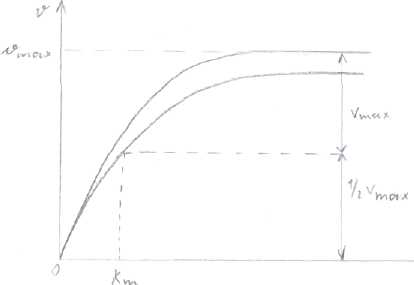 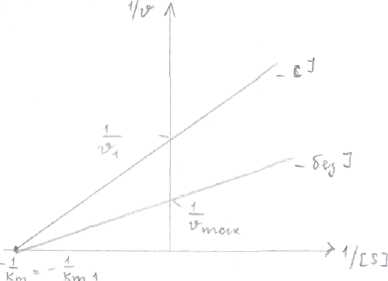 Ингибитор присоединяется к аллостерическому центру, изменяет конформацию фермента—» АЦ 2 фермента выводится из реакции —> V. Биохимия нуклеотидов и нуклеиновых кислот. Матричные биосинтезы. Вопросы: 1. структура нуклеотидов-мономеров нуклеиновых кислот. Структура азотистых оснований - пуриновых (А, Г) и пиримидиновых (У, Т, Ц). Нумерация атомов в азотистых основаниях, в рибозе и дезоксирибозе (с.98) - нумерация в пуриновых и пиримидиновых основаниях ведется в противоположном направлении, С5 находится в одном и том же положении
8. Структура и функции РНК (с. 100), ш-РНК (с.516), м-РНК (с.518), р-РНК (с.513) Биологически важные производные нуклеотидов (моно- и динуклеотидов). АТФ - аденозинтрифосфорная кислота - основной внутриклеточный переносчик свободной энергии. [АТФ] 1 ммоль/л. По структуре - это аденозин с тремя остатками фосфорной кислоты в пятом положении пентозы. При гидролизе 1 моля АТФ высвобождается 7 ккал энергии. В результате катаболизма (ферментативное разрушение белков, жиров, углеводов, поступающих с пищей). Энергия из химических связей накапливается путём фосфорилирования АДФ и АТФ, которая затем в процессах анаболизма используется за счёт обратной реакции (АТФ=АДФ+Ф). АТФ необходима для биосинтеза веществ, мышечного сокращения, функционирования K/Na насосов, т.е. активного транспорта. В АТФ очень легко разрушаются связи между остатками фосфорной кислоты с выделением большого количества энергии - макроэргические связи. Кроме АТФ переносчиками энергии являются: ГТФ и АТФ - биосинтез белка; АТФ и УТФ - биосинтез полисахаридов; АТФ и ЦТФ, дАТФ, дГТФ, дТТФ, дЦГФ - в биосинтезе ДНК. цАМФ-3,5-аденозинмонофасфат-медиатор внеклеточных сигналов (например, гормонов). Образуется из АТФ под действием фермента аденилатциклазы. цГМФ-антагонист цАМФ. Производные урациловых участвуют в качестве коферментов в различных реакциях метаболизма гексоз и синтезе гликогена, например, уридиндифосфатлюкоза - предшественник в синтезе гликогена, УТФ используется в реакциях превращения галактозы в глюкозу. Некоторые нуклеозиды 5 - фосфаты выполняют роль переносчиков молекул, например, КоА является производным нуклеотида, переносит ацильные группы и ацетильные радикалы, содержит витамин - пантотеновую кислоту. Производные нуклеотидов: ФАД, НАД, не являются продуктами гидролиза нуклеиновых кислот, а синтезируются самостоятельно и являются производными витаминов. НАД - никотинамидадениндинуклеотид, производное витамина РР, ФАД - флавинадениндинуклеотид, производное витамина В ; функции: связующие звенья между процессами анаболизма и катаболизма. Содержат аденозин-5-фосфат, переносят 2Н=2р+ё ФАДН2,- восстановленная форма ФАД+. НАДН + Н+"- т.к. этот кофермент переносит не 2 атома Н , а гидрид-ион (2ё и 1р). Матричные биосинтезы. Основными матричными биосинтезами являются:
Репликация ДНК. Механизм: спираль раскручивается, цепь расходится, а затем каждая одноцепочечная половина ДНК достраивается до целой двухцепочечной по принципу комплиментарности, в результате получается 2 двухцепочечные молекулы ДНК - полуконсервативный способ. Консервативный способ когда вновь синтезированная цепь образуется без раскручивания. Характеристика репликации. Субстратами для репликации служат дезоксирибонуклеозидфосфаты (дАТФ, дЦТФ, дГТФ, дТТФ). Источники энергии - дАТФ, дГТФ, дТТФ, дЦТФ. Репликация ДНК всегда идет с образованием репликативной вилки, синтез идет в направлении 5—»3. В синтезе принимает участие мультиферментный репликативный комплекс. Ферменты: эндонуклеазы, ДНК - раскручивающие белки, ДНК-полимеразы (а,δ,β, ε), ДНК - лигаза, РНК - праймаза. Продукты реакции - вновь синтезированные молекулы ДНК идентичны матрице, репликация идет в двух направлениях, обе цепи реплицируются одновременно, протекает в S фазу клеточного цикла. Полная репликация генома происходит за 9 часов -время необходимое для удвоения генетического материала диплоидной делящейся клетки —> репликация начинается в нескольких местах с образованием «репликативного глаза». Если точка репликации находится в начале «репликативного глаза», то репликация идет в одном направлении. Если точка репликации находится в середине «репликативного глаза», то репликация идет в двух направлениях, но цифровое сохраняется. Образование репликативных вилок начинается с образования «репликативного глаза». Для бактерий и вирусов «репликативный глаз» образуется там, где имеются специфические нуклеотидные последовательности (около 300 нуклеотидов) - это точки начала репликации. В точке начала репликации эндонуклеаза (топоизомераза) вызывает кратковременный разрыв 1 цепи ДНК (это топоизомераза 1) или двухцепочечный разрыв (топоизомераза 2) и присоединяется к разорванному концу, способствуя расплетению небольшого участка спирали. В дальнейшем раскручивании ДНК принимают участие спецефические белки - ДНК-геликазы (рис.2), использующие АТФ (АТФ-зависимые ДНК-геликазы). Другие белки образуют репликативную вилку - дестабилизирующие белки (рис.2), которые выстраиваются в ряды на образовавшейся одноцепочечной ДНК, растягивают её остов и делают основания нуклеотидов более доступными для спаривания. Для того чтобы репликативная вилка могла продвигаться вперёд со скоростью равной 50 нуклеотидов в секунду, родительская спираль должна вращаться 50 оборотов в секунду. Этого не происходит, т.к. при действии топоизомеразы образуется шарнирный участок, т.е. временный разрыв цепи, возникающий под её действием, даёт возможность спирали ДНК по обе стороны от него вращаться. Синтез, растущей дочерней цепи идёт в направлении 5—>3, осуществляется ДНК-полимеразой (ДНК-полимераза 5 осуществляет синтез лидирующей цепи, е, а, р -отстающей), осуществляющей полимеризацию нуклеотидов по принципу комплиментарности. Рис.2 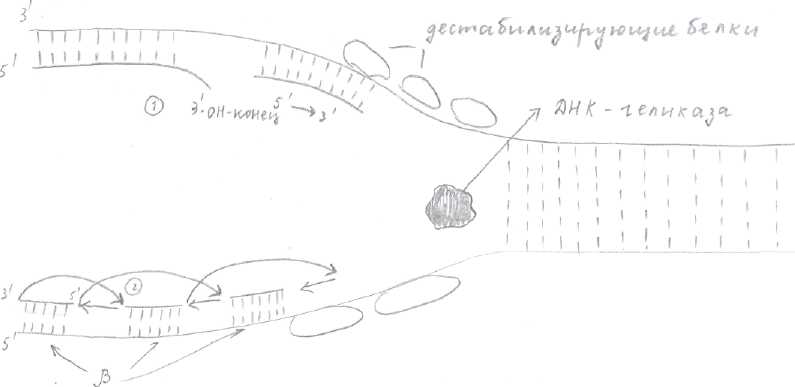 Ведущая цепь синтезируется следующим образом: Синтез начинается с синтеза затравки (т.к. ДНК-полимераза может только достраивать нуклеотиды к имеющимся 3-ОН-концам). Затравка или праймер (от 10 до 200 нуклеотидов) состоит из нуклеотидов РНК и синтезируется РНК-праймазой. 3-ОН-конец праймера должен быть спарен с матричной цепью. Если 3-ОН-конец не спарен с нуклеотидами матричной цепи, тогда ДНК-полимеразы отщепляет неспаренные нуклеотиды до появления спаренного конца (1) (рис.2). ДНК-полимераза 5 достраивает дочернюю цепь, прикрепляя к праймеру 5-конец (2). Синтез на ведущей цепи протекает быстро. Синтез отстающей цепи происходит особенным образом, т.к. если бы он проходил также, как на ведущей цепи, направление синтеза было бы 3—>5 (рис.2), а ДНК-полимеразы осуществляет "синтез новой дочерней цепи в направлении 5^------>3^ —> особенности: - отстающая дочерняя цепь синтезируется фрагментами;
Каждый раз нужна новая затравка (из 10 нуклеотидов). Затравки синтезируются с определенным интервалом на матрице, затем их наращивает ДНК-полимераза с 3- конца, начиная всякий раз новые фрагменты Оказаки, до тех пор, пока не достигнет РНК-затравки, присоединенной к 5-концу предыдущего фрагмента. Затем ДНК-полимераза р удаляет затравки между фрагментами Оказаки и достраивает нуклеотидную цепь из нуклеотидов ДНК. Завершает процесс ДНК-лигаза, которая соединяет З'-фрагмент нового фрагмента ДНК с 5-концом предыдущего. Таким образом, в целом цепь строится в направлении 3^-»5,' но каждый фрагмент синтезируется в нужном направлении 5—»3 по типу шитья назад. Транскрипция. Трансляция. Заключается в переводе информации, заключенной в последовательности нуклеотидов матричной-РНК, в последовательность аминокислот в белке, т.е. матрицей для синтеза белка является матричная РНК. Субстраты - аминокислоты, источники энергии - АТФ и ГТФ. Биосинтез белка - циклический процесс:
Для вступления в биосинтез аминокислоты должны быть активированы. Активация аминокислот - образование аминоацил-m-PHK (аминокислота своей СООН-группой присоединяется к 3-ОН-группе акцепторного участка т-РНК). Происходит это при помощи специфических ферментов (для каждой аминокислоты - свой фермент). Аминоацил-m-PHK синтетаза (участвует в реакции активации аминокислот) Молекулы т-РНК являются адаптерами. 1 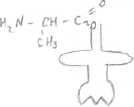 ).Инициация ).ИнициацияЗаключается в формировании белоксинтезирующего мультиферментного комплекса рибосомы. Рис.1  В начале особая инициирущая аминоацил-m-PHK, несущая у эукариот Met, у прокариот - формил Met, присоединяется к малой субъединице рибосомы. З  атем этот комплекс присоединяется к матричной атем этот комплекс присоединяется к матричнойРНК в специальном стартовом кодоне по принципу комплиментарности, матричная РЕК удерживается в специальной бороздке. Затем к малой субъединице присоединяется большая (состоящая из А- и Р-участков), так что инициирующая аминоацил-m-PHK оказывается в Р-участке, А-участок свободен. Р-пептидил-m-PHK -связывающий, А-аминоацильный (рис.2) В процессе инициации принимают участие белковые факторы инициации. Фактор инициации 3 катализирует связывание матричной-РНК с малой субъединицей рибосомы. Фактор инициации 2 взаимодействует с инициирующей т-РНК и ГТФ и в присутствии фактора инициации 1 присоединяет т-РНК к первому кодону матрицы. Образуется инициирующий комплекс. Факторы высвобождаются, после этого к ГТФ присоединяется большая субъединица, при этом происходит гидролиз ГТФ. 2). Элонгация Заключается в наращивании ППЦ от NH2 - к СООН-концу. Циклический процесс. Включает 3 этапа (идет в присутствии факторов элонгации):
На первом этапе молекула аминоацил-m-PHK, несущая любую аминокислоту, связывается со свободным А-участком, с комплиментарным кодоном матричной-РНК. А- и Р- участки расположены близко друг к другу так, что 2 связанные аминоацил-m-PHK спариваются с двумя соседними ко донами (фактор элонгации 1, 1 молекула ГТФ) На втором этапе происходит расщепление макроэргической связи между т-РНК и аминокислотой, находящейся в Р-участке (рис.1) и засчет энергии разрыва этой связи в присутствии воды образуется пептидная связь между свободными СООН-концом аминокислотой Р-участка и NH2 —группой аминокислоты в А-участке (пептидилтрансфераза прочно связан с рибосомой). Дополнительной энергией АТФ и ГТФ не требуется для синтеза пептидной связи, т.к. используется энергия макроэргической связи —> в Р-участке т-РНК становится свободной, а растущая ППЦ прикреплена к т-РНК в А-участке. На третьем этапе происходит транслокация или перемещение рибосомы на один кодон с затратой энергии АТФ (фактор элонгации 2) в направлении 5—>3 т-РНК с растущей ППЦ переносится в Р-участок, а свободная аминокислота — в цитоплазму. 3). Терминация Рибосома перемещается до тех пор, пока не встретит стоп ко доны: УАА, УАГ, УГА. К ним нет аминоацил-m-PHK. Вместо этого в А-участок присоединяется особый белок - фактор освобождения - это изменяет активность фермента и он присоединяет к растущему СООН-концу воду —> карбоксильный конец отделяется от т-РНК и синтезированная цепь уходит в цитоплазму. Рибосома распадается, ППЦ отделяется. Антибиотики, бактериальные токсины - ингибиторы матричных биосинтезов. |
