Во второй реакции ацетильный остаток переносится на КоА при помощи фермента Е2 , т.е. фермент Е2 отщепляет ацетильный остаток от собственного кофермента.
В третьей реакции происходит окисление дигидролипоата Е2 третьим ферментом -дигидролипоат Е2 дегидрогеназа.
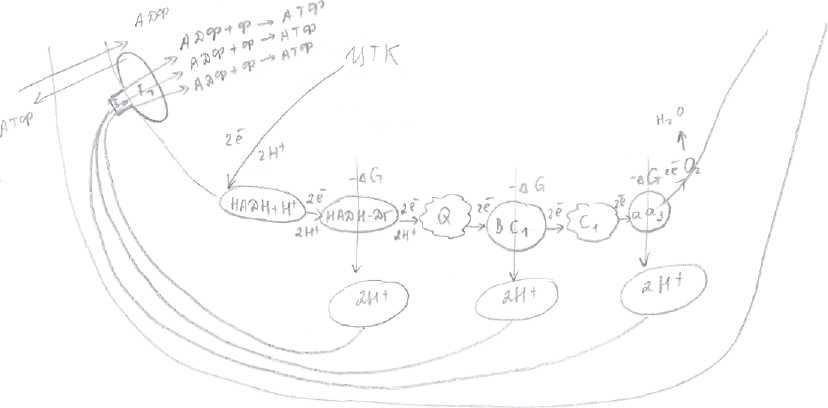
Организация ЦПЭ (по рис.1)
Окисление субстратов в процессе дыхания можно представить как перенос ёиН (т.е. атомов Н), которые отщепляются от субстратов (например, в ЦТК и ОДПВК). Этот процесс включает несколько этапов и в нем участвует ряд переносчиков, образующих ЦПЭ. ЦПЭ локализована во внутренней мембране митохондрий. В переносе ё и Н (т.е. атомов Н) участвуют три класса окислительно-восстановительных ферментов:
пиридинзависимые дегидрогеназы (НАД, НАДФ)
флавинзависимые дегидрогеназы (ФАД,ФМН)
цитохромы, содержащие железопорфириновую кольцевую систему
По рис.1:
первый компонент ЦПЭ - НАДН+Н-кофермент дегидрогеназ, который легко
отделяется от своего фермента и диффундирует к внутренней мембране митохондрий и
становится первым компонентом дыхательной цепи - производное витамина PP.
Второй компонент - НАДН - ДГ - белок - кофермент флавинмононуклеотид - производное витамина B называется так по субстрату, от которого отщепляет или отнимает 2Н (НАДН+Н*)
Третий компонент — кофермент Q или убихинон, структура его сходна со структурой витамина Е и К, содержание KoQ значительно превосходит содержание других компонентов. Липофилен, может перемещаться в липидном слое мембраны митохондрий.
Четвертый компонент - система цитохромов - это сложные белки-гемопротеины. Атом Fe в отличие от Fe гемоглобина может менять валентность, при присоединении или отдаче электронов.
Цитохром В и С функционируют в комплексе, обладают ферментативной активностью, называются по субстрату, который окисляет QH - ДГ.
Пятый компонент - цитохром С - подвижный.
Цитохромы а и а
3 функционируют как ферментцитохромоксидаза, в своем составе
помимо Fe содержат ионы Си/которые участвуют в передаче электронов на конечный
акцептор О
л.
Функции дыхательной цепи:
утилизация водорода, отщепленного от субстратов, и образование метаболической
воды,
разбивают свободную энергию Гиббса, выделяющуюся при переносе электронов и
Н по дыхательной цепи к Ол на порции, достаточные для сопряженного синтеза
АТФ (указаны J,)
ЦПЭ участвует в создании электрохимического трансмембранного протонного
градиента - движущей силы синтеза (АТФ).
Водород от субстратов (например, ЦГК или ОДПВК) (а) при помощи НАД-зависимых и
ФАД-зависимых ДГ (б) вводится соответственно или в начало (НАДН+Н
1) или в
середину ЦПЭ (Q). 2 атома Н в виде 2ё и 2Н передаются на НАДН-ДГ. Q
восстанавливается и становится QH .
Пути Н и электронов расходятся, Н
выходят в матрикс и восстанавливают кислород, а электроны передаются далее по цепи, т.к. система цитохромов переносит только электроны. Поэтому дыхательная цепь называется ЦПЭ.
Система цитохромов может переносить только 1 электрон, поэтому существует 2 теории: либо электроны переносятся по очереди, либо существуют 2 параллельные системы цитохромов. Электроны передаются через всю систему цитохромов и вместе с Н
+, которые высвободились восстанавливают O
2 до метаболической воды - расшифровка 1 функции.
Таким образом, главные компоненты дыхательной цепи располагаются во внутренней мембране строго определенным образом - в порядке возрастания окислительно-восстановительного потенциала. Атомы Н (в виде
2ệи 2Н) перемещаются по цепи от более электроотрицательного компонента к более электроположительному кислороду, (способность отдавать электроны убывает от начала цепи к концу, способность присоединять электроны увеличивается).
Самый сильный восстановитель - НАДН, окислитель – O
2. Электроны, поступающие в начало ЦПЭ, обладают | энергией, по мере продвижения по ЦПЭ запас энергии будет уменьшаться. Общая разность окислительно-восстановительных потенциалов между НАДН (начало) и O
2 (концом) = 1,14В.
Этому соответствует разность свободной энергии Гиббса (-220кДж), этой энергии хватило бы на синтез четырех молекул АТФ, но синтезируется всего 3, остальное рассеивается в виде теплоты.
При переносе двух атомов Н, от окисленных субстратов, происходит изменение свободной энергии Гиббса на каждом этапе ЦПЭ. В дыхательной цепи есть три участка, в которых наблюдается большое ↓G ( смотрите рисунок рядом с ↓
).Эта энергия используется для сопряженного синтеза АТФ, т.е. дыхательная цепь - это такой механизм, который позволяет высвобождать свободную энергию порциями. Если бы энергия высвобождалась единоразово, то она рассеивалась бы в виде тепла. Места сопряженного синтеза были исследованы при помощи ингибиторов дыхательной цепи (3 жирные J, показывают ингибирование) - расшифровка второй функции. Для объяснения механизма сопряжение существует хемиосмотическая теория Митчелла. Согласно которой при переносе е по дыхательной цепи, свободная энергия, выделяемая в трех участках, направленная на выталкивание Н в межмембранное пространство. На каждую пару электронов, переносимую по цепи высвобождается 3 пары Н. Наружная поверхность внутренней мембраны заряжается положительно, а внутренняя -отрицательно.
Таким образом, возникает электрохимический трансмембранный протонный градиент. Т.к. внутренняя мембрана не проницаема для протонов, следовательно, для их выталкивания необходима свободная энергия.
Создавшийся градиент Н
+ заставляет их двигаться в обратном направлении из межмембранного пространства в матрикс. Существует специальный протонный канал, называемый F1 -комплексом, через который H
+ возвращается из межмембранного пространства в матрикс.
F1 - комплекс - это белок, находящийся на внутренней поверхности внутренней мембраны, обращенной в матрикс ( смотрите рис.2) и представляет собой протон-зависимую АТФ-синтетазу, которая преобразует энергию обратного потока Н в энергию фосфатных связей АТФ. При прохождении через F1 -комплекс 1 пары Н АТФ -синтетаза активируется и катализирует реакцию образования одной молекулы АТФ из АДФ и Ф (неорганического).
Т.к. при переносе электронов по дыхательной цепи к О
2, в межмембранное пространство выталкивается 3 пары Н, то синтезируется 3 молекулы АТФ.
Таким образом, в ЦПЭ существует 3 участка сопряженного синтеза. 1 участок по рис.1 на уровне НАДН- дегидрогиназы, 2 - на уровне цитохромов В и С1, 3 - на уровне цитохромов а и аЗ .
Рис.2
Количество АТФ, которое образуется при переносе пары электронов в дыхательной
цепи, называется дыхательным коэффициентом Р/О. Если электроны переносятся с
начала цепи, образуется 3 молекулы АТФ, в результате сопряженного процесса, который
называется окислительным фосфорилированием (окисление ЦПЭ — фосфорилирование в
F1 -комплексе). Если электроны вводятся в цепь на уровне убихинона при помощи
ФАД-зависимых ДГ. (см. рис.2), то дыхательная цепь укорочена. Электроны проходят
всего 2 сопряженных участка, следовательно, Р/О будет равен 2.
Т.к. только в двух местах происходит выталкивание пары Н и они только дважды
активируют АТФ-синтетазу—» синтезируется всего 2 молекулы АТФ.
Разобщители окислительного фосфорилирования разобщают перенос электронов по цепи и фосфорилирования в F1-комплексе (ионофоры и протонофоры).
Например, 2,4 -динитрофенол — это липофильное вещество, которое может свободно проникать через мембрану митохондрий и переносить Hf из межмембранного
пространства в матрикс. То есть не возникает протонного градиента —» не синтезируется
АТФ, а вся энергия, которая выделяется при переносе электронов по ЦПЭ рассеивается в
виде тепла, так называемый пирогенный эффект, потому что повышается температура
тела.
Пирогенным эффектом обладают гормоны щитовидной железы. Валиномицин (ионофор) действует также, но имеет сродство к К+
Дыхательный контроль.Зависимость дыхания в митохондриях от концентрации АДФ называется дыхательным контролем, т.е. скорость синтеза АТФ путем окислительного фосфорилирования определяется потребностью клеток в энергии. При расходовании АТФ повышается концентрация АДФ в клетке —►
ускоряется дыхание и фосфорилирование, т.е. синтез АТФ.
Таким образом, клеточное дыхание включает в себя следующие процессы: ОДПВК, ЦТК и ЦПЭ.
Токсичное действие кислорода. Защита от токсичного действия кислорода. О2является неотъемлимой частью для нормальной деятельности организма, но О
2 может образовывать высокоактивные формы, токсичные для организма. Т.к. О
2 имеет 2 не спаренных электрона с одинаково ориентированными спинами, занимающие самостоятельные внешние орбитали . Присоединение одного электрона к
О2приводит к
образованию супероксидного аниона (O
2). Присоединение второго электрона приводит к образованию пероксидного аниона (O
22-).
О^может действовать как окислитель и как восстановитель. В результате присоединения электронов к О
2 образуется НО.
O
2-+ẽ+2H
+ H
2O
О
2 может служить восстановителем, тогда образуется О^
O2- - ẽ
O
2Возможна ситуация, когда один Од является окислителем, а другой - восстановителем, в результате образуется перекись водорода (пероксид) - малотоксичное для клеток вещество
O
2- + O
2- + 2
Н+ H
2O
2 +O
2(дисмутация)
Образовавшийся H
2O
2 может восстанавливаться О
2 с образованием свободного гидроксильного радикала ОН ,
Оги Н
2О - это высокоактивные вещества, они могут взаимодействовать с нуклеиновыми кислотами, белками, липидами, лучше всего изучено их повреждающие действие на липидный слой мембраны (курс биорганики). В результате их действия повреждаются жирные кислоты, входящие в состав липидов, особенно этот процесс опасен для эритроцитов (это приводит к гемолизу - выходу содержимого эритроцитов). Поэтому организм выработал механизмы, защиты от токсичного действия кислорода (естественная защита), ферментативная.
во всех клетках содержится 2 фермента: 1 - супер-оксиддисмутаза - фермент,
катализирующий реакцию дисмутации; 2 - каталаза, разлагает малотоксичную перекись
до воды, т.е. эти два фермента защищают организм от накапления О2и Н2О2
глутатионпероксидаза, находится больше всего в эритроцитах и в печени. Защищает
мембраны эритроцитов от разрушения, но работает в комплексе с другими ферментами.
Он катализирует восстановление перекиси водорода с образованием воды.
(Восстановление - присоединение двух атомов водорода), донорами двух атомов водорода служат глутатион (трипептид, состоящий из глутаминовой кислоты, цистиина и глицина).
витамин Е - экзогенная защита, токоферол.
Он способен окисляться, т.е. отдавать один электрон с образованием малоактивного свободного радикала. Акцепторами электрона могут быть свободные радикалы жирных кислот (которые образуются в результате перекисного окисления липидов мембран). Т.е. витамин Е восстанавливает свободные радикалы жирных кислот и прерывает цепную реакцию перекисного окисления (антиоксидантная функция витамина Е).
Обмен углеводов.Включает в себя катаболизм (расщепление углеводов пищи и выделение энергии) и анаболизм (синтез углеводов с затратой энергии). Катаболизм УВ включает в себя 3 стадии:
1 стадия: углеводы пищи (суточная потребность 400-500г, самая большая, т.к. глюкоза является основным источником энергии) расщепляется до моносахаридов: глюкозы, галактозы и фруктозы (до мономеров). Расщепление внеклеточное, происходит в ЖКТ.
2 стадия: внутриклеточное расщепление глюкозы протекает в процессе гликолиза с
образованием ПВК.
3 стадия: ОДПВК, ЦТК и ЦПЭ - внутримитохондриально.
Глюкоза расщепляется в ПФП (пентозофосфатный путь) - прямое расщепление глюкозы - энергия не выделяется, функция не энергетическая.
Функции углеводов.
энергетическая
рецепторная
защитная
пластическая
Переваривание и всасывание углеводов.Лишь малая часть углеводов растительной пищи доступна для питания человека, из-за отсутствия соответствующих ферментов. Не перевариваются гемицеллюлозы, целлюлозы, ксиланы, пектины и др. тем не менее они имеют биохимическую функцию и физиологическое значение. Некоторые пентозаны гидролизуются и преобразуются ферментами микрофлоры толстого кишечника с образованием CO
2,; С
2Н
5ОН и органических кислот, что стимулирует перистальтику. Кроме этого, растительные пектины и целлюлозы обладают сорбционно активными свойствами и способны выводить из организма различные токсины.
Основными углеводами растительной и животной пищи являются крахмал и гликоген, соответственно. Крахмал представляет собой смесь двух фракций полисахаридов: неразветвленной амилозы и разветвленного амилопектина.
В прямых цепях крахмала глюкозные остатки соединены между собой а-1,4-гликозидглюкозными связями (фермент а-амилаза).
В точках ветвления связи 1,6 - для гидролиза, которых нужны специальные ферменты. Гликоген имеет большую молекулярную массу, чем крахмал и разветвлен в значительно большей степени. (В его гидролизе принимают участие те же ферменты). Гидролиз данных полисахаридов начинается в ротовой полости под действием амилазы слюны. Значимость этого процесса во многом не ясна, многие млекопитающие этим свойством не обладают.
Основное значение имеют процессы расщепления гликогена и крахмала под действием панкреатической а-амилазы.
а-амилаза имеет абсолютную потребность к ионам С1. Стабилизируется катионами Са, имеет оптимум рН7,1.
Фермент представляет собой одноцепочный полипептид, к которому присоединен олигосахарид.
Продукты гидролиза гликогена и крахмала - это смесь олигосахаридов и конечный продукт - мальтоза.
Процесс гидролиза дисахаридов пищи происходит в дистальном отрезке двенадцатиперстной кишки и происходит он не в просвете, а в клетках слизистой оболочки.
Основные ферменты:
мальтаза
изомальтаза
сахараза
лактаза.
Установлено, что изомальтаза способна гидролизовать а-1,6-гликозидфруктозидные связи, пример соединения - палатиноза; сахараза также способна гидролизовать а-1,6 - гликозидные связи. Клеточный эпителий содержит три различных фермента, имеющих (3-галактазидную активность. Ферменты: р-галаксидаза (рН4,5), гетерогалактозидаза, истинная лактаза.
Всасывание углеводов в кишечнике.Химическая природа моносахаридов, а также их различная структурная форма (открытая цепь, пиранозный или фуранозный цикл) имеет влияние на скорость всасывания. Галактоза > глюкоза > фруктоза > манноза > ксилоза > арабиноза.
Для последних моносахаридов
всасывание носит характер облегченной диффузии; для галакто- и глюкопиранозы - это активный транспорт, при этом всасывание может идти против десятикратного градиента. Для этого процесса есть специфические переносчики. Важная роль принадлежит Na- и К- зависимым АТФ-азам.
Метаболизм глюкозы.Концентрация глюкозы в крови человека поддерживается близкой к 5 ммоль/л. Тогда как в цитоплазме большинства клеток концентрация глюкозы очень низкая. Ее поступление в клетку осуществляется в направлении падения градиента концентрации. Это не пассивная диффузия, а облегченный процесс, природа которого мало изучена. Минимальные потребности в глюкозе имеют все ткани, но у некоторых из них, например, у клеток мозга и эритроцитов эти потребности весьма значительны.
Гликолиз (дихотомический процесс).Это главный путь утилизации глюкоза, протекающий во всех клетках. Гликолиз - это последовательность 10 ферментативных реакций в результате которых из глюкозы образуется 2 молекулы пирувата с одновременным (субстратным) генерированием АТФ. У аэробных организмов гликолиз предшествует ОДГТВК, ЦТК и ЦПЭ. Такой гликолиз называют аэробным.
В анаэробных условиях, например, при мышечном сокращении пируват восстанавливается до лактата - это так называемый анаэробный гликолиз.
Биомедицинское значение ферментативных реакций гликолиза.
главный путь метаболизма глюкозы, а также фруктозы и галактозы с целью
быстрого и последующего генерирования энергии.
гликолиз - это путь образования строительных блоков для биосинтеза высших
жирных кислот, некоторых аминокислот и других соединений.
способность к образованию АТФ в анаэробных условиях, например, в интенсивно
работающих мышцах или при кислородном голодании (в сердечной мышце
возможности осуществления гликолиза ограничены, поскольку аэробные условия просто необходимы для клеток миокарда - недостаток (^приводит к ишемии).
Известно заболевания, связанные с нарушением активности ферментов в гликолизе,
например, незначительное ингибирование пируваткиназы вызывает гемолитическую
анемию.
В быстро растущих раковых клетках активность гликолиза высока, возникает избыток пирувата и лактата —► рН в цитоплазме повышается.
Последовательность реакций гликолиза одинакова у микробов, растений, животных и человека.
Суммарная реакция и выход энергии при гликолизе.
Глюкоза + 2АДФ + 2 Pi + 2 НАД* 2 пирувата + 2 АТФ + 2 НАДН + 2Н
++ 2 Н
2О. При субстратном фосфорилировании суммарный выход энергии гликолиза составляет 2 молекулы АТФ на 1 моль глюкозы, также в этих реакциях образуется 2 молекулы НАДН на 1 молекулу глюкозы, которые в митохондриальном матриксе в реакции
окислительного фосфорилирования потенциально могут дать 6 молекул АТФ. Реакции гликолиза протекают в цитоплазме, а окислительное фосфорилирование в митохондриях. Протоны водорода не способны проникать через мембрану митохондрий и нуждаются в специальном переносчике.
Существует 2 типа челночного механизма переноса протонов водорода:
малатно-аспартатный, при котором потери АТФ не происходит; (8АТФ).
глицерофосфатный - теряется 2 молекулы АТФ (6АТФ).
Нарушения гликолиза в эритроцитах приводит к изменению транспорта О
2. Гликолиз в
эритроцитах и транспорт O
2 между собой .
Эритроциты характеризуются высокой концентрацией 2,3 - бифосфоглицерата = 4
ммоль*л, тогда как концентрация его в других клетках низкая.
Присутствие и повышенный уровень 2,3 - БФГ в эритроцитах способствует диссоциации
Ог, из оксиНЬ и переход его в ткани.
,
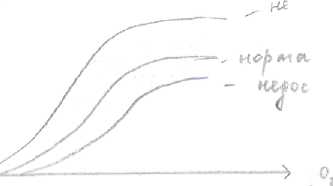 р
р недостаток гексокиназы
норма
недостаток пируваткиназы
насыщение,%
Низкая концентрация 2, 3 - БФГ приводит к ненормально высокому сродству НЬ к O
v Недостаток пируваткиназы приводит к высокому уровню 2, 3 - БФГ и низкому сродству НЬ к О
2.
К регуляции гликолиза имеет отношение фосфофруктокиназа — наиболее важный фермент, а также гексокиназа и пируваткиназа.
Пентофозофосфатный путь (ПФП).Прежде мы рассматривали процессы генерирования АТФ с участием глюкозы, субстратное фосфорилирование при гликолизе и окислительное фосфорилирование в цепи переноса электронов и протонов. Существует метаболитические пути генерирования другого вида энергии восстановительной способности. Легко доступным источником восстановительного эквивалента в клетках является НАДФН. Существует принципиальная разница между НАДН и НАДФН, которая заключается не только в химическом составе, но главным образом в роли этих соединений в биохимических реакциях. НАДФН служит донором протона и электронов при восстановительных биосинтезах.
Биомедицинское значение.
НАДФН необходим для биосинтеза ВЖК и стероидов, при этом активность ПФП
находится на чрезвычайно низком уровне в скелетных мышцах и на высоком в
клетках жировой ткани и в эритроцитах
обеспечение рибозой и дезоксирибозой синтеза нуклеотидов и нуклеиновых
кислот, КоА, НАД, ФАД, АТФ и т.д.
ПФП катализирует ряд не окислительных реакций, обеспечивающих
взаимопревращения 3, 4, 5, 6, 7 - моносахаридов
У растений часть реакций ПФП участвует
в реакциях фотосинтеза.
4. ПФП в эритроцитах поставляет НАДФН для восстановления окисленного
глутатиона.
G-S-H разрушает в эритроцитах перекись водорода. 2 G-S-H + H
2O
2-> G-S-S-G + H
2O
Эта реакция имеет исключительно важное значение, поскольку накопление Н
2О
2 сокращает
время жизни эритроцитов, путем повышения скорости окисления НЬ в метНЬ.
Общая схема биохимических реакций ПФП.1. ПФП начинается с дегидрирования глюкозо-6-фосфата с образованием лактона, который гидролизуется с образованием 6-фосфоглкжоната и затем окислительно декарбоксилируется с образованием рибулозо-5-фосфата. В этих реакциях образуется 2 молекулы восстановленного НАД.
В дальнейшем рибулозо-5-фосфат изомерируется через промежуточный енольный продукт в рибозо-5-фосфат - это окислительная ветвь ПФП.
2. когда в клетках потребность в НАДФН оказывается выше потребности в рибозо-5-
фосфате активизируется другой механизм переноса.
Рибозо-5-фосфат превращается в глицероальдегид-3-фосфат и фруктозо-6-фосфат. Под действием фермента транскеталазы и трансальдолазы. Эти 2 фермента создают обратимую связь между ПФП и гликолизом, промежуточными продуктами в указанных превращениях являются ксилулозо-5-фосфат, седогептлулозо-7-фосфат и эритрозо-4-фосфат.
Медицинское значение.Следствием мутации транскеталазы являются нарушения, приводящие к нервно-психическим расстройствам - синдром Вернике — Корсакова, который заключается в парезе глазодвигательного нерва, ненормальной осанке и походке, дезориентации и потери памяти, в сильных нарушениях психики.
Связано с недостаточностью В1 и с неспособностью образовывать связи с тиаминпирофосфатом, также с нарушением фермента ПФП —» приводит к недостатку восстановленных НАДФН, способствует развитию гемолитической анемии, после приема пациентами препаратов, действующих как оксиданты: сульфаниламиды, аспирин.
Таким образом, в результате может генерироваться 12 молекул НАДФН в расчете на каждую молекулу глюкозо-6-фосфата, которая полностью окисляется до СО
2.
3. когда потребность в биосинтезе рибозо-5-фосфата значительно превышает
потребность в НАДФН активна только неокислительная ветвь.
В таких условиях фруктозо-6-фосфат и глицероальдегид-3-фосфат (из гликолиза) превращается в рибозо-5-фосфат без образования НАДФН.
4. рибозо-5-фосфат, образованный по окислительной ветви, также может превращаться в
пируват через фруктозо-6-фосфат и глицероальдеигд-3-фосфат. При этом генерируется
АТФ и восстановленный НАДФ.Глюконеогенез.
Глюконеогенез включает все механизмы и пути, обеспечивающие биосинтез глюкозы из не углеводных предшественников. Главное из них это лактат, гликогенные аминокислоты и глицерол, у жвачных животных - это пропионат. Происходит главным образом в клетках печени и почках.
Биомедицинское значение.1. глюконеогенез играет важную роль, поскольку некоторые ткани, прежде всего мозг, и
эритроциты в высшей степени зависят от глюкозы, как от первичного топлива. При
понижении концентрации глюкозы ниже определенного критического уровня
нарушается функционирование мозга, т.е. при тяжелой гипогликемии возникает
коматозное состояние и возможен летальный исход.
Дневная потребность глюкозы - 160г, из них 120г идет на работу мозга, в жидкостях тела присутствуют =20г, 190г глюкозы может быть получено из запасов гликогена. Таким образом прямые резервы организма вполне обеспечивают суточную потребность человека в глюкозе
глюконеогенез обеспечивает потребности организма в глюкозе в тех случаях, когда
диета содержит недостаточное количество углеводов
важную роль играет в период интенсивной физической нагрузки, поскольку является
путем удаления избыточного лактата из скелетных мышц и эритроцитов, а также
глицерол а из клеток жировой ткани.
Основные метаболические пути глюконеогенеза.Основные биохимические реакции глюконеогенеза не являются обращением реакций гликолиза.
Не совпадение прямых и обратных реакций многих жизненно важных метаболических путей - это один из основополагающих принципов организации метаболизма, который позволяет осуществлять строгую регуляцию направленности биохимических процессов. Практически всегда, когда активность прямого пути высока, активность обратного находится на минимальном уровне.
В обычных условиях,
существующих в клетках, свободная энергия, необходимая для образования пирувата из глюкозы составляет1О ккал/моль. Уменьшение свободной энергии при гликолизе происходит в основном в участках трех необратимых реакций, катализируемых гексокиназой, фосфофруктокиназой и пируваткиназой. Т.е. это 3 обходных пути гликолиза.
Глюконеогенез обходит эти необратимые реакции при помощи следующих новых этапов:
1. фосфоенолпируват образуется из пирувата через оксалоацетат,
а), пируват + АТФ +CO
2 + H
2O оксалоацетат + АДФ + Фi +2H*
б), оксалоацетат + ГТФ —> фосфоенолпируват + ГДФ + СО
2,
Реакция а), протекает в митохондриях и нуждается в биотине, который ковалентно связан с ферментом.
Этот комплекс является мобильным переносчиком активированного СО
2, . Далее оксалоацетат переходит в цитозоль в форме малата по челночному механизму.
фруктозо-6-фосфат образуется из фруктозо-1,6-БФ путем гидролиза фосфатного
эфира в положении 1
собственно глюкоза образуется путем гидролиза глюкозо-6-фосфат с
одновременным образованием неорганического фосфора.
Большинство аминокислот, входящих в состав белков, способны метаболизироваться в глюкозу, и называются глюкогенными, некоторые из них превращаются в кетоновые
тела - это кетоновые кислоты. Существует несколько семейств, объединенных по тому принципу в какой метаболит они преобразуются. Например, в пируват способны переходить Ala, Ser, Gly, Cys, Tre.
α-оксоглутарат Glu, Gin, His, Pro, Arg
сукцинил - KoA—► He, Met, Tre, Val
фумарат Туг, Phe, Asp
оксалоацетат Asp, Asn.
Лактат, образованный сокращающейся мышцей, превращается в печени в глюкозу (цикл Кори)
Основным метаболитом для глюконеогенеза является лактат, образованный активной скелетной мышцей, при этом единственная цель восстановления пирувата до лактата - это регенерирование окисленных НАД, необходимых для осуществления гликолиза в сокращающихся мышцах. Полученный лактат - это тупик в метаболизме. Для дальнейшего его превращения он должен быть снова восстановлен в пируват. Плазматические мембраны большинства клеток обладают высокой проницаемостью для лактата и пирувата. Оба соединения диффундируют из активной скелетной мышцы в кровь и переносятся в печень. Значительно больше переносится лактата.
Окислительно-восстановительную реакцию преобразования лактата в пируват, и наоборот, катализирует фермент-лактатдегидрогеназа, который представляет собой тетрамер, построенный из двух типов ППЦ (тип М и Н). засчет этого могут быть образованы 5 различных тетрамеров (М4 (al , ЛДГ1 ); М ЗН1 (ЛДГ2 , а2 ); М2Н2 (ЛДГЗ, р); М1НЗ (у, ЛДГ4 ); Н4 (у2 , ЛДГ5 ).
Изофермент М4 обладает большим сродством к пирувату, чем Н4, остальные занимают промежуточное положение.
При инфаркте миокарда повышено содержание а — изомеров, особенно а1. Увеличивается соотношение ЛДГ1 и ЛДГ2. аналогичные нарушения возникают при инфаркте коркового вещества почек и гемолитической анемии. Относительное увеличение ЛДГ4 и ЛДГ5 имеет место при остром гепатите, тяжелых мышечных повреждениях.
Обмен гликогена.Гликоген - это главная легко мобилизуемая форма запасания углеводов у животных и человека.
Гликоген в печени приблизительно 4 %, 72г; в мышцах 0,7%, 245-250г. Внеклеточная глюкоза - 0,1% или Юг, общие запасы - 327-332г.
Биомедицинское значение.1. легко доступный источник глюкозы, используемый в ходе гликолиза в мышцах.
Гликоген печени необходим главным образом для поддержания физиологической
концентрации глюкозы в крови, главным образом в период между приемами пищи.
2. охарактеризованы некоторые дефекты ферментов, которые приводят к
нарушениям обмена гликогена.
Главным образом различают болезни, связанные с накоплением гликогена.
Биосинтез гликогена.Реакции синтеза гликогена - это не обращение реакции его расщепления. Биосинтез гликогена осуществляется из активированной глюкозы, которая образуется в результате реакции. Глюкозо-1-фосфат + УТФ —> УДФ - глюкоза + пирофосфат. Пирофосфат (PPi) 2Pi
Эта реакция равно как и многие другие реакции биосинтеза запускаются гидролизом пирофосфата. На следующем этапе происходит образование связи а-1,4-гликозидгликозной в молекуле гликогена, которая последовательно удлиняется на 1 глюкозный остаток. Присоединение уридиндифосфатглюкозы осуществляется с невосстанавливающего конца цепи молекулы гликогена (С4). Таким образом, для процесса биосинтеза нужна «гликогеновая» затравка.
Реакция катализируется ферментом - гликогенсинтазой. Этот фермент катализирует только образование а-1,4-связи, для образования а-1,6 необходим специальный ветвящий фермент.
Распад гликогена. Открыт Карлом и Кори.
Гликоген расщепляется ортофосфатом с образованием глюкозо-1-фосфата. Гликоген + Pi —»гликоген (n-1) + глюкозо-1-фосфат
Процесс называется фосфоролиз. Для распада гликогена необходим также фермент, разрывающий связи в точках ветвления, это α-1,6-глюкозидаза.
Особенности фосфоролиза в мышцах.
Весь процесс фосфоролиза гликогена в мышцах, ориентирован на быстрое извлечение энергии и называется гликогенолизом.
Первая реакция фосфоролиза дает нам получение фосфорилированной глюкозы без затрат энергии АТФ. Фосфорилаза скелетных мышц существует в двух взаимопревращающихся формах (Р-неактивная, А-активная)
B неработающей мышце почти вся фосфорилаза неактивна, в работающей в форме а. Ее повышенное
содержание связано с действием адреналина, некоторых других гормонов, электростимуляции мышц. Гликоген является очень эффективной резервной формой глюкозы. Обычно 90% подвергается фосфоролитическому распаду до глюкозо-1-фосфата, который без затрат энергии превращается в гюкозо-6-фосфат. Остальные 10% принадлежат ветвям и расщепляются гидролитически. Подсчитано, что общая эффективность запасания энергии составляет 97%.
Циклический аденозинмонофосфат (цАМФ) - занимает центральное положение в координированном контроле синтеза и распада гликогена.
На обмен гликогена значительное влияние оказывают специфические гормоны:
инсулин повышает способность печени синтезировать гликоген,
адреналин и глюкагон активируют реакции распада гликогена, при этом адреналин
действует главным образом на процессы в мышцах, а глюкагон в печени.
Установлено, что действие адреналина и глюкагона на метаболизм обусловлено цАМФ.
Синтез цАМФ из АТФ катализируется аденилатциклазой, которая связана с
цитоплазматической мембраной.
Существует определенная взаимосвязь между гормонами и обменом гликогена:
адреналин связывается с плазматической мембраной мышечной клетки и
стимулирует аденилатциклазу,
аденилатциклаза катализирует в плазматической мембране образование цАМФ из
АТФ,
повышенное внутриклеточное содержание цАМФ активирует протеинкиназу (это
аллостерическая стимуляция),
зависимая от цАМФ протеинкиназа фосфорилирует киназу фосфорилазы и
гликогенсинтазу. Фосфорилирование этих двух ферментов лежит в основе
координированной регуляции синтеза и распада гликогена.
В сущности регуляция метаболизма гликогена отражает также регуляцию концентрацию глюкозы в крови. Кроме инсулина, адреналина и глюкагона в ней принимают участие гормоны передней доли гипофиза: кортикотропин, гормон роста, которые действуют противоположно инсулину.
Глюкокортикостероиды, которые синтезируются в коре надпочечников играют важную роль в обмене углеводов. Усиливают глюконеогенез за счет мобилизации аминокислот, они также ингибируют утилизацию глюкозы во внепеченочных тканях, являются антогонистами инсулина. В случае нарушений функций щитовидной железы может иметь место высокий уровень образования тироксина, который обладает диабетическим действием: гликоген отсутствует в печени при тиреотоксикозах.
Обмен фруктозы и галактозы.Все реакции метаболизма этих соединений сводятся главным образом к образованию глюкозы. Также галактоза после взаимодействия с УТФ образует активированную УДФ - галактозу, которая при взаимодействии с глюкозой образует дисахарид лактозу и УДФ. Некоторые моносахариды служат предшественниками образования аминосахаров, которые являются важными компонентами гликопротеинов, некоторых гликосфинголипидов, например, ганглиозиды, и глюкозаминогликанаты, наиболее важное значение имеет глюкоза, галактоза, маннозамин, а также углерод9-соединения-сиаловая кислота.
Некоторые другие клинические аспекты нарушения углеводного обмена: Лактоацидоз может быть вызван комплексованием сульфигдрильных групп липоевой кислоты, тяжелыми металлами и арсенатами.
Также он вызывается недостатком В1 , мутацией перуватдегидрогеназы.
Существует также гипо- и гиперсостояния, связанные с глюкозой, фруктозой,
галактозой.
Болезни, связанные с накаплением гликогена (гликогенозы).
Обмен липидов.  Скачать 1.05 Mb.
Скачать 1.05 Mb.