Лекции по медицинской химии. Лекции по медицинской химии
 Скачать 400.78 Kb. Скачать 400.78 Kb.
|
14 Смесь реагентовСмесь реагентов Второй синтетический подход, названный методом “смесь реагентов”, предполагает использование избытков реагентов в отношении каждой реакционного цента на твердофазном субстрате. Применение таких смесей реагентов требует полного знания механизма и кинетики процессов, используемых в выполняемых реакциях. Большой избыток поступающих реагентов используется для того, чтобы наблюдалась реакция кинетики псевдопервого порядка. Однако этот подход имеет существенные ограничения. Очень важно, чтобы относительные скорости реакций вводящихся реактивов были приблизительно равными, т.е эти реагенты должны иметь примерно равную нуклеофильность и отсутствие стерических помех. Такие требования довольно трудно выполнять. Тем не менее было обнаружено, что эта концепция хорошо применима к синтезу гетероциклических библиотек типа циклической мочевины и тиомочевины. 15 ФотолитографияФотолитография Фотолитография – это техника для миниатюризации комбинаторного синтеза. В синтезе пептидов поверхность твердой подложки состоит из аминогрупп, защищенных фотолабильной нитровератрилоксикарбонильной защитной группой (NVOC). Используя маску – защищая часть поверхности от облучения светом, удается снять защиту в экспонированной области. После этого плата обрабатывается аминокислотой и в результате реакция протекает только в той области на плате, где предварительно была снята защита. Плата затем промывается для удаления избытка аминокислоты. Затем процесс может повторен в другой области платы, используя другую маску и таким образом различные пептидные цепи могут быть построены на различных частях платы, последовательность которых известна по записям на используемых масках. Затем проводится инкубация платы с белком рецептора, для определения активного соединения, которое закреплено в соответствующем положении платы. Удобный метод для осуществления этого процесса – это использование платы с флуресцентно-меченым рецептором. В этом случае только в присутствия активного соединения будет наблюдаться флуоресценция. Интенсивность флуоресценции может быть измерена методом флуоресцентной микроскопии и, таким образом, можно определить сродство синтезированного соединения к рецептору. Альтернативным способом может быть использование радионуклидов или хемолюминисценции. Возможности этого метода очень высоки. При 20-микронном разрешении может быть приготовлена плата, на которой находится 250 000 различных соединений на квадратном сантиметре.  В случае пептидного синтеза общие операции, такие как снятие защиты и промывание, производятся путем погружения платы в большие бани, но связывание производится в ячейках, таким образом, чтобы каждая ячейка содержала уникальную аминокислоту. Добавление реагента и удаление его избытка, а также нагревание и охлаждение реакционных смесей, может осуществляться автоматически. Такие синтезаторы подходят как для множественного параллельного синтеза индивидуальных соединений, так и для параллельного синтеза смесей, содержащих различные, но структурно подобные соединения. 16 РазверткаРазвертка – выделение активных соединений из смеси Показав, что смесь соединений обладает биологической активностью, необходимо идентифицировать наиболее активные компоненты. Выделение и идентификация активных соединений называется разверткой. Вот некоторые методы этой процедуры: Микроманипуляция Каждый гранула в смеси содержит только один тип продукта. Следовательно, индивидуальная гранула может быть отделена, продукт очищен и затем протестирован. Эту процедуру можно осуществить методом калориметрического анализа, которым продукты тестируются на активность. Активные гранулы отличаются по цветным реакциям и могут быть выбраны путем микроманипуляции (ручным способом). Обратная развертка Микроманипуляция имеет серьезные трудности и возможности ошибок, в том случае когда имеет дело с большими количествами гранул. Для уменьшения объема работ в этом случае можно применить метод, известный как обратная развертка. Его можно проиллюстрировать на примере библиотеки трипептидов, которая описана ранее. В этом примере было синтезировано три смеси. Было предположено, что одна из них имеет активный компонент. Как найти, какой из девяти возможных трипептидов обладает активностью? Мы можем синтезировать отдельно все девять пептидов и проверить на активность каждый из них. Однако, можно сократить объем работы, если сохранить образцы димерных смесей, полученных в процессе комбинаторного синтеза. Предположим, что третья смесь трипептидов, описанных ранее, показывает активность. Это значит, что активный трипептид имеет валин на конце цепи. На следующей стадии возьмем три дипептидных смеси, которые мы сохранили и проведем связывание каждой из их с валином. В этом случае мы получим девять трипептидов разделенных на три отдельных смеси. Теперь нам известны вторая и третья аминокислота в каждой смеси. Все три смеси снова протестируем на биологическую активность. Если одна из них проявляет активность, мы можем знать последовательность в ней второй и третьей аминокислоты. Предположим, что смесь содержащая Ala и Val является активной смесью. Тогда мы можем синтезировать индивидуально уже не девять, а только три трипептида, находящиеся в этой смеси и, проведя тест, определить активное соединение.  Применение метода смешивания и разделения вместе с методом обратной развертки дают значительную экономию объема работ. Последовательное разделение Линкеры являются устройством, которое позволяет отделить определенную долю продукта от гранулы. Если смесь активна, то она может быть разделена на меньшие по составу смеси и конечный продукт может быть отделен от гранул и протестирован. Этот процесс может быть повторен несколько раз, до тех пор пока не идентифицируется активная гранула. Определение строения активного соединения Прямое определение строения компонентов в смеси является непростой задачей. Однако имеются успехи в определении строения продуктов, связанных с гранулой смолы, методами ЯМР, КР-, ИК- и УФ-спектроскопии. В случае пептидов может быть применено пептидное секвенирование для определения последовательности, в которой пептиды соединены с гранулой. Каждая гранула диаметром 0,1 мм содержит приблизительно 100 пикомолей пептида, которое достаточно для микросеквенирования. В случае непептидов, определение строения активного соединения может быть достигнуто обратной разверткой, описанной ранее. Однако, это очень утомительный процесс. Альтернативным подходом может быть метод прикрепления меток (tags). Прикрепление меток В этом процессе две молекулы связываются с одной гранулой. Одна из них – новая структура, которая тестируется, тогда как другая является молекулярной меткой (обычно пептид или олигонуклеотид). Эта метка ведет себя, как код для каждой стадии синтеза. В этом процессе гранула должна иметь множественный линкер, способный связываться как с синтезируемой структурой, так и с молекулярной меткой. Реагент присоединяется к одной части линкера, а закодированная аминокислота (или нуклеотид) – к другой части. После каждой последующей стадии комбинаторного синтеза, аминокислота или нуклеотид добавляется к метке, чтобы показать, какой регент применялся. В качестве примера множественного линкера может привести так называемый safety catch linker (SCAL), который включает в себя остатки лизина и триптофана.  Синтезируемое соединение связывается с триптофановым остатком, а после каждой стадии синтеза меченая аминокислота соединяется с лизиновым остатком и, таким образом, в конце синтеза присутствует трипептид, в котором каждая аминокислота определяет идентичность изменяемых R, R’, R” в непетидной структуре. Непептидная структура может быть разрушена восстановлением двух сульфоксидных групп в SCAL, который затем взаимодействует с кислотой. В этих условиях порядок трипептидых остатков, соединенных с гранулой, остается неизмененным и может быть установлен для идентификации строения соединения, которое было отделено от гранулы.  Подобная стратегия может быть использована с олигонуклеотидами вместо меченой молекулы. Кодировочные таблицы Разработан метод, который позволяет осуществить разделение индивидуальных твердофазных продуктов, включающий в себя расшифровку кода для определения синтетической истории. Гранулы смолы закрепляются между двумя плетеными листами из инертного полипропилена. Эти листы могут быть промаркированы в виде квадратов и каждый квадрат получает кодировку в виде трех букв. Для примера на рисунке приведены три таких листа размером 6 на 6 см, которые имеют девять маркированных квадратов, каждый из которых получил трехбуквенный код. Эти три листа разделяются и каждый из них обрабатывается аминокислотой. В результате все гранулы верхнего листа связываются с лейцином, все гранулы второго листа связываются с серином, а все гранулы нижнего листа связаны с глицином. Все листы затем промываются, сушатся и обрабатываются пиперидином для удаления Fmoc защитной группы. 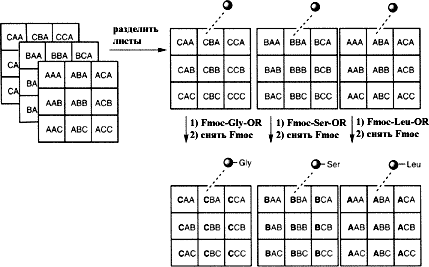 На второй стадии листы разрезаются на три колонки. Каждая колонка обрабатывается затем другой аминокислотой активированной Fmoc и, таким образом, генерируется уникальный дипептид на каждой колонке материала. 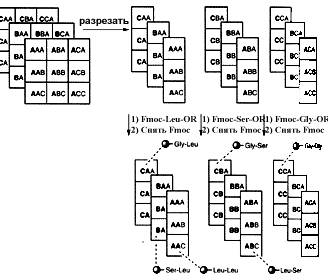 Эти колонки обрабатываются для отделения Fmoc защитной группы. После этого колонки разрезаются на индивидуальные квадраты. Таким образом получаются три набора квадратов. Каждый из этих квадратов обрабатывается третьей аминокислотой и, таким образом, синтезируется 27 возможных трипептидов. Каждый из квадратов содержит уникальный трипептид, который идентифицируется с помощью трехбуквенного кода, имеющегося на каждом квадрате. Ограничения комбинаторного синтеза В принципе, комбинаторный синтез позволяет синтезировать все 10 240 миллиардов возможных декапептидов. Однако имеются ограничения и, прежде всего, практические требования по весу и объему. Прежде всего нужно ответить на вопрос: сколько гранул необходимо для комбинаторного синтеза. По статистическим причинам число гранул должно превышать число целевых молекул в десять раз. Таким образом необходимо использовать избыток гранул. И для того, чтобы сделать полную библиотеку дипептидов необходимо использовать их весом 8,4 мг. Для создания полной библиотеки тетрапептидов необходимо иметь 3,4 г каждого. Однако, для того чтобы сделать полную библиотеку декапептидов вам необходимо 215,3 тонны. |
