Лекции по медицинской химии. Лекции по медицинской химии
 Скачать 400.78 Kb. Скачать 400.78 Kb.
|
7 Жидкофазный синтезЖидкофазный синтез Преимущества: Жидкофазный синтез возможен при использовании всех известных синтетических методов без каких либо ограничений Реакция проходит в гомогенных условиях Можно легко использовать нагревание Реакцию можно контролировать Возможна очистка и анализ продуктов реакции на каждой стадии Недостатки: После окончания реакции все целевые соединения и побочные продукты находятся в смеси и требуется их разделение При использовании избытка реагентов, для достижения хороших выходов продуктов, эти реагенты необходимо тщательно очищать В том случае, если реагенты, продукты и побочные соединения невозможно перегнать или они не выпадают в осадок, их можно разделить или очистить только экстракцией или хроматографически, что обычно требует большого времени Автоматизация процессов очистки соединений в растворе весьма затруднительна Процессы создания библиотек путем реакций в растворе делятся на параллельный синтез и синтез смесей. Параллельный синтез протекает как обычные реакции, только их много, и они идут одновременно в отдельных реакционных сосудах. В этом случае в конце превращения регенты и побочные продукты летучи, их выпаривают. Если это невозможно, иногда используют кислотно-основную экстракцию или колоночную хроматографию. Это обычно затруднительно при наличии большого числа получаемых соединений. Все это приводит к тому, что жидкофазный способ создания библиотек относительно мало распространен. 8 Твердофазный синтезТвердофазный синтез В органической химии нет ни одной реакции, обеспечивающей на практике количественные выходы целевых продуктов в любом случае. Единственное исключение составляет, по-видимому, полное сжигание органических веществ в кислороде при высокой температуре до СО2 и Н2О. Поэтому очистка целевого продукта является сложной и трудоемкой задачей. Например, 100%-ная очистка продуктов пептидного синтеза является трудноразрешимой проблемой. Действительно, первый полный синтез пептида, гормона окситоцина (1953 г), содержащего всего 8 аминокислотных остатков, рассматривался как выдающееся достижение, принесшее его автору, В. дю Виньо, Нобелевскую премию 1955 г. Однако уже в следующие двадцать лет синтезы полипептидов подобной сложности превратились в рутину, так что в настоящее время синтез полипептидов, состоящих из 100 и более аминокислотных остатков, уже не рассматривается как непреодолимо трудная задача. Что вызвало столь драматические изменения в области синтеза полипептидов? Дело в том, что в начале 60-х годов был предложен новый подход к решению проблем выделения и очистки, возникающих в пептидном синтезе. Позже автор открытия этого подхода, Р.Б. Меррифилд, в своей Нобелевской лекции рассказал, как это произошло: “Однажды у меня возникла мысль о том, как может быть достигнута цель более эффективного синтеза пептидов. План состоял в том, чтобы собирать пептидную цепь постадийно, причем во время синтеза цепь должна быть одним концом привязана к твердому носителю”. В результате выделение и очистка промежуточных и целевых производных пептидов сводились просто к фильтрованию и тщательной промывке твердого полимера для удаления всех избыточных реагентов и побочных продуктов, остающихся в растворе. Такая механическая операция может быть выполнена количественно, легко стандартизируется и может быть даже автоматизирована. Рассмотрим эту процедуру более подробно. Полимерный носитель в методе Меррифилда – это гранулированный сшитый полистирол, содержащий хлорметильные группы в бензольных ядрах. Эти группы превращают полимер в функциональный аналог бензилхлорида и сообщают ему способность легко образовывать сложноэфирные связи при реакции с карбоксилат-анионами. Конденсация такой смолы с N-защищенными аминокислотами ведет к образованию соответствующих бензиловых эфиров. Удаление N-защиты из дает С-защищенное производное первой аминокислоты, ковалентно связанное с полимером. Аминоацилирование освобожденной аминогруппы N-защищенным производным второй аминокислоты с последующим удалением N-защиты приводит к аналогичному производному дипептида также привязанному к полимеру: 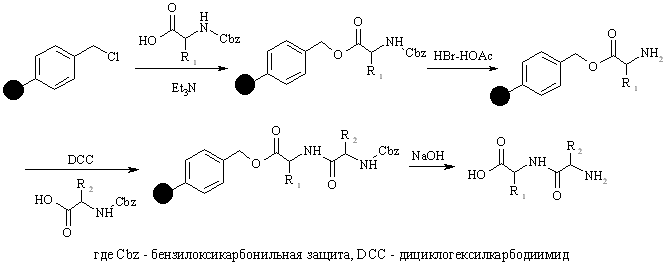 Такой двустадийный цикл (удаление защиты-аминоацилирование) может быть, в принципе, повторен столько раз, сколько требуется для наращивания полипептидной цепи заданной длины. Использование твердого носителя само по себе еще не может упростить решение проблемы отделения n-звенного пептида от его (n-1)-членного предшественника, поскольку оба они привязаны к полимеру. Однако этот подход позволяет безопасно использовать большие избытки любого реагента, необходимые для достижения практически 100%-ной конверсии (n-1)-членного предшественника в n-членный пептид, так как привязанные к носителю целевые продукты на каждой стадии могут быть легко и количественно освобождены от избыточных реагентов (что было бы весьма проблематично при работе в гомогенных системах). Сразу же стало понятно, что возможность очистки продукта после каждой реакции путем простого фильтрования и промывки, и то, что все реакции можно проводить в одном реакционном сосуде, составляют идеальные предпосылки для механизации и автоматизации процесса. Действительно, всего три года потребовалось для разработки автоматической процедуры и аппаратуры, позволяющих выполнять программируемый синтез полипептидов с заданной последовательностью аминокислотных остатков. Первоначально и сама аппаратура (емкости, реакционные сосуды, шланги), и система управления были очень примитивны. Тем не менее, мощь и эффективность общей стратегии были убедительно продемонстрированы рядом пептидных синтезов, выполненных на этом оборудовании. Так, например, с помощью такой полуавтоматической процедуры был успешно выполнен синтез природного гормона инсулина, построенного из двух полипептидных цепей (состоящих из 30 и 21 аминокислотных остатков), связанных дисульфидным мостиком. Твердофазная техника приводила к существенной экономии труда и времени, необходимых для пептидного синтеза. Так, например, ценой значительных усилий Хиршмен с 22 сотрудниками завершили выдающийся синтез фермента рибонуклеазы (124 аминокислотных остатка) с помощью традиционных жидкофазных методов. Почти одновременно тот же белок был получен путем автоматизированного твердофазного синтеза. Во втором случае синтез, включающий 369 химических реакций и 11 931 операцию, был выполнен двумя участниками (Гатте и Меррифилд) всего за несколько месяцев (в среднем до шести аминокислотных остатков в день присоединялись к растущей полипептидной цепи). Последующие усовершенствования позволили построить полностью автоматический синтезатор. Метод Меррифильда и послужил основой для нового направления органического синтеза – комбинаторной химии. Хотя иногда комбинаторные эксперименты проводятся в растворах, но в основном, они осуществляются с использованием твердофазной техники – реакции протекают с использованием твердых подложек в виде сферических гранул полимерных смол. Это дает ряд преимуществ: Различные исходные соединения могут быть связаны с отдельными гранулами. Затем эти гранулы смешиваются и, таким образом, все исходные соединения могут взаимодействовать с реагентом в одном эксперименте. В результате продукты реакции образуются на отдельных гранулах. В большинстве случаев, смешивание исходных в традиционной жидкой химии приводит обычно к неудачам – полимеризации или осмолению продуктов. Эксперименты на твердой подложке исключают эти эффекты. Поскольку исходные материалы и продукты связаны с твердой подложной, то избыток реагентов и не связанных с подложкой продуктов можно легко отмыть от полимерной твердой подложки. Можно использовать большие избытки реагентов, для того чтобы провести реакцию до конца (больше, чем 99%), поскольку эти избытки легко отделяются. В случае использования низких объемов загрузок (менее 0,8 ммоль на грамм подложки) можно исключить нежелательные побочные реакции. Интермедиаты в реакционной смеси связаны с гранулами и их нет необходимости очищать. Индивидуальные гранулы полимера могут быть разделены в конце эксперимента и таким образом получаются индивидуальные продукты. Полимерная подложка может быть регенерирована в тех случаях, когда подобраны условия разрыва и выбраны соответствующие якорные группы – линкеры. Возможна автоматизация твердофазного синтеза. Необходимыми условиями проведения твердофазного синтеза, кроме наличия нерастворимой полимерной подложки, инертной в реакционных условиях, являются: Присутствие якоря или линкера – химической функции, обеспечивающей связь подложки с наносимым соединением. Он должен быть ковалентно связан со смолой. Якорь также должен являться реакционно-способной функциональной группой для того, чтобы субстраты могли взаимодействовать с ним. Связь, образующаяся между субстратом и линкером должна быть стабильна в условиях реакции. Должны существовать способы разрыва связи продукта или интермедиата с линкером. Рассмотрим подробнее отдельные компоненты твердофазного метода синтеза. |
