Лекции по медицинской химии. Лекции по медицинской химии
 Скачать 400.78 Kb. Скачать 400.78 Kb.
|
35 АгонистыАгонисты Молекула AMPA представляет собой аналог глутаминовой кислоты, в которой роль терминальной карбоксильной группы играет кислая гидроксиизоксазольная группа. Активность к соответствующему рецептору проявляет только S‑изомер AMPA, в то время как R‑изомер практически не активен. Замена атомов водорода метильной группы на галоген (-СF3, -CH2Cl) приводит к агонистам с активностью близкой к активности AMPA. Однако введение объемной третбутильной группировки приводит к потере агонистической активности по отношению к каинатному рецептору. Замена гидроксильной группы в изоксазоле на карбоксильную группировку приводит к пятикратному повышению активности как антагониста. К сильным агонистам AMPA относятся и природный β‑оксозиламино‑L‑аланин. 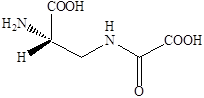 Структуры известных в настоящее время агонистов каиновых рецепторов довольно близки к самой каиновой кислоте. Интересным примером конструирования агониста AMPA каинатного рецептора является объединение в одной молекуле фрагмента AMPA и каиновой кислоты. Производные пролина обладают слабой агонистической активностью по отношению к рецептору AMPA, но также способно к связыванию с рецептором AMDA. 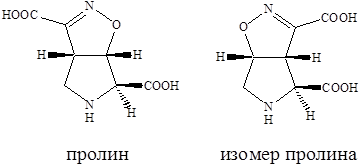 Изомер пролина является высоко аффинным и активным агонистом AMPA каинатных рецепторов, хотя, как можно было ожидать, и не слишком селективным по отношению к каждому из подтипов. Очень сильным и очень селективным лигандом каинатного рецептора является такое простое соединение как 4‑метилглутаминовая кислота, которая в 3000 раз более селективна к каинатному, чем к рецептору AMPA и в 200 раз более селективна к каинатному рецептору, чем рецептору NMDA. 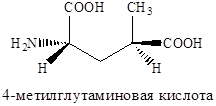 Структурные требования к выбору селективных агонистов сайта связывания глутаминовой кислоты AMPA каинатных рецепторов, отличающих их от таковых для рецепторов NMDA, не вполне ясны за исключением предпочтительности S‑конфигурации хирального аминокислотного центра. Антагонисты AMPA каинатных рецепторов В настоящее время неизвестны специфические сильные антагонисты каинатных рецепторов. В тоже время известны либо сильные, но неселективные, либо селективные, но слабые антагонисты рецепторов AMPA. Например, диэтиловый эфир L‑глутаминовой кислоты является слабым, но селективным неконкурентным агонистом рецепторов AMPA. Биоизостерическая замена терминальной карбоксильной группы L‑глутаминовой кислоты на динитрофенильную привела к высоко аффинным антагонистам рецепторов AMPA. Наличие свободных фенольных и аминогрупп важно для проявления активности, поскольку она резко уменьшается у кислород и азотзамещенных аналогов. Ситуация с селективными антагонистами для AMPA каинатных рецепторов резко отличается от таковой для рецептора NMDA, для которых изучено уже несколько поколений конкурентных антагонистов. 36 Метаботропные глутаматные рецепторыМетаботропные глутаматные рецепторы Семейство метаботропных глутаматных рецепторов было открыто совсем недавно. Активизация этих рецепторов приводит к запуску механизма с участием цепочки мембранных белков последовательно взаимодействующих друг с другом. На определенной стадии передача сигнала продолжается с помощью вторичных мессенджеров - молекул и ионов, которые в итоге вызывают изменения конфигурацию (конформацию) белков, участвующих в специальных клеточных процессах. Семейство метаботропных глутаматных рецепторов подразделяются на три группы в зависимости от аналогий в строении их аминокислотной последовательности, механизмов передачи сигнала и чувствительности к действию различных агонистов. Группа 1 принципиально отличается от групп 2 и 3. Взаимодействие агонистов с рецепторами группы 1 приводит к передаче возбуждения, а с группой 2 и 3 к блокированию возбуждения. Это лежит в основе стратегии поиска нейропротекторов, действующих на метаботропные глутаматные рецепторы. Физиологически активные соединения, взаимодействующие с серотониновым рецептором 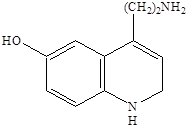 Серотонин или 5‑гидрокситриптамин (5НТ) является биогенным амином, образующимся в организме в результате превращения аминокислоты триптофана. Серотонин содержится в различных органах, тканях, тромбоцитах и в мозге. В нервной системе синтез серотонина происходит в цитоплазме нервных окончаний. Он накапливается в синаптических пузырьках, выделяется под влиянием нервных импульсов и взаимодействует со специфическими рецепторами, обозначаемыми как серотониновые (серотонин‑R‑ические). Серотониновые рецепторы содержатся в периферических тканях. Причем разделяются следующие подтипы: 5НТ1, 5НТ2, 5НТ3. 5НТ2 рецепторы содержатся в гладких мышцах стенок сосудов, в бронхах. 5НТ1 и 5НТ3 находятся в гладкой мускулатуре и в слизистой оболочке желудочно-кишечного тракта. 5НТ3 в центральной нервной системе и периферических тканях. Известно, что физиологическая роль серотонина в головном мозге человека заключается в регуляции различных психоэмоциональных реакций. Кроме того, серотонин участвует в контроле терморегуляции, процессов сенсорного восприятия, в частности чувствительности к боли. В последующие годы было показано, что нарушение обмена серотонина и функций серотониновых регуляторов имеют отношение к патогенезу наркомании, алкоголизма и т.д. Эти факты и явились причиной возросшего интереса к изучению химических соединений, участвующих в нейропередаче серотонина. Серотонин отличается чрезвычайно широким спектром биологической активности по отношению к центральной нервной системе и другим органам. С влиянием на биосинтез серотонина, его метаболизм и взаимодействие с рецепторами связан механизм действия ряда психотропных препаратов. Большая роль серотонину придается в механизме действия антидепрессантов. Серотониновые рецепторы представляют собой белковые молекулы, встроенные в плазматические мембраны клеток и трансформирующие молекулярный сигнал серотонина и его аналогов в специальный ответ клетки. Действие большинства соединений используемых для лечения различных умственных расстройств, ожирения, мигрени основана на их участии в серотонин‑R‑ической передаче. Эти вещества выступают в роли агонистов или антагонистов соответствующих рецепторов. Очевидно, что антагонисты не обладают внутренней активностью. Возможно также существование частичных агонистов, не способных произвести максимально активных рецепторов, а следовательно, и максимальный биологический ответ независимо от применяемого количества. Активация серотониновых рецепторов приводит к инициированию механизма с участием цепочки мембранных белков, последовательно взаимодействующих друг с другом. На определенной стадии передача сигнала продолжается с помощью вторичных мессенджеров («посыльные») – молекул или ионов, которые в итоге вызывают изменения конфигурации (конформации) белков, участвующих в специфических клеточных процессах. Открытие различных подтипов серотониновых рецепторов привело к осознанию того факта, что большинство из известных лекарственных соединений, влиящих на серотонин‑R‑ическую передачу, действуют одновременно на несколько подтипов 5НТ рецепторов. Например, 5НТ3 рецептор образует ионный канал и передает сигнал непосредственно от нервных клеток за счет возникновения тока ионов, поэтому разработка селективных лигандов, приводящих к более эффективному лечению с меньшими побочными эффектами была и есть задача номер один нервных болезней, не говоря уже о том, что разработка селективных лигандов может привести к созданию принципиально новых форм терапии. Серотониновые рецепторы найдены в высоких концентрациях в коре головного мозга, где, как полагают, они играют существенную роль в процессах возникновения эмоций. Лиганды, особенно агонисты, взаимодействующие с рецепторами были предложены в качестве терапевтических средств для лечения состояния страха, как обезболивающие средства и т.п. Простейшие структурные модификации молекулы серотонина – введение различных заместителей в бензольное кольцо или ограничение конформационной подвижности в боковой цепи молекулы – привели к нескольким высоко аффинным агонистам 5НТ1 рецепторов, например, 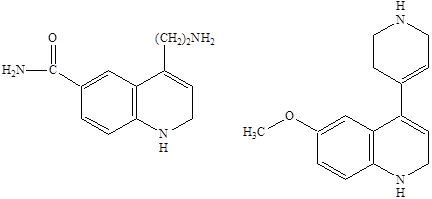 Однако указанные соединения как и сам серотонин не являются селективными и взаимодействуют с разными подтипами серотониновых рецепторов. 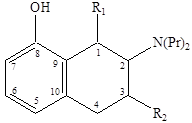 8‑гидрокси‑2‑дипропиламинотетралин оказался одним из наиболее активных селективных агонистов 5НТ1 рецепторов, причем полным агонистом является только (+)‑R‑энантиомер, который к тому же имеет приблизительно в двое большую активность. Основные закономерности «структура-свойства» для тетралинов следующие: 1) Наличие гидроксильной группы в положении 8 необходимо для связывания. Обеспечивает 500‑кратную селективность к серотониновым рецепторам по сравнению с дофаминами. 2) Наличие второй гидроксильной группы в положении 5 или 7 приводит к резкому снижению селективности. 3) Возможна замена гидроксильной группы на метокси (-OCH3) и ацильную и некоторые другие, но не на карбоксильную, без потери аффинности и селективности, хотя при этом иногда сильно уменьшается агонистическая активность. 4) Оптимальным для аффинности, селективности и агонистической активности является наличие двух пропильных заместителей у атома азота, хотя некоторая вариация заместителей, например, Pr заменить на ‑CH2-CH=CHI, тоже дает хороший результат и приводит к значительному улучшению связывания полученного лиганда с рецептором. 5) Введение небольших заместителей R1 и R2 = ‑CH3 приводит к существенным различиям в активности полученных соединений. 6) Переход к три и тетрациклическим структурам, например, апоморфин, привел к созданию селективных сильных агонистов 5НТ1 рецепторов. Основной проблемой в дизайне новых лигандов является обеспечение селективности, т.к. семейство серотониновых рецепторов характеризуется широким набором структурно похожих подклассов, и прогресс остается за рентгеноструктурными анализом, ибо только с его помощью можно уточнить компьютерные модели по докингу лидеров различных структурных классов. |
