Лекции Значение и функции белков. Строение и свойства аминокислот
 Скачать 4.99 Mb. Скачать 4.99 Mb.
|
|
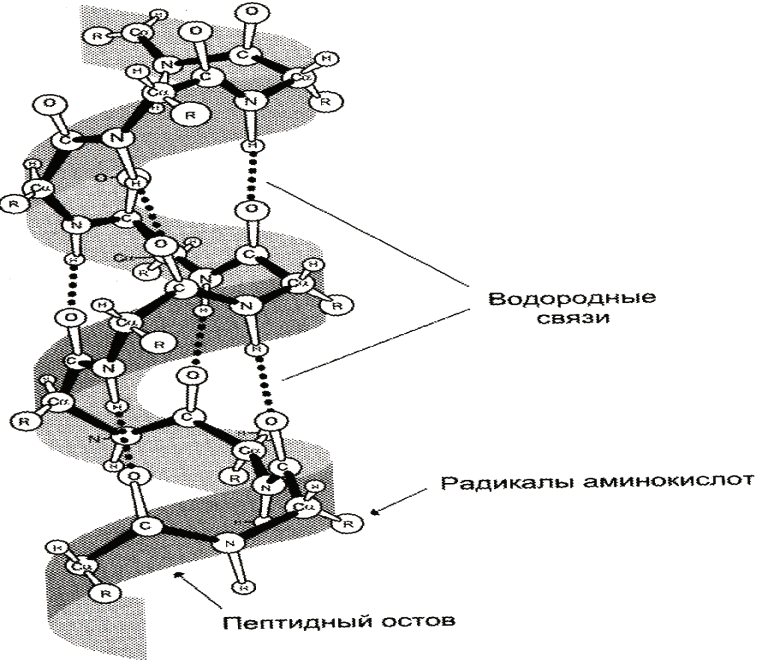
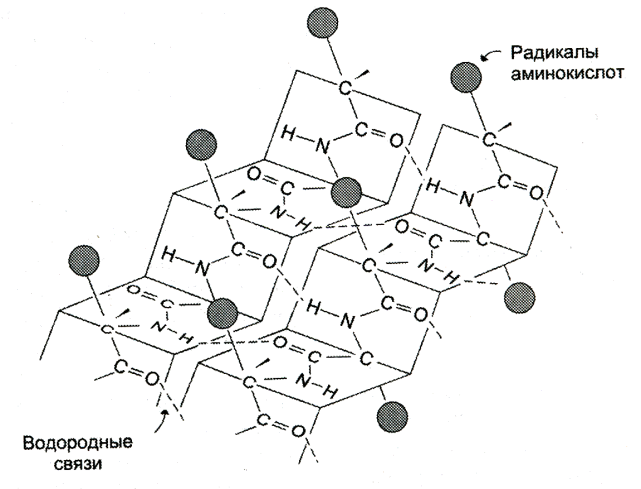
ТЕМА: СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. Цель изучения: знать уровни организации белковых молекул: первичную, вторичную, третичную и четвертичную структуру. Физико-химические свойства белков: поведение белков в растворах с различными значениями Рh, понятие об изоэлектирческой точке. Уметь: провести реакции высаливания, и денатурации в различных средах. Ответить: на контрольные вопросы к теме. Содержание темы Первичная структура каждого индивидуального белка матрицы закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на м-РНК, а затем, используя м-РНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка. Каждый белок организма человека имеет уникальную для него первичную структуру. При нарушении аминокислотной последовательности белков возникают многие генетические болезни. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания. Первичная структура белка – строго определенная последовательность остатков аминокислот в полипептидной цепи, образуемой за счет пептидных связей. Пептидные связи образуются при взаимодействии α – карбоксильной группы одной аминокислоты и α – аминогруппы от последующей аминокислоты. Пептидная связь – это амидная ковалентная связь, соединяющая аминокислоты в полипептидную цепочку. Следовательно, пептиды – это линейные полмеры из остатков аминокислот. В полипептидной цепи различают: N – конец, образованный свободной α – аминогруппой и С – конец, имеющий свободную α – карбоксильную группу. 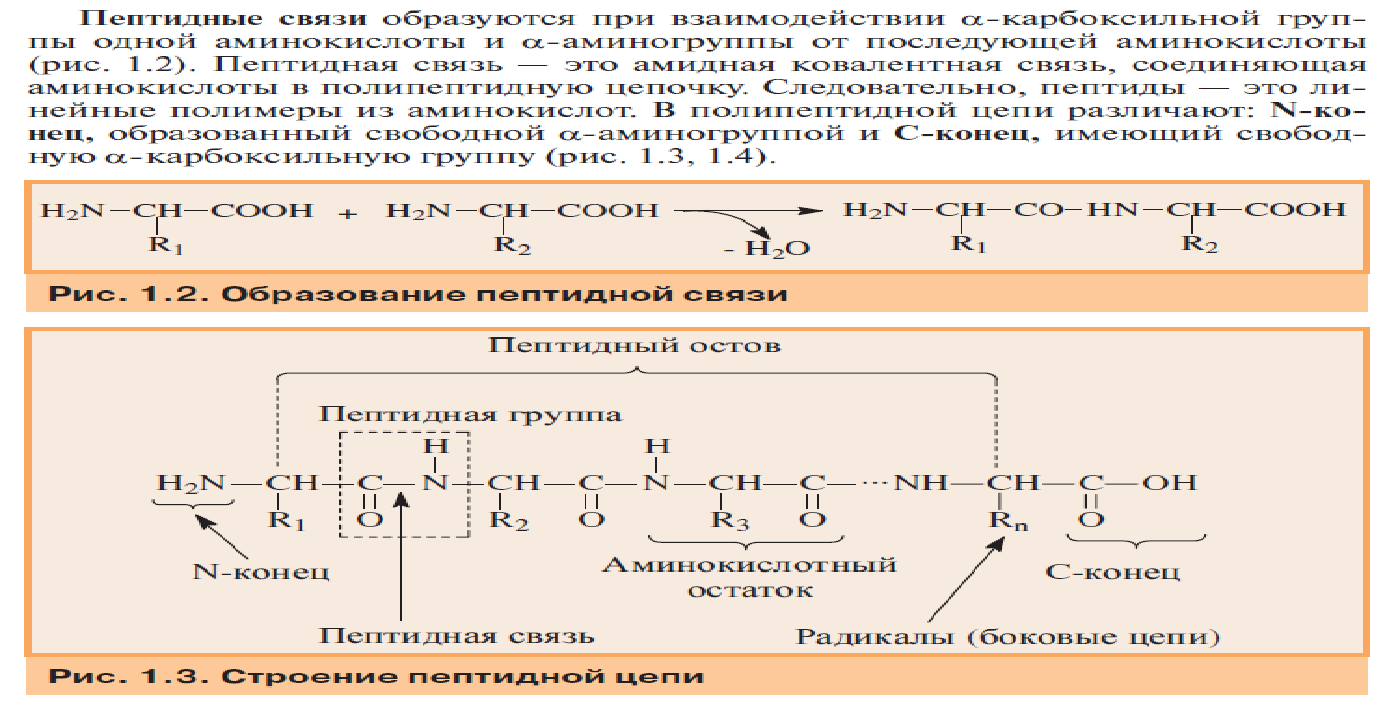 Мономеры аминокислот, входящие в состав полипептидов, называютаминокислотными остатками.Аминокислотный остаток, имеющий свободную аминогруппу, называютN-концевым и записывают слева пептидной цепи, а имеющий свободную α-карбоксильную группу – С-концевым, и записывают справа. Цепь повторяющихся атомов –СН – СО –NH– в полипетидной цепи называется пептидным остовом.Строго определенная последовательность аминокислот, связанных пептидными связями, образуетпервичнуюструктуру белка . ПЕПТИДЫ 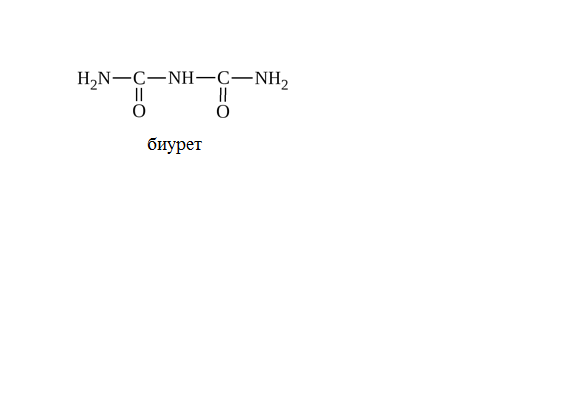 Ещё в 1888 году А.Я. Данилевский обратил внимание на способность белков давать своеобразную цветную реакцию при добавлении к раствору белка щелочи и раствора сульфата меди. Голубая окраска, характерная для раствора медного купороса, переходила в краснофиолетовую. В этих же условиях такое же изменение окраски давал биурет. Ещё в 1888 году А.Я. Данилевский обратил внимание на способность белков давать своеобразную цветную реакцию при добавлении к раствору белка щелочи и раствора сульфата меди. Голубая окраска, характерная для раствора медного купороса, переходила в краснофиолетовую. В этих же условиях такое же изменение окраски давал биурет.Реакция была названа «биуретовой». 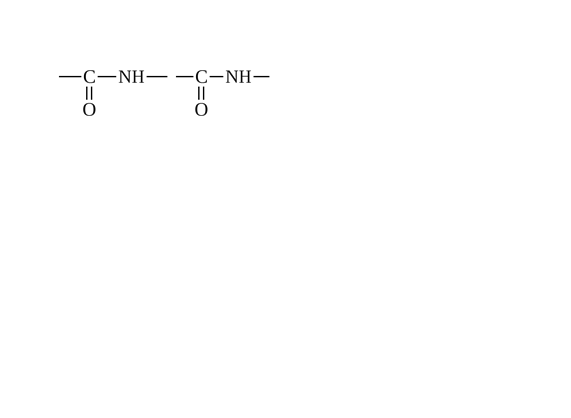 Было высказано предположение о том, что в белке должны существовать связи, подобные тем, которые имеются в биурете. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислотных остатков, называют− декапептид, образованный двумя аминокислотами, называется дипептид, несколькимиолигопептидами.Часто в названии таких молекул указывают число аминокислот, входящих в состав данного олигопетида: дипептид, трипептид, тетрапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют полипептидами. А полипептиды, содержащие более 50 аминокислотных остатков, обычно называют белками. Однако такие градации весьма условны: например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном. Гормоны окситоцин и вазопрессин содержат всего по 9 аминокислотных остатков. Полипептиды представляют собой линейные, довольно гибкие молекулы, а длинные цепи белков свернуты в клубок или иную структуру. Многие белки могут иметь в своем составе группы небелкового характера (простетические группы). Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот. Например, тетрапептиды это два разных пептида, несмотря на то, что они имеют одинаковый качественный и количественный состав.− сер-гис-про-ала и ала-гис-про-сер. В проявлении биологических функций пептидов и белков большую роль играет электронное и пространственное строение пептидной группы: 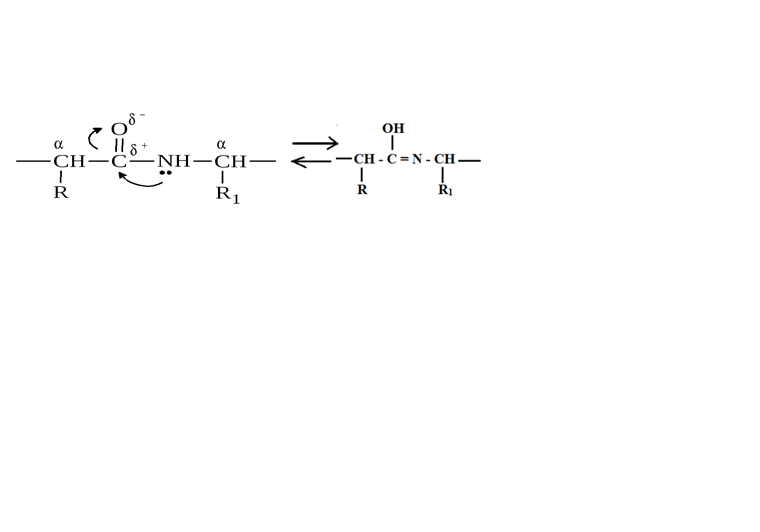 Частичная двоесвязанность связи С – N означает, что пептидная группа представляет собой плоский участок пептидной цепи. Плоскости пептидных групп расположены под углом друг к другу. Вокруг связей С – Сαи N– Сαвозможно вращение, хотя и ограниченное размерами и характером радикалов, что позволяет полипептидной цепи принимать различные конфигурации. Пептидная связь является единственной ковалентной связью, промежуточной между одинарной и двойной связью,при помощи которой аминокислотные остатки соединяются друг с другом, образуя остов белковой молекулы. Номенклатура пептидов. При названии полипептида к названию всех аминокислотных остатков, кроме последнего, добавляют суффикс -ил, концевая аминокислота имеет окончание -ин. Например, пептид мет-асп-вал-про имеет полное название метиониласпарагилвалилпролин. Вторичная структура–это пространственная структура, образующаяся в результате взаимодействий между функциональными группами. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-складчатая структура. 1. α-Спираль.Спираль определяется пространственным расположением следующих атомов аминокислот:ала, глу, глн, лей, лиз, мет и гис. Наиболее устойчивой из различных типов спиралей является правовращающая α-спираль, которая была впервые предложена в 1950 году Полингом и Кори на основании теоретических расчетов. α-Спираль может образоваться как из L-аминокислот, так и изD-кислот, но все аминокислоты спирали должны быть одного стереохимического ряда. В данном типе структуры пептидный остов закручивается в виде спирали за счет образования водородных связей между атомами кислорода карбонильных групп и атомами водорода аминогрупп, входящих в состав пептидных связей через четыре аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали -0,51нм, приходится 3,6 аминокислотных остатка, одна аминокислота занимает пространство 0, 15 нм. В образовании водородных связей участвуют практически все атомы кислорода и атомы водорода пептидных групп. В результате α-спираль стягивается множеством водородных связей. Несмотря на то, что водородные связи относят к числу слабых связей, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все карбонильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спирали уменьшается, а её гидрофобность растет. Врезультате образования α-спирали полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится. Поскольку α-спираль образована только из одного вида повторяющихся звеньев, её размеры довольно постоянны. Радикалы аминокислот находятся на наружной стороне α-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, но некоторые из них могут нарушать образование α-спирали. К ним относятся:гли, сер, асп, асн и про.Особая структура пролина нарушает образования α-спирали. 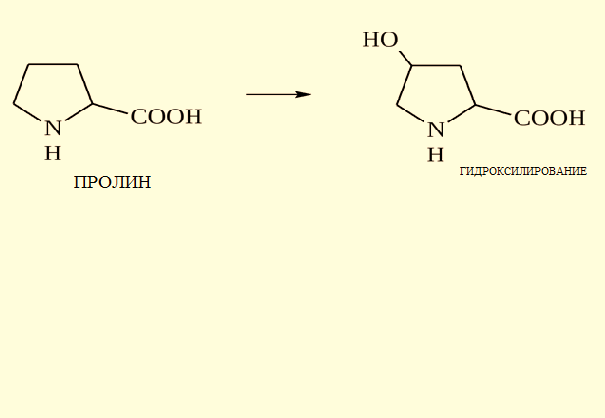 1) Пролин.У атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовывать водородную связь, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб.Его атом азота входит в состав жесткого кольца, что исключает возможность вращения вокруг связи N. 1) Пролин.У атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовывать водородную связь, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб.Его атом азота входит в состав жесткого кольца, что исключает возможность вращения вокруг связи N.2) Одинаково заряженные радикалы.Формирование α-спирали нарушается, если имеются участки, где последовательно расположены несколько радикалов, несущих одинаковый заряд. Между этими радикалами возникают электроста-тические силы отталкивания. 3) Объёмные радикалы.Участки с близко расположенными объёмными группами, например, изопропильная группа валина, изобутильная группа лейцина и др., по-видимому, ослабляют α-спираль из-за стерического отталкивания.Если бы α-спираль была единственным типом вторичной структуры белков, то все они были бы жесткими, палочковидными образованиями. Поскольку это не так, следует заключить, что α-спираль составляет лишь отдельные участки полипептидных цепей. 2. β-складчатая структура.Другим типом организации полипептидной цепи является, так называемый,β-складчатый листок.Эта конформация белка стабилизируется водородными связями междуразвернутымиполипептидными цепями (межцепочечные связи). Но водородные связи могут возникнуть и между линейными участками внутри одной полипептидной цепи. Такие связи называют «внутрицепочечными».
В β-структурах водородные связи расположены перпендикулярно полипептидной цепи. Если N- и С-концы полипептидных цепей совпадают (т.е. цепи направлены параллельно друг другу) в этом случае образовавшуюся структуру называют параллельным β-складчатым листком. Если же С-концы полипептидной цепи не совпадают сN-концами возникает антипараллельная β-структура. В отличие от α-спиралей, разрыв водородных связей, формирующих β-структуры, не вызывает удлинения полипептидных цепей. Как α-спираль, так и β-складчатый листок встречаются и в глобулярных, и в фибриллярных белках. Третичная структура – это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. При укладке полипептидная цепь белка стремится принять энергетически выгодную конформацию. Если белок растворим в воде, гидрофобные радикалы аминокислот объединяются внутри глобулы. Между ними возникают, так называемые, гидрофобные взаимодействия.Если эти радикалы близко прилегают друг к другу, между ними дополнительно возникают силы притяжения Ван-дер-Ваальса. В результате внутри молекулы формируется гидрофобное ядро.Гидрофильные радикалы стремятся образовать водородные связи с водой, и поэтому, в основном, располагаются на поверхности белковой молекулы. Но внутри гидрофобного ядра могут оказаться и гидрофильные группы пептидного остова. Эти гидрофильные группы взаимодействуют друг с другом с помощью ионных и водородных связей. Множество водородных связей, которые формировались ещё в момент образования вторичной структуры, исключают связывание гидрофильными группами молекул воды и препятствуют разрушению внутренней плотной структуры белка. Если белок функционирует в неполярном (липидном) окружении (например, белки мембран), он имеет обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, а гидрофобные локализованы на поверхности и контактируют с неполярной средой. Но во всех случаях радикалы аминокислот занимают энергетически наиболее выгодное положение. 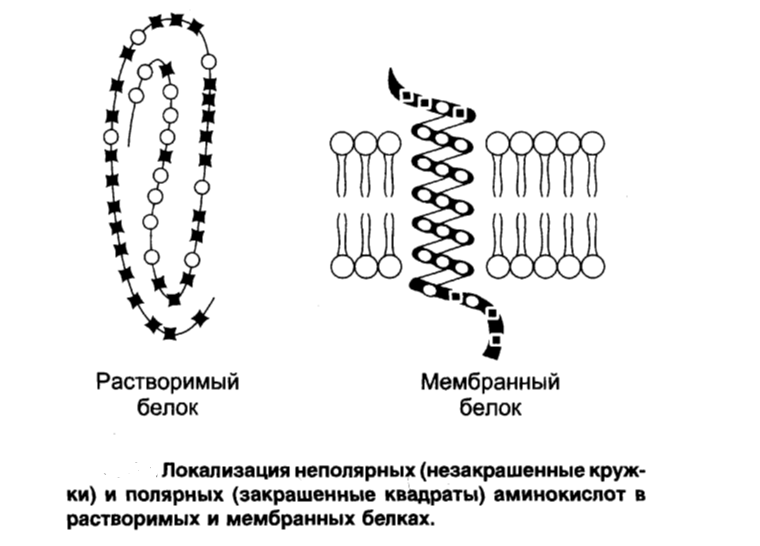 В формировании третичной структуры белка участвуют связи: 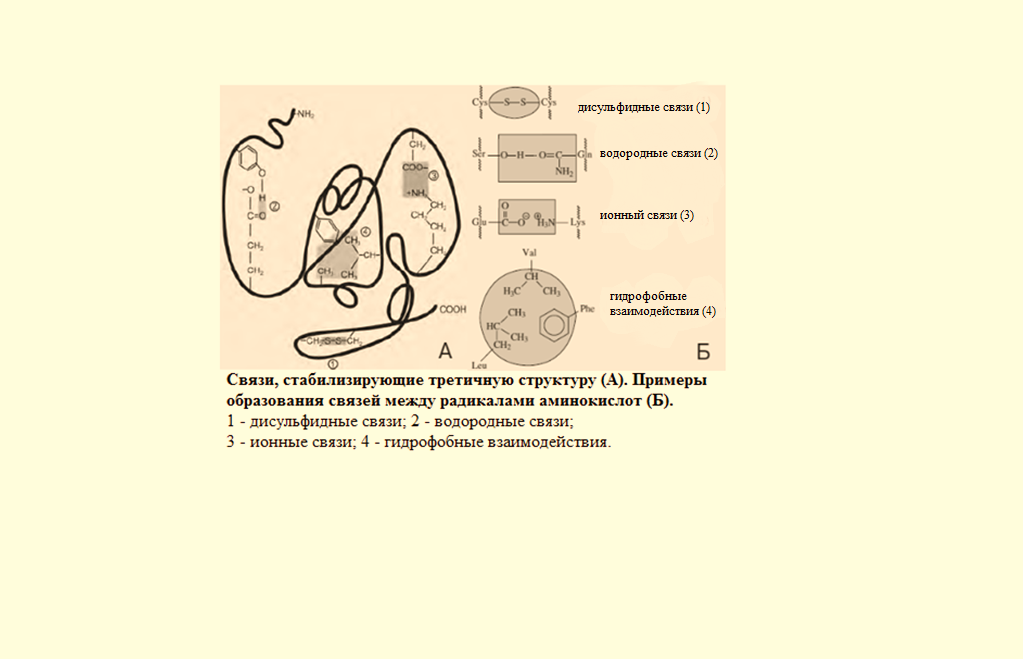 1) Ионныевозникают между отрицательно заряженными карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными группами радикалов лизина, аргинина и гистидина. 1) Ионныевозникают между отрицательно заряженными карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными группами радикалов лизина, аргинина и гистидина.2) Водородные ,−возникают между гидрофильными незаряженными группами 3) Дисульфидные связиобразуются за счет взаимодействиятиогрупп радикалов цистеина. Большинство внутриклеточных белков не имеют дисульфидных связей. Однако в белках, секретируемых клеткой во внеклеточное пространство, эти связи распространены и, возможно, именно они стабилизируют конформацию белков вне клетки, и предотвращают их денатурацию. К таким белкам относят инсулин и иммуноглобулины.−S−−S-групп двух остатков цистеина, которые могут находиться далеко друг от друга в линейной первичной структуре белка. Но при формировании третичной структуры они сближаются и образуют прочное связывание радикалов ковалентной 4) Слабые гидрофобные взаимодействия.Одна из причин гидрофобных взаимодействий заключается в проявлении слабых сил притяжения Ван-дер-Ваальса, которые действуют между неполярными боковыми цепями аминокислотных остатков. Четвертичная структура белков Ассоциация двух или большего числа белковых глобул с образованием комплекса создает сложную пространственную конфигурацию четвертичную структуру белка: актомиозина, являющегося сократительным белковым комплексом мышц. Ассоциация молекул фибриноген-мономера приводит к образованию фибрина-полимера, что имеет большое значение в процессах свертывания крови. Этапы формирования конформаций белков – образование первичной, вторичной, третичной и четвертичной структур представлены на рисунке. В этой структуре молекула белка состоит из субъединиц, каждая из которых имеет третичную структуру. Такие белковые комплексы часто обладают важными биологическими свойствами. Эти комплексы представляют собой единое целое и выполняют биологическую функцию, не свойственную отдельно взятым субъединицам. Примерами белков, имеющих четвертичную структуру, являются гемоглобин, который состоит из четырех субъединиц, и миозин, состоящий из двух субъединиц. Ассоциация миозина и актина приводит к образованию ещё более сложного комплекса. Конформация белков. Анализ структуры белка не сводится к установлению его аминокислотной последовательности (первичной структуры). Белок обладает сложной «макроструктурой», которая контролируется более разнообразными и многочисленными взаимодействиями, чем пептидные связи, составляющие его первичную структуру. Линейные пептидные цепи индивидуальных белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную трехмерную структуру, называемуюконформацией.Было показано, что все молекулы индивидуальных белков (то есть имеющих одинаковую первичную структуру), образуют одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.В белках различают два основных типа конформаций полипептидных цепей: вторичную и третичную структуру. 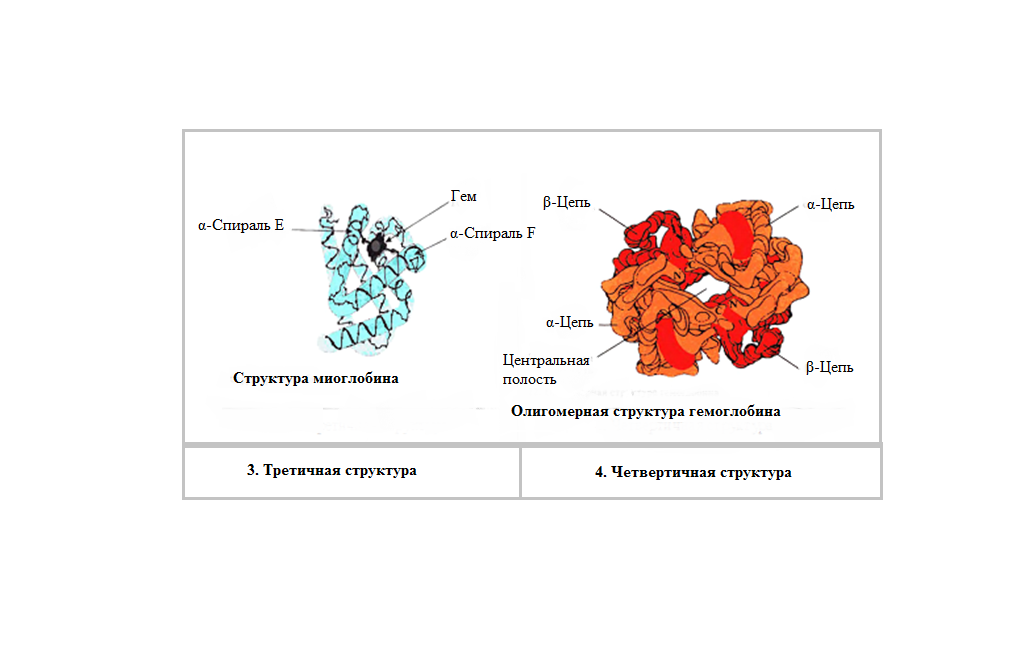 Свойства белков Кислотно-основные свойства белков. Изоэлектрическая точка.Кислотно-основные свойства пептидов. Многие короткие пептиды были получены в чистом кристаллическом виде. Высокие температуры их плавления указывают на то, что из нейтральных растворов пептиды кристаллизуются в виде диполярных ионов. Поскольку ни одна из α-карбоксильных групп и ни одна из α-аминогрупп, участвующих в образовании пептидных связей, не может ионизироваться в интервале рН от 0 до 14, кислотно-основные свойства пептидов определяются свободной NH2группойN-концевого остатка и свободной карбоксильной группой С-концевого остатка пептида и темиR-группами, которые способны к ионизации. В длинных пептидных цепях число ионизированных R-групп обычно велико по сравнению с двумя ионизированными группами концевых остатков пептида. Поэтому для характеристики кислотно-основных свойств пептидов мы будем рассматривать короткие пептиды. Свободная α-аминогруппа и свободная концевая карбоксильная группа в пептидах разделены значительно большим расстоянием, чем в простых аминокислотах, и поэтому электростатические взаимодействия между ними ослаблены. Белковая молекула содержит некоторое количество свободных амино- и карбоксильных групп, и поэтому, подобно аминокислотам и пептидам, белки являются амфотерными соединениями. В щелочной среде белок диссоциирует как кислота, а в кислой – как основание. Отсюда следует, что в щелочной среде молекулы белка заряжаются отрицательно, а в кислой – положительно, и в электрическом поле будут перемещаться соответственно к катоду или к аноду. Для белков, так же как для аминокислот и пептидов, при определенном значении рН среды число положительных зарядов будет равно числу отрицательных, и в электрическом поле такая белковая молекула перемещаться не будет. Это значение рН среды называют изоэлектрической точкой белка. В изоэлектрической точке белки в наименьшей степени гидратированы, и они легко выпадают в осадок, особенно при добавлении к ним водоотнимающих средств.ЕслирН, среды выше чем изоэлектрическая точка белка, то он будет анионом и будет мигрировать к аноду, если ниже – заряд белка +, и он движется к катоду. |