Лекции Значение и функции белков. Строение и свойства аминокислот
 Скачать 4.99 Mb. Скачать 4.99 Mb.
|
|
Лекция 1. Значение и функции белков и аминокислот План лекции 1. Значение и функции белков. 2. Строение и свойства аминокислот. 3. Реакции сульфгидрильной (тиоловой) группы. 4. Дезаминирование аминокислот 5. Реакциииии трансамнирования 6. Декарбоксилирование аминокислот. 7. Реакции гидроксилирования и карбоксилирования 8. Качественные цветные реакции на аминокислоты, пептиды и белки. 3. Структурная организация белков, Физико-химические свойства белков. 4. Классификация белков. Простые и сложные белки. 5. Структура и функции гемоглобина. Цель изучения: знать классификацию, строение, физико-химические свойства и биологические функции аминокислот и белков. Уметь проводить обнаружение отдельных аминокислот и белка в биологических жидкостях с целью диагностики. Содержание биополимеров в организме. В живых клетках синтезируется множество молекул, среди которых, главная роль, играют полимерные молекулы – белки, нуклеиновые кислоты, углеводы и липиды. Нормальный химический состав человека весом 65 кг.
* Содержание воды в разных тканях существенно различается: в ткани кости, не содержащей костного мозга, на долю воды приходится 22,5%. Содержание воды снижается также при накоплении жира. Актуальность темы. В единстве всего живого мира важнейшую роль играют белки, не заменяемые веществами другого класса. Белки или протеины, получили свое название от лат. Рrotos– первые или важнейшие. Подсчитано, что в живой природе 1010 – 1012 различных белков содержится примерно в106 видах организмов. В организме человека содержится 45% белков от сухой массы тела; больше всего в селезенке (84%), меньше всего в жировой ткани (14%). Трудно провести четкую границу между пептидами и белками. Обычно к белкам относят, как правило, высокомолекулярные пептиды, выполняющие основные биологические функции. 1. Значение и функции белков. Белки выполняют многочисленные функции: – каталитическая – ферменты 50% от всех белков; – защитная – иммуноглобулины, антитела лизоцим; – транспортная – гемоглобин, трансферрин; – регуляторная – гормоны инсулин, глюкагон; – сократительная – актин, миозин; – структурная – коллаген, эластин; – резервная – альбумины; – токсическая (белки вирусов, бактерий, грибов – токсины) Такие многочисленные функции белков объясняются особенностями белков: Большое разнообразие структур; Разнообразие физико-химических свойств; Образование комплексов с другими классами органических молекул (металлами, углеводами, липидами, нуклеиновыми кислотами); Белки способны к внутримолекулярным взаимодействиям; Способность менять пространственную структуру под действием внешних агентов и возвращаться к нативной структуре по окончании действия агентов, если они не были продолжительными и необратимыми. В абсолютном своём большинстве белковая природа присуща всем ферментам. Такие особенности белков объясняются их составом и строением молекул. Элементный состав белков представлен 50-54 % С, 21 -23 % О, 15 -17 % N,6-7 % H ,2,5 -0,32 % S и возможно до 0,5 % зольных элементов. Наличие в белках 16 % азота позволяет по азоту определить количество белка в изучаемой ткани (Метод Кьельдаля по которому % белка = % N х 6,25). Молекулярная масса белков варьирует от 6000 до 1 000 000 и выше. Белки –полимеры, состоящие из остатков аминокислот. Итак, белки –высокомолекулярные азотосодержащие органические вещества, построенные из остатков протеиногенных аминокислот. 2. Строение и свойства аминокислот, пептидная связь. Задание Выучить формулы незаменимых аминокислот. Аминокислоты – органические вещества, содержащие две функциональные группы (аминную и карбоксильную), связанные с одним атомом углерода (α). 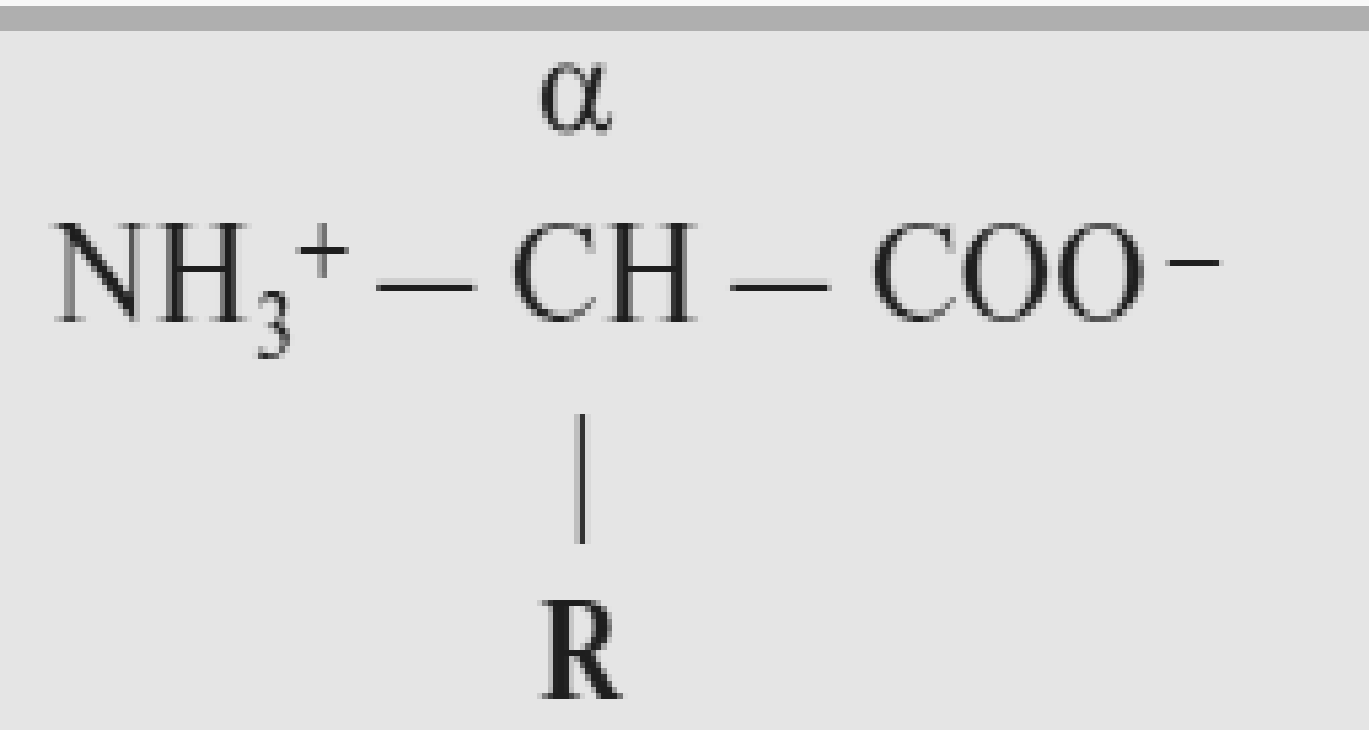 Исключением является пролин, который содержит в α-положении группу — NH и называется аминокислотой. Аминокислоты отличаются друг от друга структурой боковой цепи — радикала (R) и, следовательно, свойствами. Все аминокислоты можно разделить на группы на основе полярности боковых цепей. Протеиногенные аминокислоты 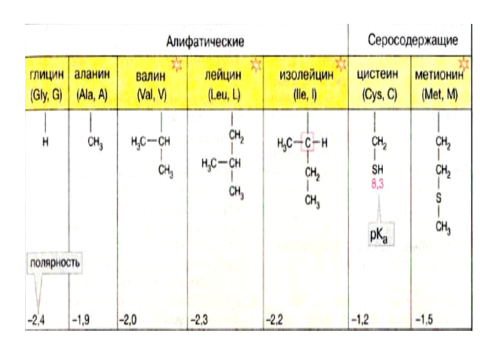 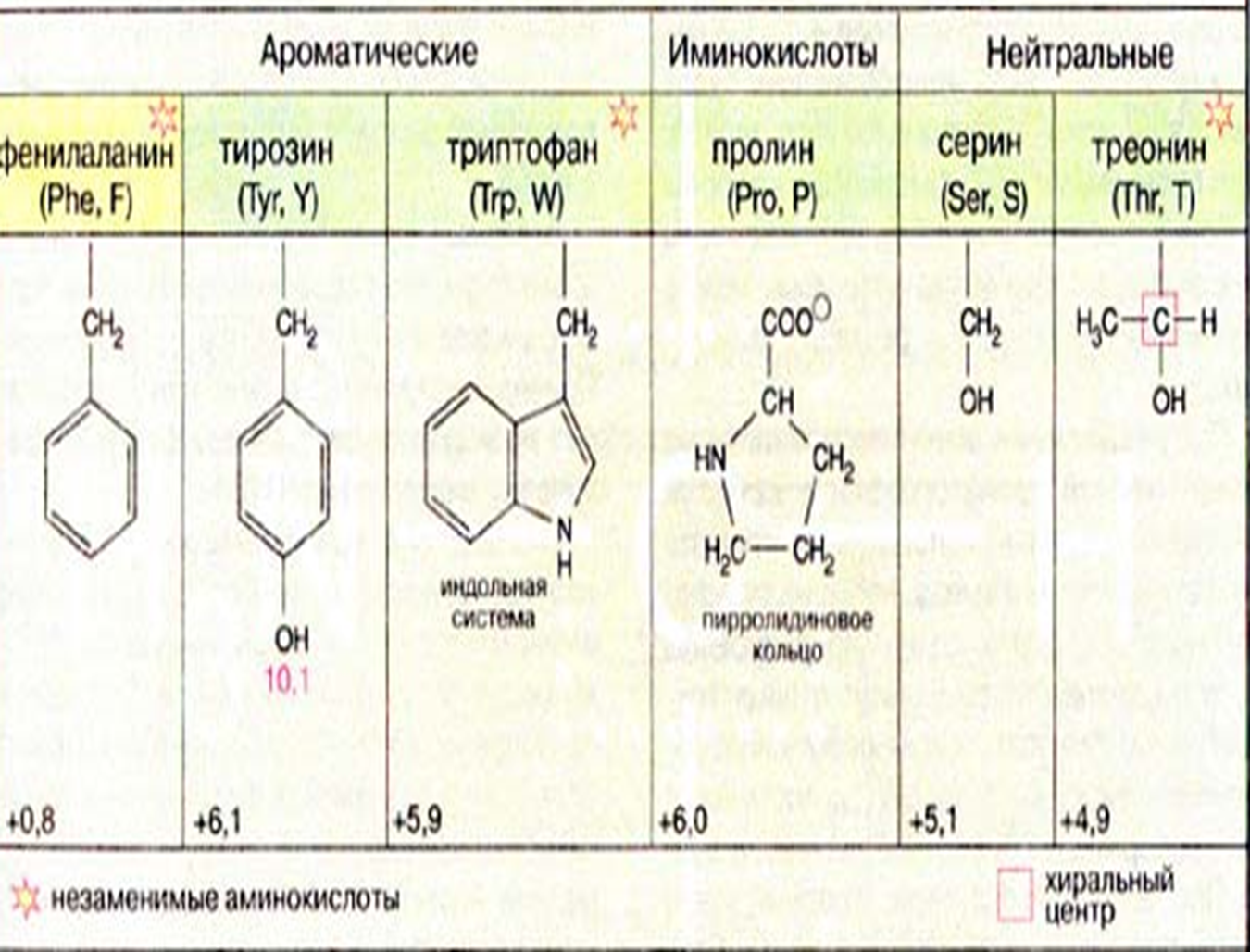 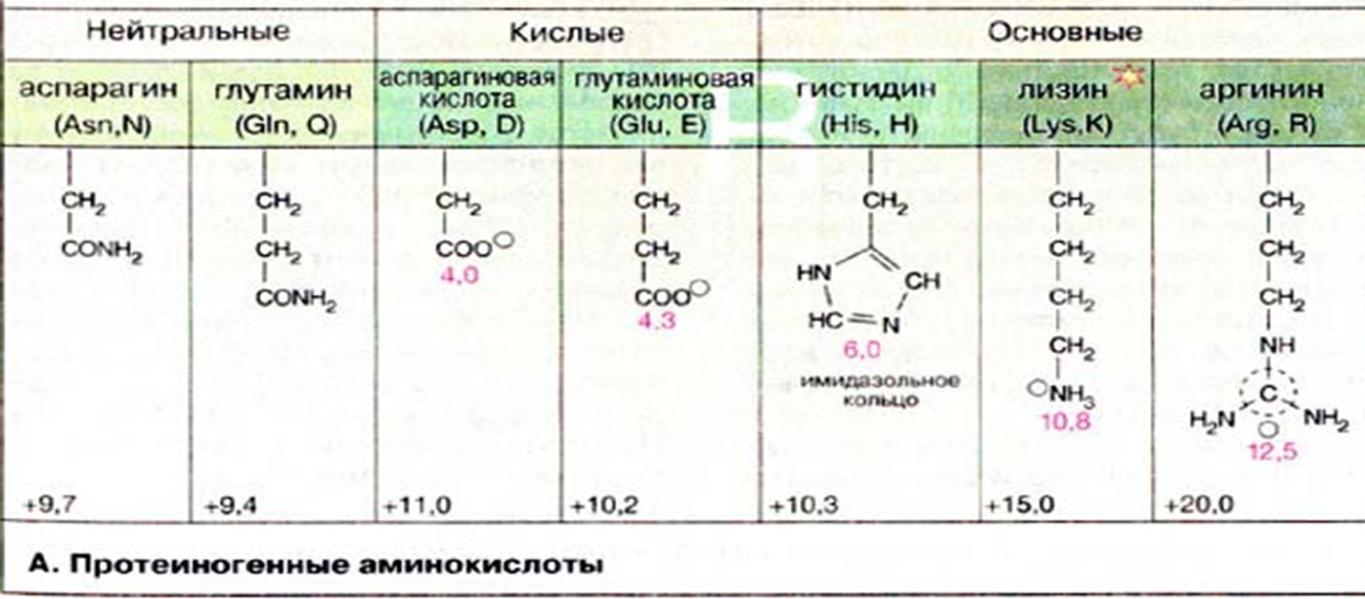 Отдельно рассматриваются модифицированные аминокислоты, содержащие в радикале дополнительные функциональные группы: гидроксилизин, гидроксипролин, γ-карбоксиглутаминовая кислота и др. Эти аминокислоты могут входить в состав белков, однако модификация аминокислотных остатков осуществляется уже в составе белков, т.е. только после окончания их синтеза. Отдельно рассматриваются модифицированные аминокислоты, содержащие в радикале дополнительные функциональные группы: гидроксилизин, гидроксипролин, γ-карбоксиглутаминовая кислота и др. Эти аминокислоты могут входить в состав белков, однако модификация аминокислотных остатков осуществляется уже в составе белков, т.е. только после окончания их синтеза.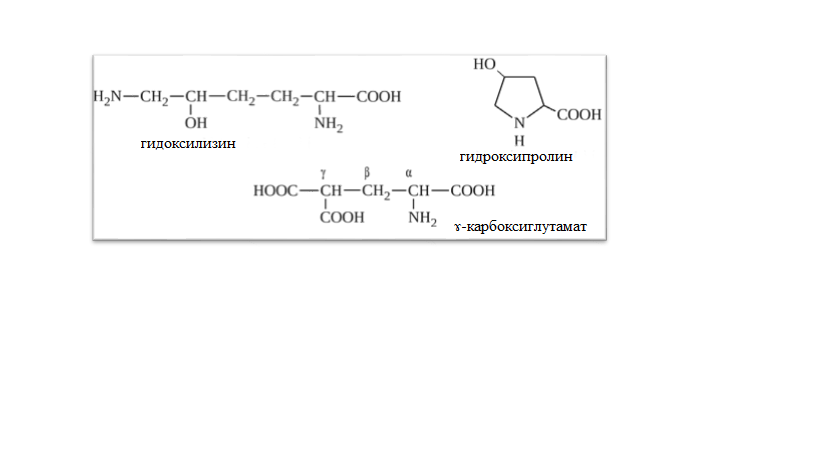 Химические свойства аминокислот Амфотерность аминокислот Аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью. 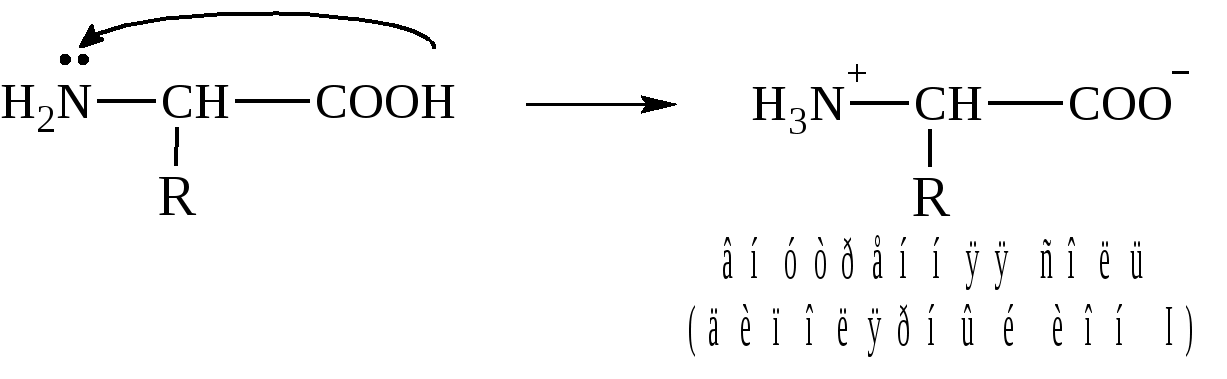 Если раствор аминокислоты поместить в электрическое поле, то в зависимости от активной реакции среды будет наблюдаться следующая картина: в кислой среде ион аминокислоты мигрирует к катоду, а в щелочной к аноду. Если при определенном рН среды концентрация катионов станет равной концентрации анионов, то никакого движения аминокислоты происходить не будет. Если раствор аминокислоты поместить в электрическое поле, то в зависимости от активной реакции среды будет наблюдаться следующая картина: в кислой среде ион аминокислоты мигрирует к катоду, а в щелочной к аноду. Если при определенном рН среды концентрация катионов станет равной концентрации анионов, то никакого движения аминокислоты происходить не будет. Наличие в молекуле аминокислоты функциональных групп кислотного и основного характера обусловливает амфотерность аминокислот. Подобно любому амфотерному соединению, аминокислоты образуют соли как при действии кислоты, так и при действии щелочи. 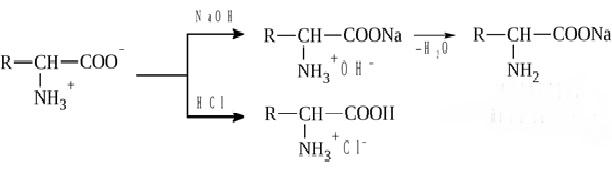 При подщелачивании раствора аминокислоты диполярный ион превращается в анион, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание. Если подкислить раствор аминокислоты, ион превратится в катион, так как более сильная кислота Н3О+отдает протон карбоксилат-иону и образуется более слабая кислота:  Аминокислоты, будучи гетерофункциональными соединениями, проявляют свойства как одной, так и другой функциональной группы. 1. Реакции сульфгидрильной (тиоловой) группы. Для сульфгидрильной группы характерна исключительно высокая реакционная способность. В щелочных растворах цистеин легко теряет атом серы. Так, при нагревании цистеина с ацетатом свинца в щелочном растворе образуется черный осадок сульфида свинца. Эта реакция применяется для обнаружения сульфгидрильной группы в пептидах и белках.Тиоловая группа цистеина легко подвергается окислению с образованием дисульфида. Этот процесс можно отразить следующей схемой: Дисульфидные связи, присоединяя два атома водорода, переходят в сульфгидрильные (тиоловые) группы: 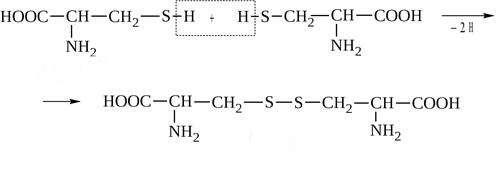 Простые аминокислоты, как и многие другие простые «биологические молекулы», не накапливаются в клетке: как правило, их избыток разрушается при помощи реакций, которые снабжают живую систему энергией. Три основные реакции, катализируемые ферментами, благодаря которым осуществляется превращение аминокислот в клетке, это реакции дезаминирования, переаминирования и декарбоксилирования. 4. Дезаминирование аминокислот В организме дезаминирование может осуществляться как неокислительным, так и окислительным путём. Неокислительное дезаминированиевстречается, в основном, у бактерий и грибов. Например, превращение аспарагиновой кислоты в фумаровую под действием фермента аспартазы. 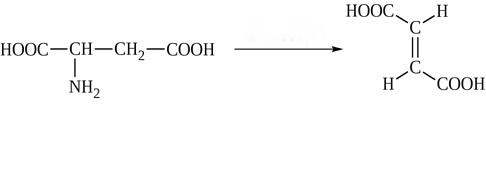 Окислительное дезаминирование протекает при участии фермента оксидазы. Для того чтобы полностью прошла реакция окислительного дезаминирования, фермент, катализирующий эту реакцию, нуждается в окислительном (дегидрирующем) агенте.−Обычно акцептором водорода в таких системах служит ФАД (флавинадениндинуклеотид), который затем переходит в восстановленную форму, сокращённо обозначаемую ФАД-Н2. Рассмотрим процесс превращения аланина в пировиноградную кислоту. 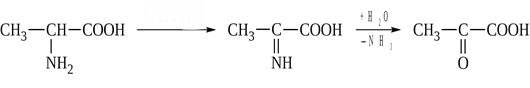 Реакции дезаминирования позволяют организму удалять избыток аминокислот, однако при этом повышается концентрация нежелательных азотистых веществ. Высокие концентрации аммиака и его производных токсичны для организма, который поэтому стремится освободиться от них, выделяя лишний азот в виде мочевины или мочевой кислоты. Реакции дезаминирования позволяют организму удалять избыток аминокислот, однако при этом повышается концентрация нежелательных азотистых веществ. Высокие концентрации аммиака и его производных токсичны для организма, который поэтому стремится освободиться от них, выделяя лишний азот в виде мочевины или мочевой кислоты.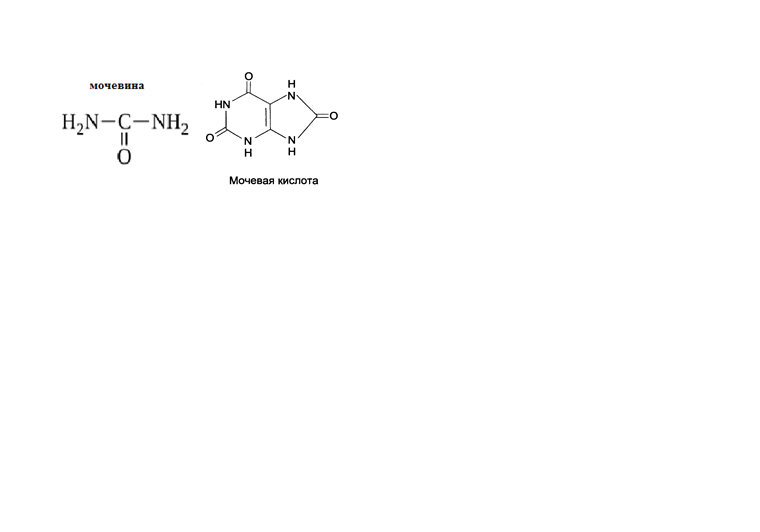 Содержание мочевой кислоты и её солей в организме человека может представлять интерес с точки зрения эволюционной теории, поскольку большинство животных полностью разлагают мочевую кислоту до её выделения из организма. Было высказано предположение о том, что присутствие мочевой кислоты в организме человека предоставляет людям некоторое эволюционное преимущество. Эта гипотеза ещё не доказана, но она может быть интересным связующим звеном между биохимическими свойствами вещества и поведением живых организмов. Мочевая кислота образуется в организме взрослого человека в качестве побочного продукта. Высокое содержание мочевой кислоты приводит к мочекаменной болезни. Мочевая кислота в виде кристаллов мононатриевой соли образует камни в почках и в мочевом пузыре. Соли мочевой кислоты в суставах вызывают болезненные симптомы подагры.Очень широко распространенного заболевания человека. 5. Реакциииии трансамнирования. Реакция сводится к взаимопревращению аминогруппы и карбонильной группы под действием ферментов трансаминаз. Эта реакция служит не только для разрушения аминокислот, но и для их биосинтеза. Рассмотрим реакцию взаимопревращения аспарагиновой кислоты и α-кетоглутаровой в щавелевоуксусную и глутаминовую кислоты: 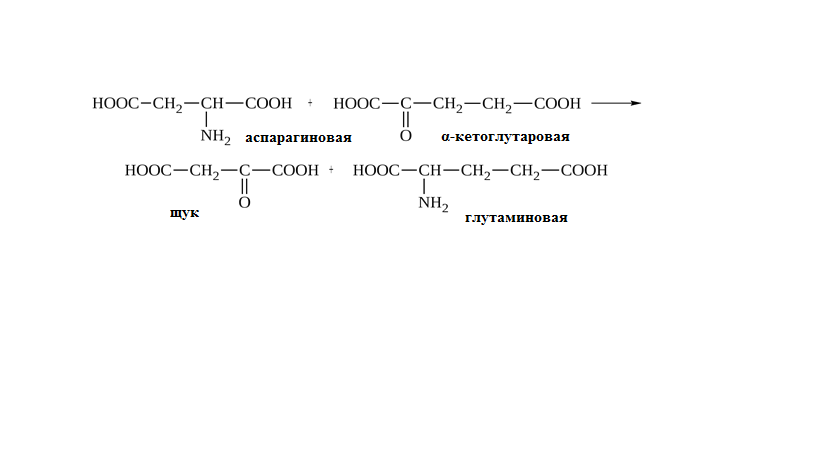 Эта схема не отражает истинного механизма процесса. Большое значение имеет реакция аминогруппы с альдегидной группой (глюкозы). Данное взаимопревращение нуждается в пиридоксальфосфате, который образует имин с исходной аминокислотой, сохраняет аминогруппу при превращении аминокислоты в соответствующую α-кетокислоту и образует имин с другой α-кетокислотой. Рассмотрим процесс превращения аминокислоты I в α-кетокислотуI и α-кетокислоты II в аминокислоту II. Альдегидная группа пиридоксальфосфата образует имин с аминокислотой I, имин далее изомеризуется и после гидролиза выделяет кетокислотуIи пиридоксаминфосфат. 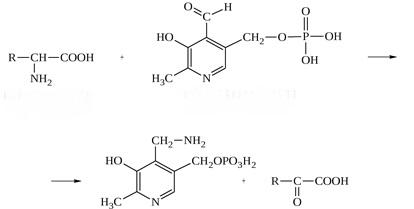 Имин далее изомеризуется и после гидролиза образует новую аминокислоту (аминокислота II):′Таким образом, из исходной аминокислоты получилась кетокислота. Образовавшийся пиридоксаминфосфат далее реагирует с другой кетокислотой (кетокислота II), образуя имин, содержащий радикал новой кетокислоты (R). Имин далее изомеризуется и после гидролиза образует новую аминокислоту (аминокислота II):′Таким образом, из исходной аминокислоты получилась кетокислота. Образовавшийся пиридоксаминфосфат далее реагирует с другой кетокислотой (кетокислота II), образуя имин, содержащий радикал новой кетокислоты (R).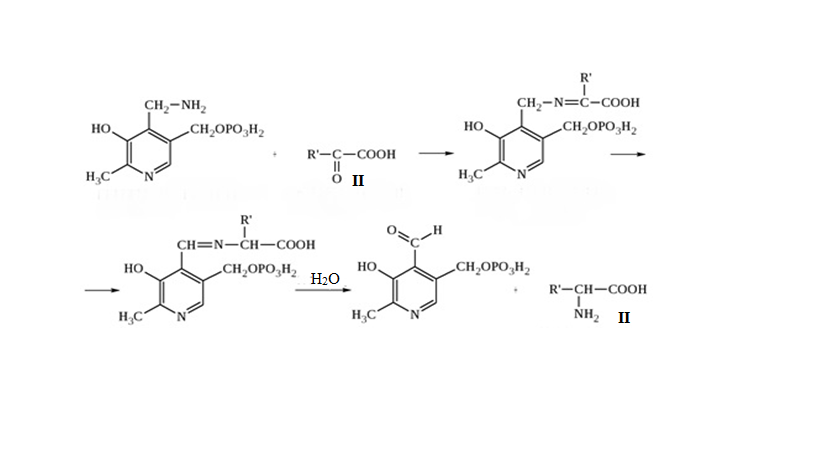 По завершении всей сложной последовательности реакций, после гидролиза пиридоксальфосфат регенерируется и способен принять участие в следующих взаимопревращениях аминокислот и α-кетокислот. 6. Декарбоксилирование аминокислот. Дофамин – это биологический предшественник адреналина−декарбоксилазами. Некоторые амины обладают ярко выраженной биологической активностью. Интереснойявляется реакция образование дофамина при декарбоксилировании диоксифенилаланина (путь образования биогенных аминов). В организме эта реакция катализируется ферментами. 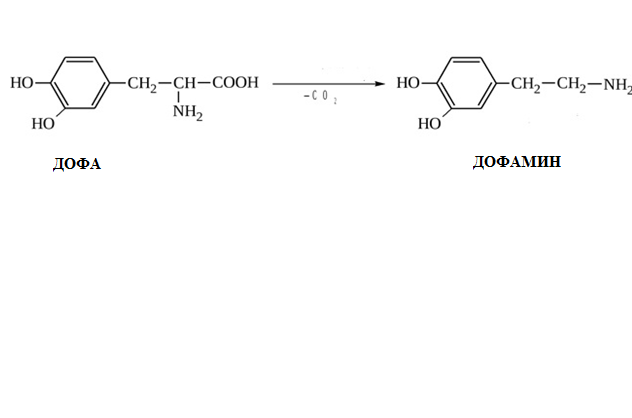 В реакции декарбоксилирования, которая протекает при гниении белков, лизин и орнитин, образуют диамины: кадаверин и путресцин. 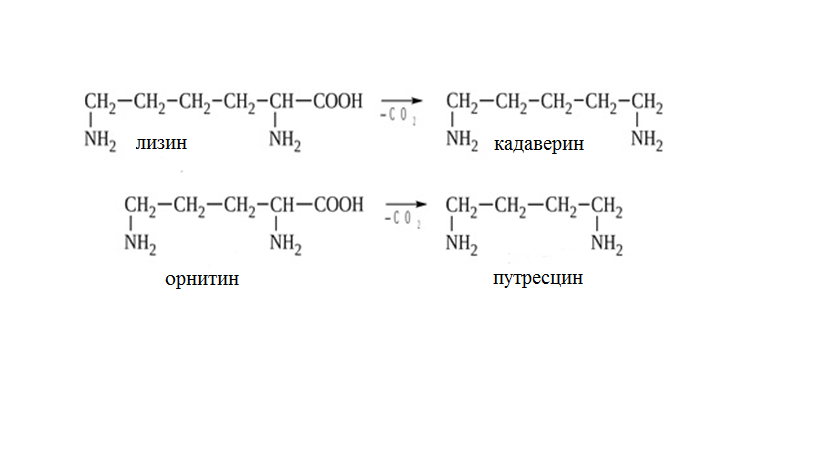 Интересной является реакция декарбоксилирования глутаминовой кислоты, так как она приводит к образованию γ-аминомасляной кислоты, которую рассматривают как природный транквилизатор. Интересной является реакция декарбоксилирования глутаминовой кислоты, так как она приводит к образованию γ-аминомасляной кислоты, которую рассматривают как природный транквилизатор.Этот процесс также нуждается в присутствии пиридоксаль-фосфата. 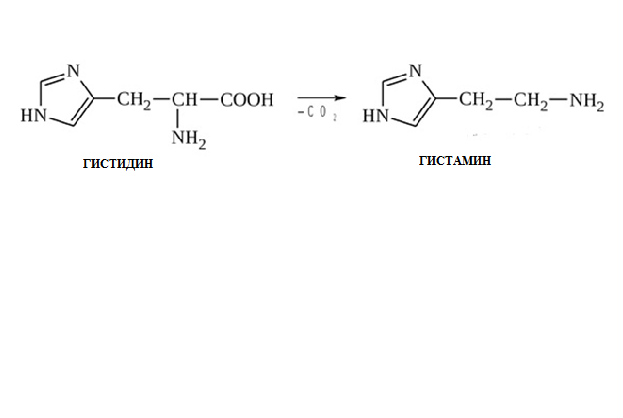 Ярко выраженной биологической активностью обладает амин, образующийся при декарбоксилировании гистидина: Гистамин является медиатором аллергии: он расширяет все периферические сосуды, что приводит к резкому падению артериального давления, нарушает проницаемость сосудистой стенки, что может быть одной из причин появления отеков, вызывает бронхоспазм и.т.д. Группа препаратов, применяемых в медицине для уменьшения проявления аллергических реакций, так или иначе связанных с гистамином, была названа антигистаминными препаратами. 7. Реакции гидроксилирования и карбоксилирования. С помощью этих реакций в молекулу органического соединения вводится дополнительная гидроксильная или карбоксильная группы. Реакции протекают при участии соответствующих ферментов и приводят к образованию модифицированных аминокислот. Эти реакции не имеют аналогов в химии invitro. Гидроксилированием называют введение в молекулу органического соединения атома кислорода. Так, гидроксилирование фенилаланина приводит к образованию тирозина: 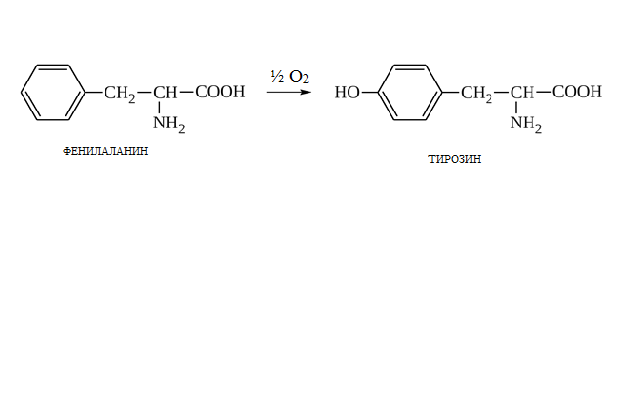 Отсутствие в организме фермента, катализирующего эту реакцию, приводит к тяжелому заболеванию фенилкетонурии. Отсутствие в организме фермента, катализирующего эту реакцию, приводит к тяжелому заболеванию фенилкетонурии.Значительный интерес представляет реакция гидроксилирования пролина: 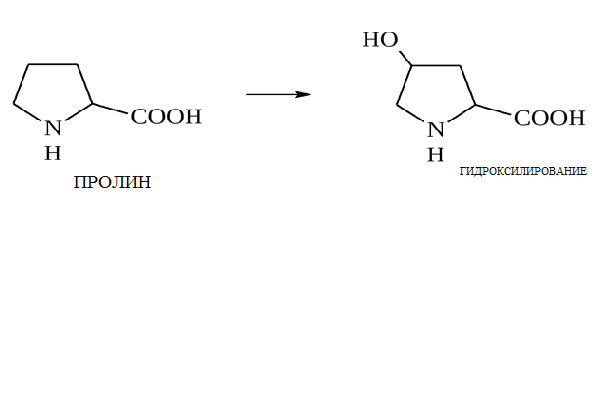 Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, которая осуществляется за счет образования водородных связей. При цинге нарушается гидроксилирование остатков пролина и лизина. В результате образуются менее прочные коллагеновые волокна, что приводит к хрупкости и ломкости кровеносных сосудов. Карбоксилированием называют введение в молекулу органического соединения карбоксильной группы. Таким образом получают, например, γ-карбоксиглутаминовую кислоту 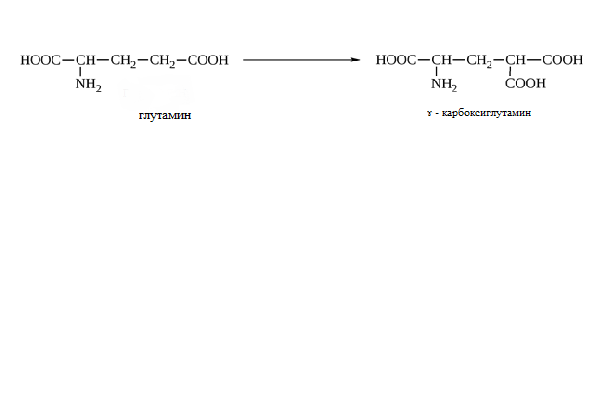 γ-Карбоксиглутаминовая кислота входит в состав белков, участвующих в процессах свертывания крови, так как две близлежащие карбоксильные группы в её структуре способствуют более полному связыванию белковых факторов с ионами кальция: 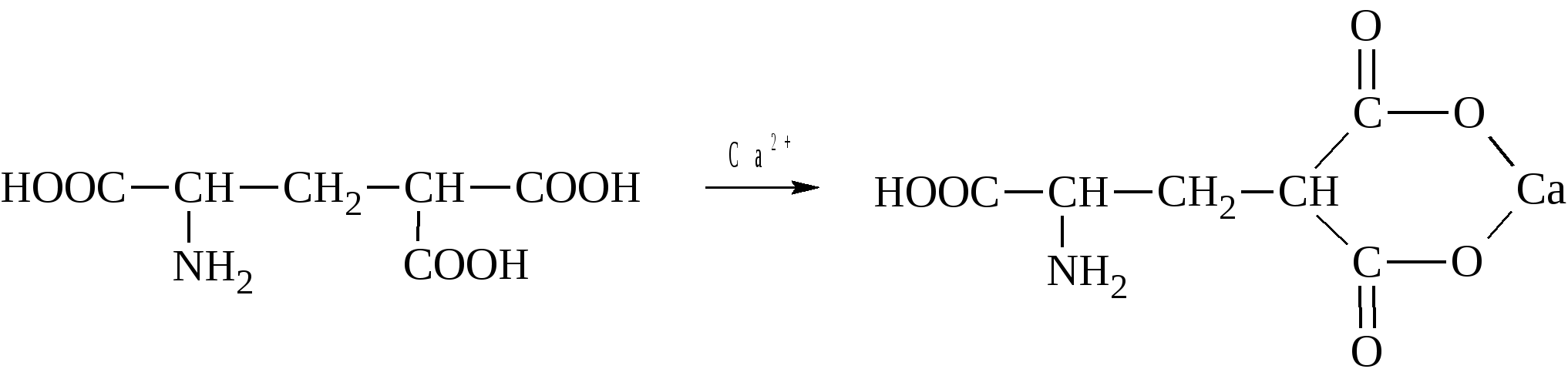 Нарушение карбоксилирования глутамата приводит к снижению свертываемости крови. Таким образом, модифицированные аминокислоты, имеющие в своих структурах дополнительные функциональные группы, приобретают свойства, необходимые для выполнения ими специфических функций. 8. Качественные цветные реакции на аминокислоты, пептиды и белки. Реакция с нингидрином.В присутствии нингидрина раствор аминокислоты окрашивается в сине-фиолетовый цвет. Это универсальный реактив для определения белков и аминокислот. Биуретова реакция.Эта реакция используется для обнаружения пептидных связей в белках и пептидах. При нагревании пептидов или белков в щелочном растворе с сульфатом меди появляется сине-фиолетовая окраска. Ксантопротеиновая реакция(групповая) Используется для обнаружения ароматических и гетероциклических аминокислотных остатков Исследуемые соединения с концентрированной азотной кислотой образуют нитросоединения, окрашенные в желтый цвет. Реакция с ацетатом свинца (индивидуальная). Используется для обнаружения белков, содержащих цистеин. В щелочной среде образуется черный осадок сульфида свинца. Реакция с диметиламинобензальдегидом (реакция Эрлиха).Используется для качественного и количественного определения триптофана. В растворе, подкисленном серной кислотой, появляется красно-фиолетовое окрашивание. Нингидриновая реакция на альфа-аминокислоты 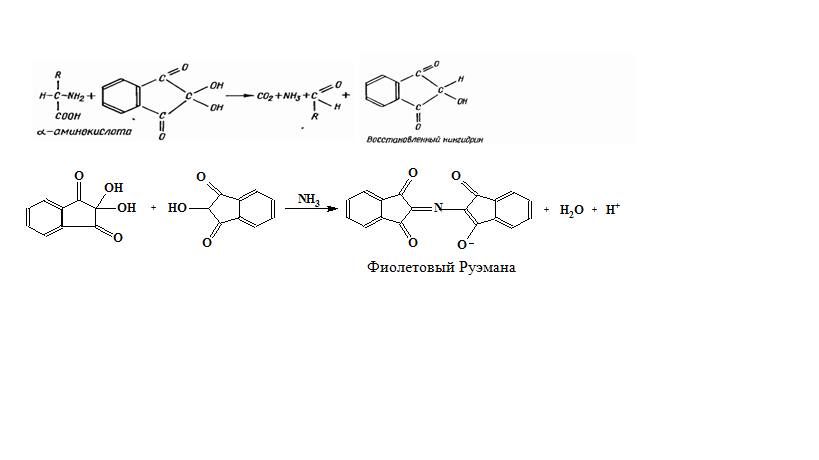 К 5 каплям раствора белка приливают 5 капель 0,1% водного раствора нингидрина и кипятят 1-2 минуты. Появляется розово-фиолетовое или сине-фиолетовое окрашивание. С течением времени раствор синеет. В этой реакции альфа-аминокислоты окисляются кислородом нингидрина и подвергаются окислительному дезаминированию с образованием аммиака, а также декарбоксилированию с образованием альдегида и CO2. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина в желтый цвет.Данная реакция не является специфичной, поскольку ее дают некоторые амины и амиды кислот. Биуретова реакция К 1-2 мл разбавленного белка прибавляют двойной объем 10% рабствора NaOH, хорошо перемешивают и добавляют 2-3 капли 1% раствора сульфата меди. Снова тщательно перемешивают. Развивается красно-фиолетовое окрашивание. Механизм биуретовой реакции: 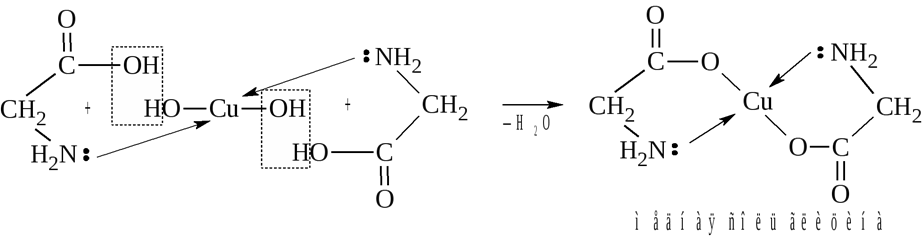 Комплексное соединение меди с енолизированными пептидными группами любого биурета. Ксантопротеиновая реакция (групповая). К 1-2 мл раствора белка добавляют 5-6 капель HNO3 концентрированной до появления белого осадка или мути от свернувшегося белка. Ксантопротеиновая реакция происходит только при наличии в белках остатков ароматических аминокислот (фенилаланина, тирозина и триптофана). При нагревании раствор и осадок окрашиваются в яркожелтый цвет. В результате реакции нитрирования по радикалам ароматических аминокислот образуются желтоокрашенные нитросоединения. Охлаждают смесь и осторожно добавляют к раствору, имеющему кислую реакцию, не взбалтывая по каплям избыток щелочи до щелочной реакции. Изменения желтой окраски в оранжевую в щелочной среде обусловлено проявлением хромофорной группы. Рассмотрим в качестве примера механизм ксантопротеиновой реакции по радикалу тирозина.: Реакция на «слабосвязанную серу» (индивидуальная). В пробирку наливают 0,5-1 мл неразбавленного раствора щелочи с белком и кипятят смесь (осторожно жидкость может выбросить). При наличии в молекуле белка аминокислот, содержащих серу – от молекул постепенно отщепляется сера в виде иона в степени окисления +2. Отдельно в пробирке готовят плюмбит натрия добавлением избытка щелочи к уксуснокислому свинцу до растворения осадка гидроксида свинца(II): к горячей щелочной жидкости приливают р-р плюмбата натрия, обязуется желто-бурое или черное окрашивание: 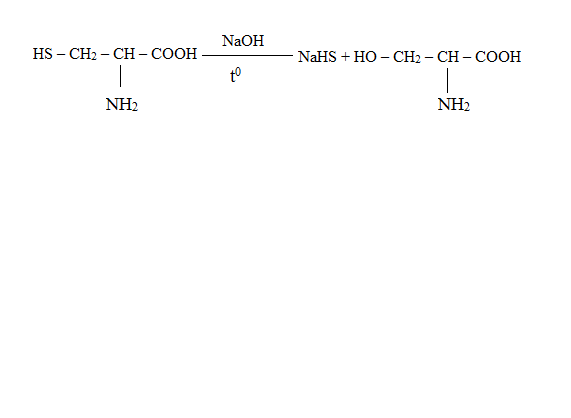 Pb(CH3COO)2 +2NaOH = Pb(OH)2+2NaCH3COO Pb(OH)2+2NaOH = Na2PbO2+2H2O H2O+Na2PbO2+NaHS = Pbs(осадок)+3NaOH Реакция Милона на тирозин (индивидуальная). К 0,5-1 мл неразбавленного белка куриного яйца прибавляют двойной объем азотнортутного реактива Милона. Белок свертывается под действием солей ртути и азотной кислоты, входящих в реактив, образуя сгусток белого цвета. Реакцию Милона дают все белки, содержащие в своем составе осадок тирозина. При взаимодействии его с фенольным ядром тирозина возникает нитрозотирозин, ртутное соединение, которое окрашено в красный цвет:  Клинико-диагностическое значение: реакция белка с азотной кислотой (метод Стольникова) – обнаружение белка в моче. Биуретова реакция – основа определения содержания общего белка крови. КОНТРОЛЬНЫЕ ВОПРОСЫ К ТЕМЕ Белки. Характеристика. Что представляют собой белки? Дайте определение. Назовите биологические функции белков в организме – приведите примеры. Белки – основа структуры клетки. а) приведите средине данные о содержании белка в теле человека. б) данные о содержание белка в отдельных органах (мышцах, сердце, легких) Белки – основа обмена веществ. Объясните биокаталитическую функцию белков и ее связь с обменом веществ. Аминокислоты – структурные компоненты белковых молекул. Дайте определение аминокислот. Элементарный состав – перечислить химические элементы, входящие в состав белка, их количественное содержание. Сколько всего аминокислот может содержаться в белковых молекулах. Укажите особенности аминокислот, входящие в состав белков, приведите общую формулу. Перечислите функциональные группы, встречающиеся в различных аминокислотах и напишите их. Классификация аминокислот. Изобразите схематически разделение аминокислот по отдельным группам. Напишите по 2-3 примера формулы моноаминокарбоновых кислот, моноаминодикарбоновых кислот, диаминомонокарбоновых кислот, содержащих циклических аминокислот. Напишите схему диссоциации аминокислот, а) в кислой среде, б) в щелочной среде. Напишите реакцию взаимодействия с азотистой кислотой ряда аминокислот, а) оксилизина, б) тирозина, в) глицина. Реакция используется для газометрического определения аммиака. Напишите реакцию взаимодействия глицина с HCL и NaOH. Напишите уравнение реакций взаимодействия с уксусным альдегидом, а) валина, б) изолейцина. Напишите уравнения реакций взаимодействия аминокислот располагая только реактивами нингидриновой пробы? Можно установить присутствие свободных аминокислот располагая только реактивами нингидриновой пробы? Из 1мл биологической жидкости полностью осажден белок, методом Кьельдаля обнаружено 3 мг азота. Каково% содержание белка в исследуемой жидкости. Что такое пептиды? Напишите формулу пептида аспаргил-валил-гистидил-треонил-аргинил. Напишите формулу пептида глутатиона ɤ - глу-цис-гли Лекция №2 | ||||||||||||||||||||||||||||||||||||
