теплотехника. Лекция_1_по_теплотехнике_db857bfe4b784fe4cb294a3eb1013967. Лекция 1 Основные понятия и определения Термодинамическая система Термодинамическая система совокупность макроскопических тел, энергетически взаимодействующих между собой и с окружающей средой
 Скачать 62.57 Kb. Скачать 62.57 Kb.
|
|
Курс «ТЕПЛОТЕХНИКА» ЛЕКЦИЯ 1 Основные понятия и определения 1. Термодинамическая система Термодинамическая система – совокупность макроскопических тел, энергетически взаимодействующих между собой и с окружающей средой. Окружающая среда –тела, не входящие в термодинамическую систему, но оказывающие на нее влияние. Если система может обмениваться веществом с окружающей средой, она называется открытой, если же такой обмен невозможен, систему называют закрытой. Система называется адиабатной (теплоизолированной), если она не обменивается теплотой с окружающей средой. Система, не обменивающаяся с окружающей средой ни энергией, ни веществом, называется изолированной. Равновесной называется система, свойства (параметры состояния) которой во всех точках одинаковы. В противном случае система называется неравновесной. 2. Термодинамический процесс Термодинамическим процессом называется последовательное изменение состояния системы, при котором меняется хотя бы один из ее параметров состояния. Все процессы делятся на равновесные и неравновесные. Равновесным называется процесс, при котором система проходит через последовательный ряд равновесных состояний. Равновесные процессы являются обратимыми. Обратимым называется такой процесс, который может проходить как в прямом, так и в обратном направлении при этом термодинамическая система, и окружающая среда возвращаются в начальное состояние. Круговым процессом (циклом) называется процесс, в результате которого система возвращается в исходное состояние (на рис. 1.1 – процесс 1-2-1). На рис. 1.1 х и у – любая пара параметров состояния системы. 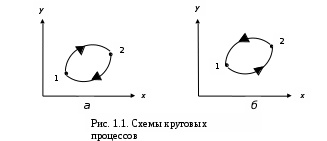 Если круговой процесс протекает «по часовой стрелке», то его называют прямым циклом (рис. 1.1, а). Такие циклы характерны для тепловых двигателей. Если круговой процесс протекает в противоположном направлении, то его называют обратным циклом (рис. 1.1, б). По таким циклам работают тепловые насосы, холодильные установки. После каждого цикла кругового процесса параметры состояния возвращаются к своему исходному значению. 3. Рабочее тело Простейшей термодинамической системой является рабочее тело, осуществляющее взаимное превращение теплоты и работы. В качестве рабочего тела чаще всего используются газы и пары. Это объясняется тем, что в таком агрегатном состоянии изменение объема и давления при подводе (отводе) теплоты во много раз больше, чем для жидких и твердых тел. Кроме того, пары и газы способны значительно изменять свои объемы даже без теплового взаимодействия со средой вследствие изменения действующих на них сил. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами или просто параметрами состояния. В число основных параметров входят: абсолютное давление; абсолютная температура и удельный объем. 4. Абсолютное давление Давление в термодинамике определяется как отношение силы, действующей по нормали на единицу площади поверхности тела. Различают абсолютное давление (p), избыточное (pм) и вакуумметрическое (pв). Под абсолютным понимают полное давление, отсчитываемое от нулевого уровня давления. Разность между абсолютным и атмосферным давлением (pатм), когда абсолютное давление больше атмосферного, называется избыточным (манометрическим) давлением: pм = p – pатм . (1) Разность между атмосферным и абсолютным давлением, когда абсолютное давление меньше атмосферного, называется вакуумметрическим давлением (или просто вакуумом): pв = pатм – p . (2) Из соотношений (1) и (2) следует: p = pм + pатм , p = pатм – pв . За единицу давления в системе СИ принят Паскаль (Па), 1 Па = 1 Н/м2. Используются также величины, кратные Па: килопаскаль (кПа) – 1 кПа = 103Па, мегапаскаль (МПа) – 1МПа = 106 Па. Используются также внесистемные единицы давления: 1атм (техническая атмосфера) = 1кгс/см2 = 9,81∙104 Па; 1 бар = 105 Па; 1 мм ртутного столба = 133,3 Па; 1 мм водяного столба = 9,81 Па. Для измерения давления больше атмосферного (pм) применяют манометры, для измерения давления меньше атмосферного (pв) – вакуумметры. Атмосферное давление (ратм) измеряется с помощью барометра. 5. Термодинамическая температура Температура характеризует степень нагретости тела и представляет собой меру средней кинетической энергии движения молекул. Параметром состояния является абсолютная температура (Т), выражаемая в градусах Кельвина (К). Отсчёт шкалы Кельвина ведётся от абсолютного нуля. Большое распространение получила Международная стоградусная шкала Цельсия (обозначается t, oC). Отсчёт шкалы Цельсия ведётся от температуры таяния льда дистиллированной воды, а 100 оС соответствую температуре кипения воды при нормальном давлении (см. п. 7). Величина градуса шкалы Кельвина равна величине градуса шкалы Цельсия: 1 К = 1 оС. Нуль шкалы Кельвина располагается ниже нуля шкалы Цельсия примерно на 273,15 оС, поэтому Т = t + 273,15. Изменение температуры, найденное по шкале Кельвина, равно изменению температуры, найденному по шкале Цельсия:  T = T2– T1= t2– t1= T = T2– T1= t2– t1= 6. Удельный объем Удельный объем 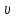 – это объем единицы массы вещества: – это объем единицы массы вещества: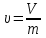 (3) (3)где V – объем, м3; m – массы вещества, кг. Измеряется удельный объем в м3/кг. Плотность вещества 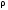 – это отношение массы к объему: – это отношение массы к объему: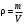 (4) (4)Из (3) и (4) следует, что удельный объем и плотность – обратные величины:  . .Единицы измерения плотности кг/м3. 7. Нормальные условия В термодинамических расчетах часто используются справочные данные. Обычно эти сведения приводятся для «нормальных условий». Нормальные условия – это давление 760 мм рт. ст. (101325 Па) и температура – 0 оС. УРАВНЕНИЯ СОСТОЯНИЯ Уравнение, устанавливающее связь между давлением, температурой и удельным объемом простейшей системы постоянного состава, называется уравнением состояния. Уравнение в общем случае имеет вид: 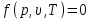 . .8. Уравнение состояния идеального газа Идеальный газ – совокупность молекул, которые имеют исчезающе малые размеры, находятся в беспорядочном тепловом движении и взаимодействуют друг с другом только при соударении. Уравнение состояния идеального газа, впервые полученное Клапейроном в 1834 г., имеет вид:  . (5) . (5) Уравнение (5) записано для одного кг газа. Для mкг газа уравнение состояния будет иметь вид: pV=mRT . Для M киломолей газа уравнение приобретает вид: pV=М 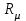 T, T, где p – абсолютное давление, Па; Т – абсолютная температура, К; V – объем, занимаемый рабочим телом, м3; 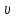 – удельный объем рабочего тела, м3/кг; m – масса, кг; М – число киломолей рабочего тела; R – удельная газовая постоянная, Дж/(кг – удельный объем рабочего тела, м3/кг; m – масса, кг; М – число киломолей рабочего тела; R – удельная газовая постоянная, Дж/(кг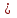 К); К); 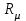 – универсальная газовая постоянная, одинаковая для киломоля любого газа и равная 8314 Дж/(кмоль – универсальная газовая постоянная, одинаковая для киломоля любого газа и равная 8314 Дж/(кмоль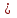 К). К).Универсальная и удельная газовая постоянная связаны соотношением R = Rµ/µ = 8341/µ, где 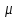 – молекулярная масса рабочего тела. – молекулярная масса рабочего тела. 9. Уравнение состояния реального газа В реальных газах в отличие от идеального, существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объёмом молекул. Межмолекулярные силы отталкивания и объём молекул не позволяют сжать реальный газ до объёма меньше некоторого минимального объёма b, а из-за сил притяжения в реальном газе возникает дополнительное молекулярное давление a/v2. Это учитывается в уравнении Ван-дер-Ваальса:  ) = RT, ) = RT,где a, b – константы, зависящие от особенностей данного газа. Таким образом, коэффициент b учитывает эффект, связанный с конечной величиной молекул и наличием сил отталкивания, а коэффициент  – учитывает эффект молекулярных сил притяжения. – учитывает эффект молекулярных сил притяжения.При больших удельных объёмах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона (5), так как величины a/v2 (по сравнению с p) и b (по сравнению с v) становятся пренебрежительно малыми. Контрольные вопросы 1. Какая термодинамическая система называется изолированной? 2. Какое давление называется вакуумметрическим? 3. Выразите давление 2,5 атм в паскалях (Па). 4. Какой температуре по шкале Цельсия соответствует температура 300 К? 5. Какой параметр в уравнении Клапейрона выражается символом v? 6. Чем отличается идеальный газ от реального? |
