лекции металловедение 1. Лекция 1 введение металловедение
 Скачать 16.24 Mb. Скачать 16.24 Mb.
|
|
ДИСЦИПЛИНА: «МЕТАЛЛОВЕДЕНИЕ» ЛЕКЦИЯ 1 ВВЕДЕНИЕ Металловедение – прикладная наука, изучающая взаимосвязи между составом, строением и свойствами металлов и сплавов в различных условиях. Изучение этой дисциплины позволяет осуществить правильный и рациональный выбор материалов для конкретных условий работы той или иной детали, изделия или конструкции в целом. Металлы и их сплавы повсеместно используются для конструкций машин, оборудования, инструмента и т.д. В последнее время в промышленности стали использоваться искусственно созданные материалы такие как керамика, пластмассы, синтетические волокна, каучуки, композиционные материалы. Однако, металлы и металлические материалы служат основным конструкционным материалом и в обозримом будущем по-прежнему будут доминировать. Синтетические материалы в мировом производстве заменили всего лишь около 6% металлов. И это не случайно. Свойства, которыми обладают металлы и их сплавы, не присущи никакому другому материалу. Металлы характеризуются прочностью, твердостью, пластичностью, устойчивостью против воздействия температур, агрессивных сред, обладают высокой электро- и теплопроводностью и многими другими ценными свойствами. Кроме того, металлические материалы хорошо обрабатываются, режутся, могут свариваться. Чистые металлы составляют основу огромного количества сплавов. Изменяя химический состав, вводя в него небольшие добавки тех или иных химических элементов, можно получать сплавы почти с любыми заранее заданными свойствами. Таким образом, задача металловедения – правильный выбор металлического материала для изготовления деталей, изделий, работающих в конкретных, заданных условиях ( возможное воздействие внешних нагрузок, влияние температуры, агрессивных сред, радиации и т.д.) и обеспечение надежности и длительной работоспособности этих изделий. Металлические материалы обычно делятся на две большие группы: -- сплавы на основе железа (сталь и чугун), которые называются черными металлами; -- сплавы на основе остальных металлов (алюминий, магний, титан, медь, молибден, ниобий и другие), которые называют цветными металлами. Наибольшее распространение в промышленности получили сплавы на основе железа. Эти универсальные конструкционные материалы не только обладают высокими свойствами, но имеют относительно небольшую стоимость. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ И СПЛАВОВ Общее свойство металлов и сплавов - их кристаллическое строение, характеризующееся закономерным расположением атомов в пространстве. Атомно-кристаллическое строение (АКС) - это строго определенное закономерное расположение атомов в пространстве. Для количественногоописания и оценки АКС вводится понятие кристаллической решетки - воображаемой пространственной сетки, в узлахкоторой находятся атомы. Атомно-кристаллическая структура может быть представлена изображением одной элементарной ячейки, повторяющейся во всех трех измерениях. Элементарная ячейка- наименьший объем, трансляцией которого можно полностью воспроизвести структуру кристалла (рис.1.1). 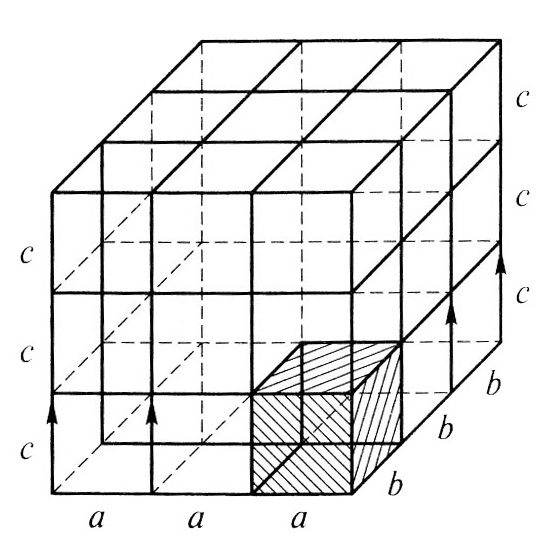 Рис.1.1 Рис.1.1В кристалле атомы сближены до соприкосновения. Для упрощения пространственное изображение АКС и кристаллических решеток принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки (рис.1.2). 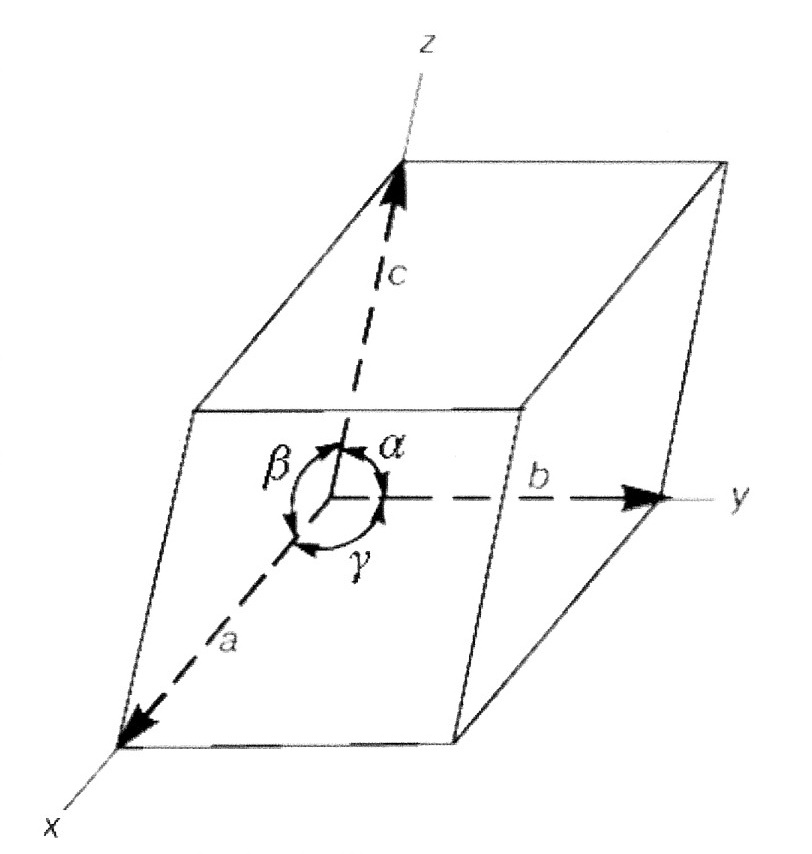 Рис.1.2 Расстояния между центрами ближайших атомов (a, b, c ) называются параметрами (периодами) решетки. Величина периодов в металлах порядка 0,1…7 нм. Размеры элементарных ячеек 0,2…0,3 нм. Для кубической кристаллической решетки а = b = с. Координационное число — количество атомов, находящихся на одинаковом и наименьшем расстоянии от данного. Период решетки характеризует ее размеры, координационное число - характеризует плотность упаковки элементарной ячейки. Углы между гранями кристаллической решетки (α, β, γ) характеризуют тип кристаллической решетки. Для кубической решетки α=β=γ= 90о. Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью. Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением. Типы кристаллических решеток. Существует 14 типов кристаллических решеток (решетки Бравэ). Рассмотрим 3 из них, которые наиболее часто встречаются у основной группы металлов и наиболее распространены в природе:
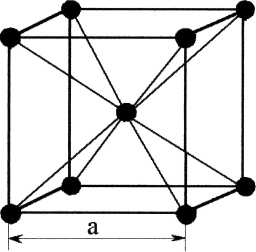 Рис.1.3 Рис.1.3 В кристаллической решетке ОЦК (рис.1.3) атомы расположены в вершинах элементарной ячейки и в центре куба. Такая ячейка содержит 9 атомов. Кубическую объемоцентрированную решетку имеют хром, вольфрам, железо, ванадий, молибден и другие металлы.
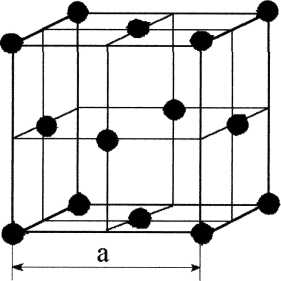 Рис.1.4 Рис.1.4В ячейке кубической гранецентрированной решетки (рис.1.4) атомы находятся в вершинах куба и на пересечении диагоналей каждой плоскости. Такая ячейка имеет 14 атомов. Решетку ГЦК имеют свинец, никель, медь, железо, серебро и другие металлы. З. Гексагональная плотноупакованная решетка (ГПУ). 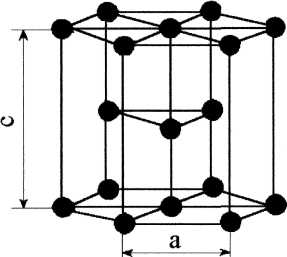 Рис.1.5 Рис.1.5В гексагональной плотноупакованной решетке (рис.1.5) атомы расположены в вершинах и в центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Ячейка ГПУ решетки содержит 17 атомов. Гексагональную кристаллическую решетку имеют магний, кадмий, цинк и другие металлы. Некоторые металлы могут изменять тип кристаллической решетки при изменении температуры (при нагреве, либо охлаждении). Такие металлы называются полиморфными. Явление полиморфизма – изменение типа кристаллической решетки при изменении температуры. Реальное строение металлов и сплавов Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Таких кристаллов в природе практически не существует. Их можно создать только в лабораторных условиях (их называют металлические усы, т.к. их толщина соответствует нескольким межатомным расстояниям). В реальных кристаллах всегда присутствуют дефекты кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Эти дефекты оказывают существенное влияние на свойства материалов. Различают два вида дефектов кристаллического строения: точечные и линейные. Точечные дефекты характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров. К точечным дефектам относятся : -- вакансии ( свободные места в узлах кристаллической решетки (рис.1.6); -- атомы внедрения и замещения (примесные атомы, которые могут находиться и в узлах решетки, и в междоузлии, рис.1.7 а, б) 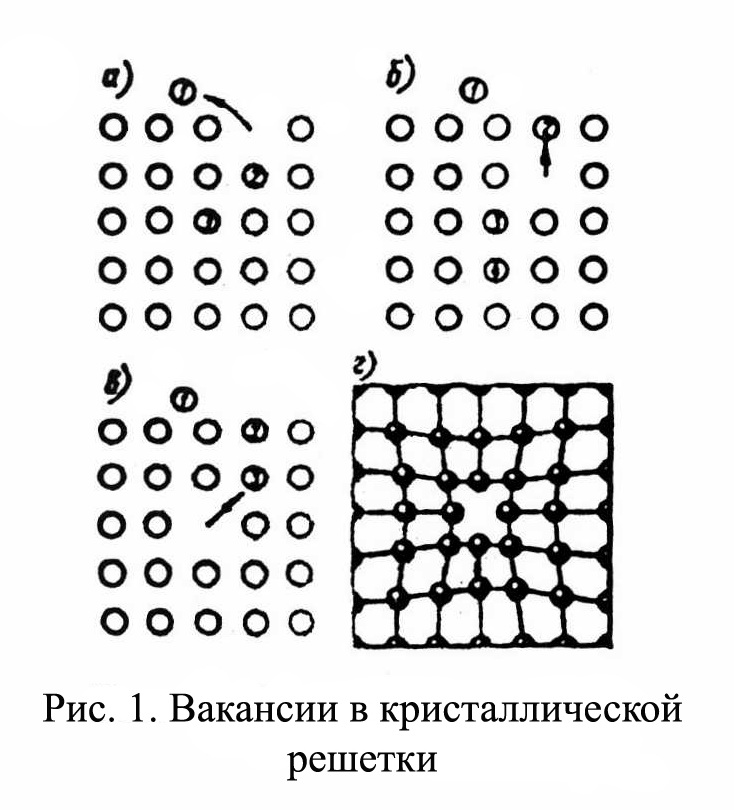 Рис.1.6. Вакансии Рис.1.6. Вакансии Атомы совершают колебательные движения возле узлов решетки. Под воздействием внешних воздействий (например, температуры) отдельные атомы приобретают энергию, значительно большую, чем средняя энергия соседних атомов в решетке. Эти атомы могут перемещаться из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находились такие атомы, называется вакансией (рис.1.6). На это место перемещается один из соседних атомов и т.д. Таким образом, вакансия перемещается вглубь кристалла. При комнатной температуре концентрация вакансий сравнительно невелика и составляет около 1 на 1018 атомов, но количество вакансий в кристаллической решетке резко возрастает при нагреве и может достигать огромных величин. Так, например, в решетке некоторых металлов в 1 см3 количество вакансий может достигать 1013. К точечным дефектам относят также атомы, внедренные в междоузлие кристаллической решетки (рис.1.7 а) и замещенные атомы, когда место атома основного металла замещается в кристаллической решетке атомом другого элемента (рис.1.7 б). 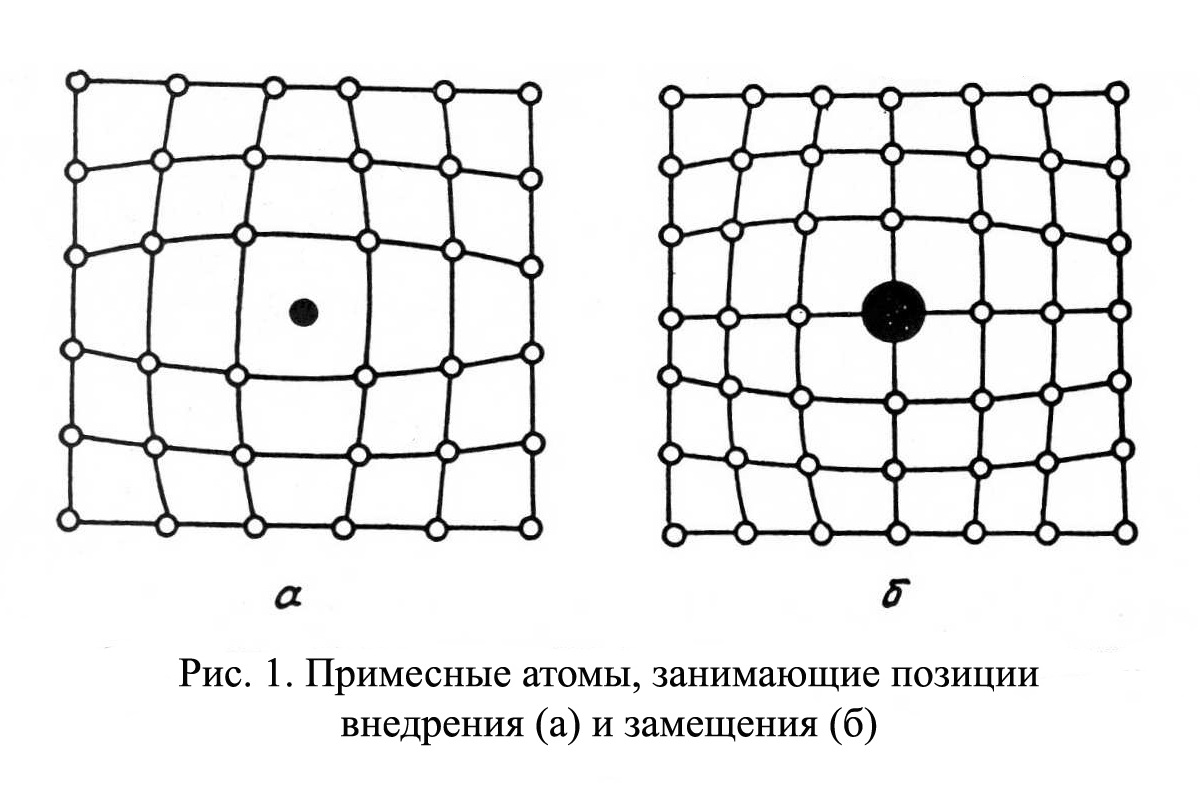 Рис. 1.7. Примесные атомы внедрения (а) и замещения (б). Точечные дефекты приводят к локальным искажениям в кристаллической решетке и локальным изменениям межатомных связей. С увеличением количества точечных дефектов может возрастать сопротивление кристаллической решетки дальнейшему смещению атомов. С другой стороны, присутствие вакансий в решетке объясняет возможность такого физического процесса, как диффузия. Диффузия – перемещение атомов на различные расстояния, превышающие межатомные для данного металла. Перемещение атомов осуществляется путем обмена местами с вакансиями. Поскольку с увеличением температуры резко возрастает количество вакансий, то очевидно, что и процессы диффузии активизируются и ускоряются с увеличением температуры. Точечные дефекты, перемещаясь по кристаллической решетке, могут объединяться в группы, образуя линейные дефекты. Скопление примесных атомов могут образовывать в определенных объемах решетки «лишнюю» кристаллографическую плоскость, а объединение вакансий, наоборот, формировать «недостающую» кристаллографическую плоскость. Линейные дефекты кристаллического строения характеризуются малыми размерами в двух измерениях и значительной протяженностью в третьем измерении. Такие дефекты называются дислокациями (рис.1.8). 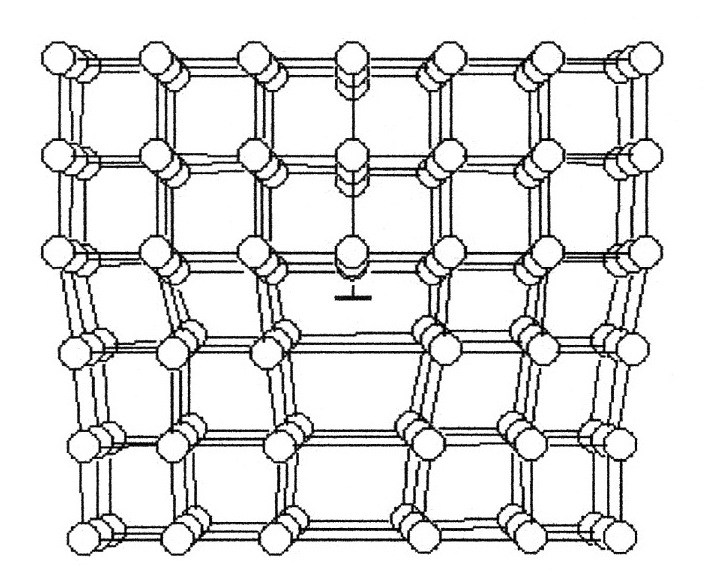 Рис.1.8. Схема расположения дислокации. Рис.1.8. Схема расположения дислокации.Основной вид дислокаций – краевая. В результате своего перемещения по кристаллу краевые дислокации могут выходить на поверхность кристалла. Из рис.1.8 и 1.9 видно, что атомы над краевой дислокацией испытывают сжатие, а нижние атомы – растяжение. Это приводит к значительным искажениям в той части кристаллической решетки, в которой находится дислокация, т.е. экстраплоскость. 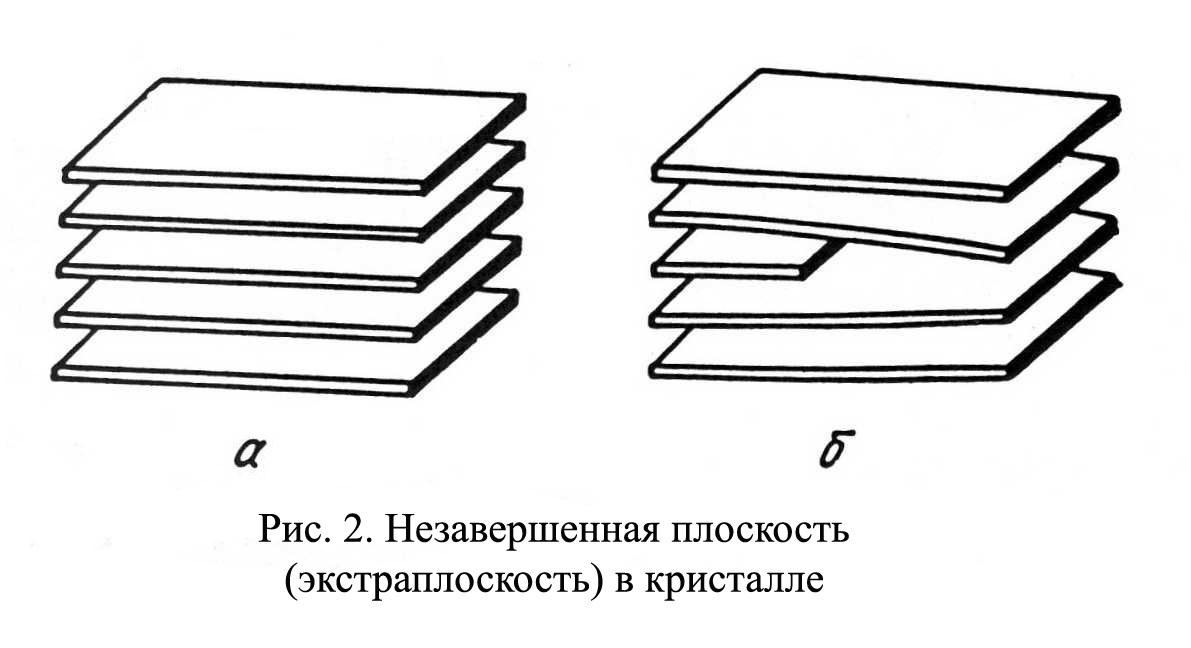 Рис. 1.9. Расположение кристаллографических плоскостей в идеальном кристалле (а) и незавершенная плоскость (экстраплоскость) в кристалле с дислокацией (б). Если экстраплоскость находится в верхней части кристалла (рис.1.10, а), то дислокацию называют «положительной» и обозначают значком «┴». Если находится в нижней части кристалла, то дислокацию называют «отрицательной» и обозначают значком «┬». Различие между положительными и отрицательными дислокациями чисто условное. Перевернув кристалл, мы превращаем положительную дислокацию в отрицательную и наоборот. Дислокации одного знака отталкиваются, а противоположного притягиваются. 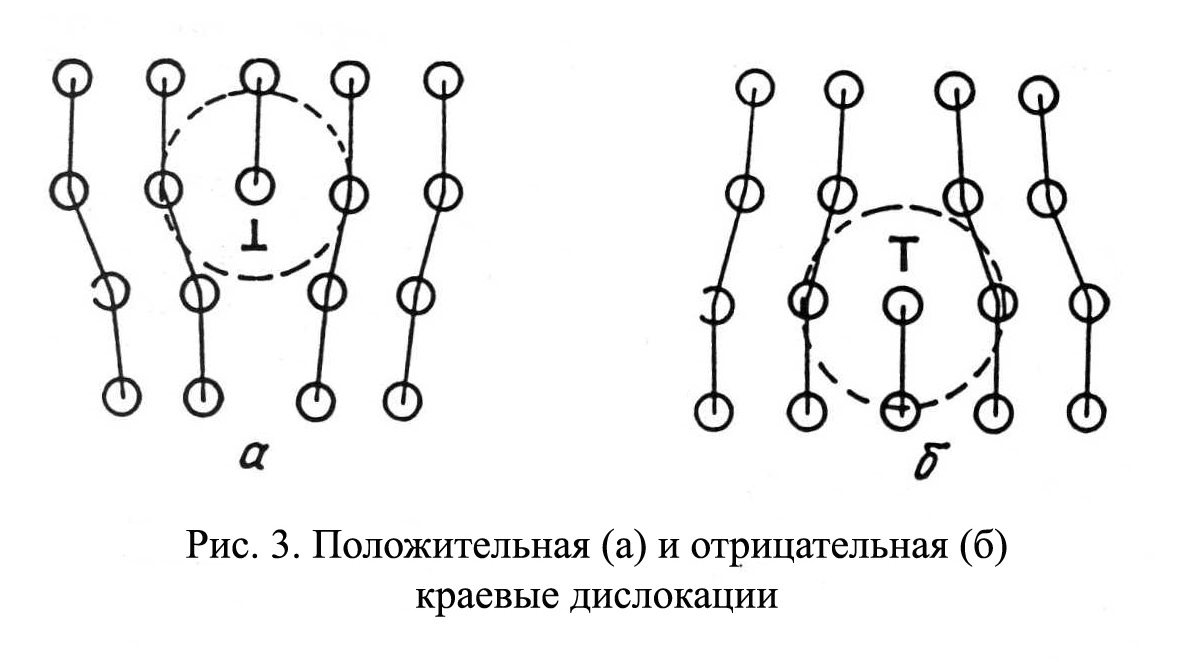 Рис. 1.10. Расположение положительной (а) и отрицательной (б) дислокаций. Дислокации внутри решетки могут взаимодействовать с точечными дефектами. Так, присоединение к лишней экстраплоскости атома внедрения перемещает дислокацию в направлении размещения этого атома. Присоединение к экстраплоскости вакансии, наоборот, перемещает дислокацию в направлении противоположном расположению вакансии. Кроме того, дислокации могут самостоятельно перемещаться по кристаллу под воздействием приложенных к металлу напряжений. Наиболее распространенный для металлов способ и механизм перемещения дислокаций является пластический сдвиг (скольжение) (рис.1.11а, б). Распространение скольжения дислокаций по плоскости скольжения происходит последовательно. Каждый шаг перемещения дислокации из одного положения в другое совер-шается разрывом лишь одной вертикальной атомной плоскости. При этом для перемещения дислокаций требуется значительно меньшее усилие, чем для жесткого смещения одной части кристалла относительно другой по кристаллографической плоскости. При движении дислокации вдоль направления сдвига (приложения нагрузки τ) через весь кристалл происходит смещение верхней и нижней части на одно межатомное расстояние. В результате перемещения дислокация выходит на поверхность кристалла, где остается так называемая «ступенька скольжения» (рис.1.11 в). Дислокации легче перемещаются в направлениях перпендикулярных экстраплоскости. С наличием дислокаций в кристаллах и возможностью их перемещения связан такой важный процесс, происходящий в металлах, как пластическая деформация. Любая пластическая деформация происходит в металлах только при приложении внешней нагрузки (напряжений). А движение дислокаций и начинается при приложении нагрузки, т.е. сама пластическая деформация связана с движением дислокаций. Таким образом, механизм пластической деформации заключается в движении и размножении дислокаций в кристалле. 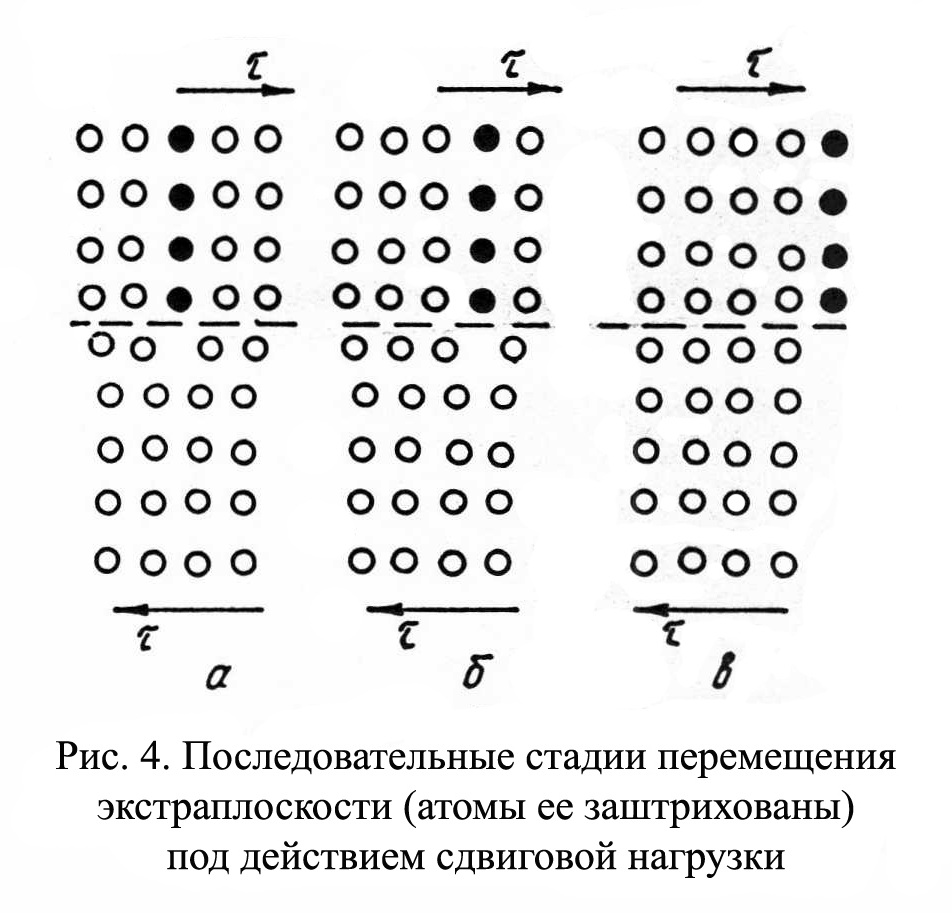 Рис.1.11. Стадии перемещения дислокаций. Рис.1.11. Стадии перемещения дислокаций.Помимо краевых дислокаций в кристаллах могут образовываться винтовые дислокации (рис. 1.12). Винтовые дислокации могут образовываются путем частичного сдвига атомных слоев внутри кристалла. Кристалл как бы закручивается винтом вокруг линии воображаемого разреза. Образование винтовой дислокации носит очень сложный характер. Основной вклад в процесс пластической деформации вносят дислокации краевые, поэтому в дальнейшем основное внимание будет уделено краевым дислокациям. 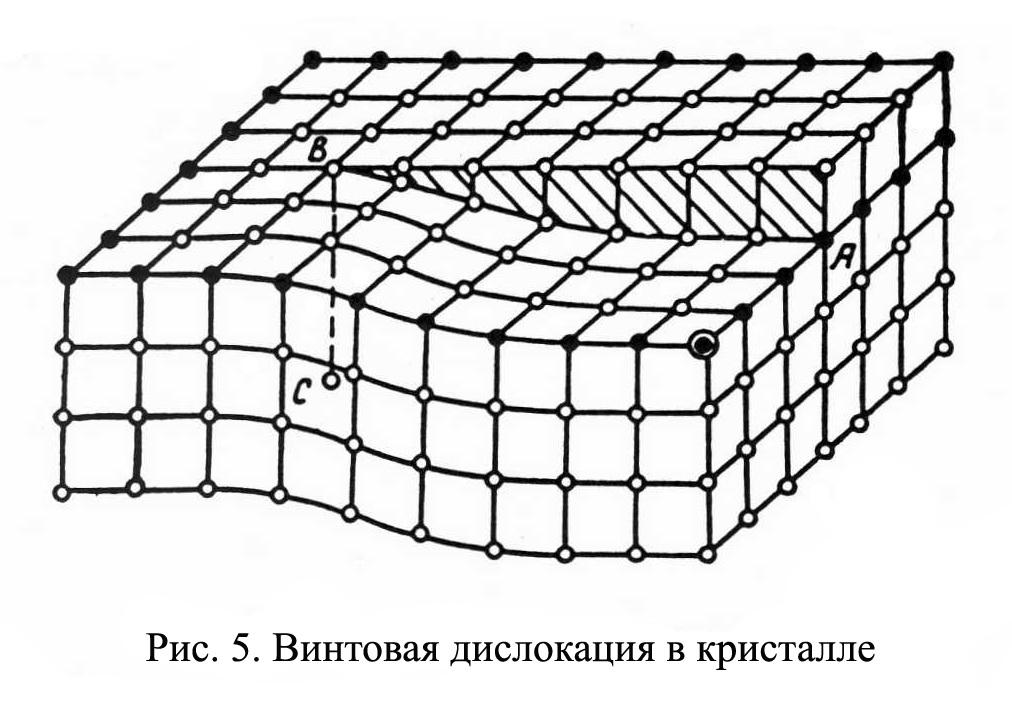 а) а)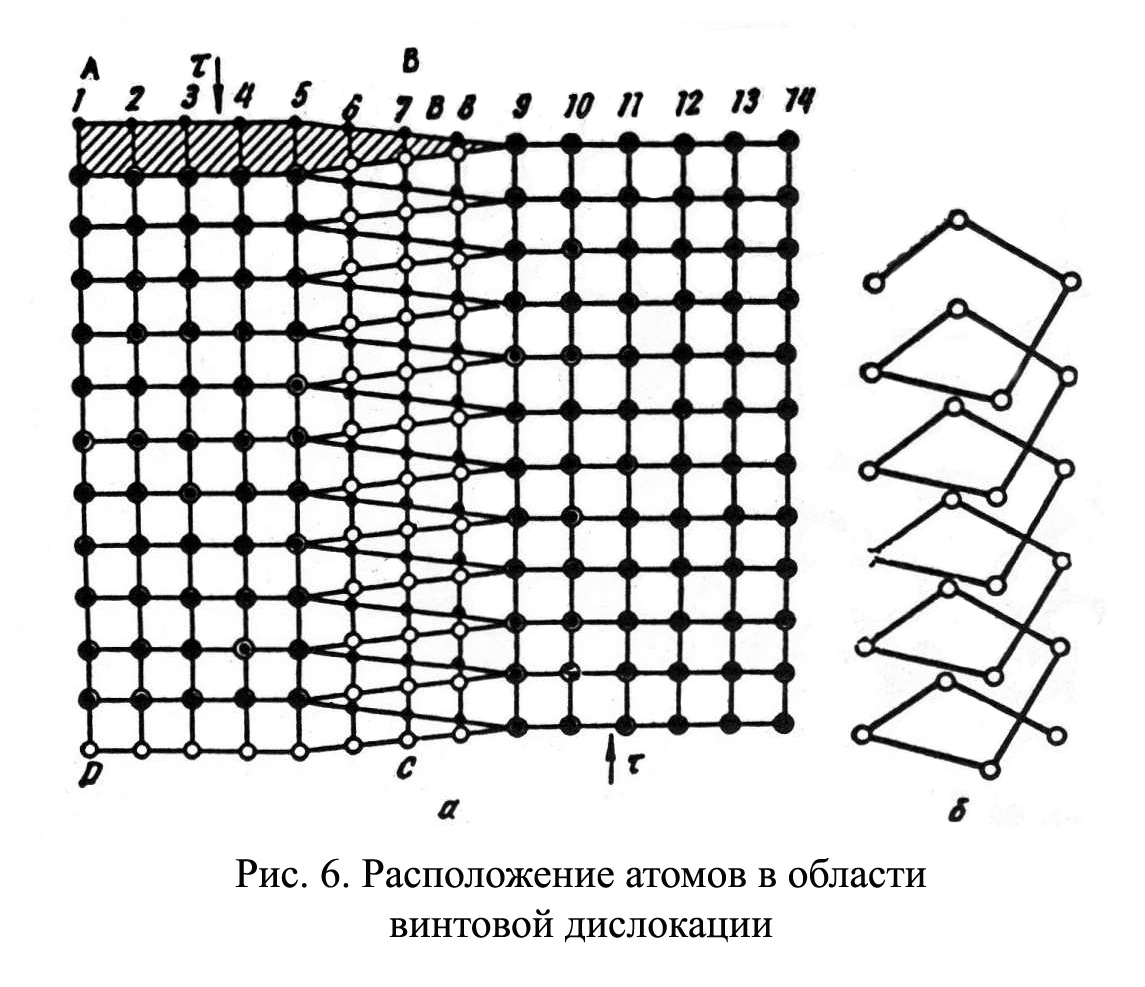 б) б)Рис. 1.12. Схема образования (а) и расположение атомов (б) винтовой дислокации в кристалле. Количество дислокаций в кристаллах может достигать большой величины и рассчитывается через плотность дислокаций ρ. ρ=∑ l / V Под плотностью дислокаций понимают суммарную длину дислокаций ∑ l приходящуюся на единицу объема V кристалла. Размерность плотности дислокаций см/см3 или см-2. В исходном состоянии плотность дислокаций в металлах около 106 - 103. После пластической деформации плотность дислокаций значительно возрастает и может составлять 1011 - 1012. Плотность дислокаций определяется экспериментально по специальным методикам и при очень большом увеличении. Подсчитывается число выходов дислокаций на единицу площади поверхности металла. Использование теории дислокаций позволило объяснить многие вопросы, связанные с изменением прочности металлов и сплавов. ЛЕКЦИЯ 2 ПРОЦЕССЫ КРИСТАЛЛИЗАЦИИ Кристаллизация – процесс перехода металла из жидкого состояния в твердое при определенной температуре. Рассмотрим термодинамические условия кристаллизации. Энергетическое состояние любой системы характеризуется определенным запасом внутренней энергии. Свободной энергией является такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Величина свободной энергии изменяется при изменении температуры: F= U - TS, где F— свободная энергия, U— полная внутренняя энергия системы, Т — температура, S— энтропия. Согласно второму закону термодинамики всякая система стремится к минимальному значению свободной энергии. Любой самопроизвольный процесс идет только в том случае, если новое состояние более устойчиво, т.е. обладает меньшим запасом свободной энергии. Процесс кристаллизации подчиняется этому же закону. Металл затвердевает, если меньшей свободной энергией обладает твердое состояние, и плавится в том случае, когда меньшей свободной энергией обладает жидкое состояние. Изменение свободной энергии жидкого и твердого состояния при изменении температуры показано на рис.2.1. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояний вещества. 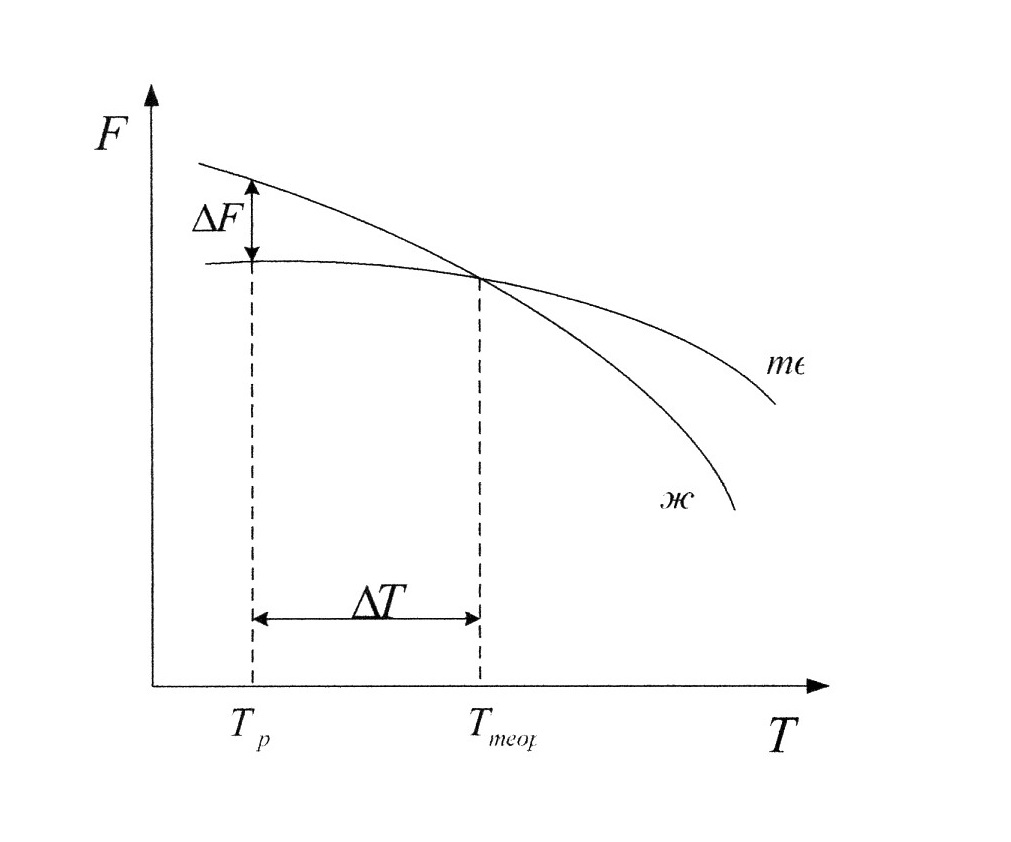 Рис. 2.1. Влияние температуры на изменение свободной энергии жидкого и твердого состояния. Различают теоретическую и реальную температуру кристаллизации. Tт — теоретическая, или равновесная температура кристаллизации, при которой Fж = Fmв. При этой температуре равновероятно существование металла как в жидком, так и в твердом состояниях. Реальная же кристаллизация начнется только тогда, когда этот процесс будет термодинамически выгоден системе |
