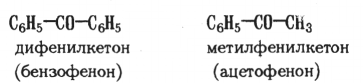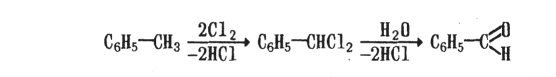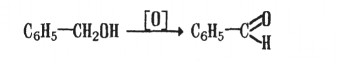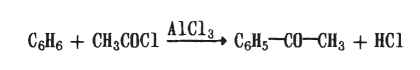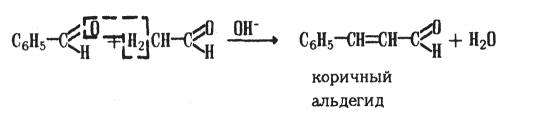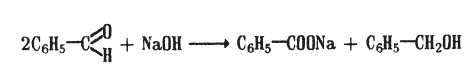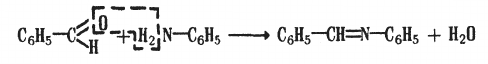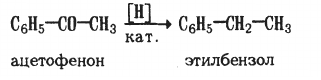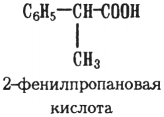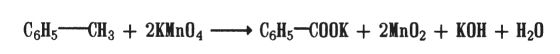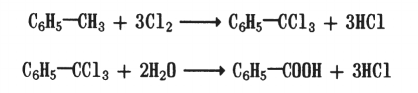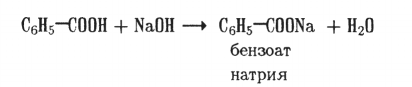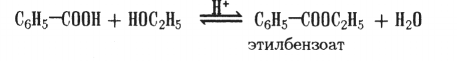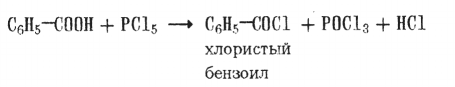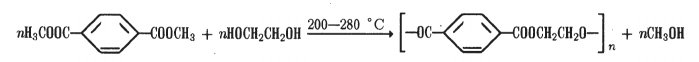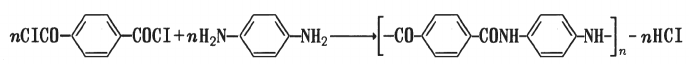|
Скачать 490.96 Kb.
Название
|
Ароматические карбонильные соединения
|
Анкор
|
Лекция 27. Аром. альдегиды и кетоны.docx
|
Дата
|
12.12.2017
|
Размер
|
490.96 Kb.
|
Формат файла
|
|
Имя файла
|
Лекция 27. Аром. альдегиды и кетоны.docx
|
Тип
|
Документы
#10964
|
|
Подборка по базе: Металловедение лекция №6 19.09.pdf, воспалительные заболевания лекция..docx, Сот эксперт лекциялар 2020.docx, Баскару 1 лекция (1).pptx, 9 лекция.docx, KM 17 Лекция 01.10. 2020.docx, КМ 06 Лекция 09.09.2020Қамырды бөлу. Қамырды тындыру.docx, БҰАМ 03 Лекция 02.09.2020 Мейрамхана келушілеріне қызмет көрсет, реферат лекция геоурб 5.docx, Оба ауруы лекция.docx
Ароматические карбонильные соединения
Классификация. Номенклатура. Изомерия. Способы получения. Физические свойства и строение. Химические свойства: реакции окисления и восстановления; присоединение нуклеофильных реагентов; конденсация с алифатическими альдегидами и кетонами, реакция Канниццаро, Перкина и бензоидной конденсации, их механизмы; реакции электрофильного замещения в ареновом цикле. Геометрическая изомерия оксимов альдегидов и кетонов. Перегруппировка Бекмана, ее механизм и практическое значение.
Хиноны. Классификация. Номенклатура. Способы получения, строение и свойства бензохинонов.
Ароматические карбонильные соединения
Ароматические альдегиды – органические соединения, в молекулах которых альдегидная группа связана с бензольным ядром или с атомом углерода боковой цепи.
Названия ароматических альдегидов первого типа обычно производят от названий соответствующих им ароматических кислот, в которые они превращаются при окислении.
По систематической номенклатуре (ИЮПАК) названия альдегидов, в которых карбонильная группа непосредственно связана с атомом углерода бензольного кольца, образуют добавлением слова -карбальдегид к названию циклической системы.
Представителями альдегидов первого типа являются:
(бензальдегид) п-метилбензальдегид (рациональная)
бензолкарбальдегид 4-метилбензолкарбальдегид (ИЮПАК)
анисовый альдегид
м-нитробензальдегид м-метоксибензальдегид
3-нитробензолкарбальдегид 3-метоксибензолкарбальдегид
Если в циклической системе есть другая группа, имеющая преимущества при перечислении, то альдегидную группу обозначают префиксом формил-:
терефталевый альдегид
4-формилбензолсульфокислота 1,4-бензолдикарбальдегид
Ароматические альдегиды с карбонильной группой в боковой цепи рассматривают как производные алифатических альдегидов:
За основу названия берут названия соответствующих альдегидов алифатического ряда по рациональной или систематической номенклатуре (ИЮПАК):
фенилуксусный альдегид п-толилуксусный альдегид
фенилацетальдегид
фенилэтаналь п-толилэтаналь
Ароматические кетоны – это органические соединения, в молекулах которых карбонильная группа связана с двумя ароматическими радикалами.
Если один из связанных с карбонильной группой радикалов ароматический, а второй – алифатический, то такие кетоны называют жирноароматическими:
Ароматические кетоны часто называют по радикальному принципу (радикально-функциональная номенклатура). При этом радикалы перечисляют в порядке возрастания сложности (или в алфавитном порядке), а в конце названия ставят слово кетон.
Для названия ароматических кетонов используются также тривиальные названия (бензофенон, ацетофенон).
По систематической номенклатуре название кетона образуют из названия соответствующего алифатического углеводорода, рассматривая циклическую систему как замещающий радикал, и суффикса –он:
4-фенилбутанон-2
Способы получения ароматических карбонильных соединений
1. Способы получения ароматических альдегидов
Ароматические альдегиды можно получать следующими способами:
1. Формилирование ароматических соединений
(синтез Гаттермана-Коха)
Действие на ароматические углеводороды смесью монооксида углерода с хлористым водородом в присутствии катализаторов (AlCl3, Cu2Cl2) приводит к образованию ароматических альдегидов:
толуол п-толуиловый альдегид
Механизм реакции:
2. Формилирование по Вильсмейеру
где Х – электронодонорный заместитель, например –N(CH3)2
3. Гидролиз геминальных дигалогенопроизводных ароматического ряда
Бензальдегид можно получить превращением толуола в хлористый бензилиден с его последующим гидролизом. Гидролиз проводят в присутствии гидроксида кальция и железного катализатора при температуре 95-1000С:
толуол хлористый бензальдегид
Бензилиден
4. Окисление ароматических углеводородов
Получение ароматических альдегидов, особенно бензальдегида, окислением ароматических углеводородов кислородом воздуха является промышленным способом:
5. Окисление ароматических спиртов
бензиловый спирт бензальдегид
6. Восстановление хлорангидридов ароматических карбоновых кислот
Для восстановления хлорангидридов применяют водород в присутствии палладиевого катализатора:
бензоилхлорид бензальдегид
2. Получение ароматических кетонов
1. Ацилирование по Фриделю-Крафтсу
Ароматические кетоны обычно получают действием хлорангидридов или ангидридов карбоновых кислот на ароматические углеводороды в присутствии катализатора AlCl3:
ацетилхлорид ацетофенон
бензоилхлорил бензофенон
Механизм реакции
2. Окисление вторичных ароматических спиртов
метилфенилметанол ацетофенон
дифенилметанол бензофенон
3. Перегруппировка Фриса
Ароматические кетоны могут быть получены перегруппировкой сложных эфиров фенола:
Физические свойства и строение
Ароматические альдегиды – нерастворимые в воде жидкости с запахом горького миндаля. Чем дальше от ароматического ядра расположена альдегидная группа, тем более резким становится запах.
Ароматические кетоны – жидкости или твердые вещества, нерастворимые в воде. Многие кетоны имеют приятный цветочный запах (например, ацетофенон имеет запах черемухи).
Строение ароматических карбонильных соединения
Карбонильная группа, как и все заместители П рода, влияет на распределение электронной плотности бензольного кольца за счет –I и –M-эффектов (π,π-сопряжение), которые действуют в одном направлении и приводят к понижению электронной плотности в кольце, особенно в орто- и пара-положениях бензольного кольца:
Поэтому электрофильный реагент вступает преимущественно в мета-положение ароматического кольца, где дефицит электронной плотности наименьшей.
При этом карбонильная группа оказывает на связанное с ней бензольное кольцо значительно меньшее влияние, чем нитро- и карбоксильная группа.
Поэтому галогенирование, нитрование и сульфирование ароматических альдегидов и кетонов проводят в более мягких условиях, чем нитробензола и бензойной кислоты.
Вследствие наличия π,π-сопряжения бензольного кольца и карбонильной группы эффективный положительный заряд (δ+) на углеродном атоме карбонильной группы понижен, особенно в случае диарилкетонов.
Поэтому реакционная способность ароматических карбонильных соединений в реакциях с нуклеофильными реагентами понижена по сравнению с алифатическими.
Химические свойства ароматических карбонильных соединений
Ароматические альдегиды и кетоны, содержащие одновременно карбонильную группу и ароматическое ядро, осуществляют реакции, характерные для:
1) карбонильной группы;
2) ароматического ядра;
3) взаимным влиянием карбонильной группы и ароматического ядра, т.е. специфических реакций, не характерных для карбонильных соединений алифатического ряда, которые обусловлены сопряжением карбонильной группы с ароматическим ядром и отсутствием у ароматических альдегидов подвижных атомов водорода в α-положении.
1. Реакции карбонильной группы
1. Реакции нуклеофильного присоединения
Ароматические альдегиды и кетоны способны вступать в большинство реакций с нуклеофильными реагентами, характерные для алифатических карбонильных соединений.
Однако реакционная способность ароматических карбонильных соединений с нуклеофильными реагентами понижена по сравнению с алифатическими вследствие эффекта π,π-сопряжения бензольного кольца с карбонильной группой.
Ароматические карбонильные соединения способны присоединять магнийорганические соединения, синильную кислоту, бисульфит натрия (присоединяют только ароматические альдегиды)
Ароматические альдегиды и кетоны образуют обычные производные в результате замещения карбонильного кислорода – оксимы, гидразоны, азометины (основания Шиффа). Однако реакция с аммиаком для ароматических альдегидов протекает иначе, чем для алифатических.
1.1. Взаимодействие с аммиаком
В отличие от алифатических альдегиды ароматического ряда взаимодействуют с аммиаком в соотношении 3:2.
В этом случае из бензальдегида образуется гидробензамид, превращающийся при нагревании в присутствии кислот в амарин:
1.2. Взаимодействие с первичными ароматическими аминами
При нагревании ароматических альдегидов с анилином образуются азометины (шиффовы основания):
азометин
(основание Шиффа)
1.3. Взаимодействие с гидроксиламином
Ароматические альдегиды и кетоны при взаимодействии с гидроксиламином образуют оксимы:
Наибольший интерес представляют оксимы несимметричных ароматических кетонов, которые могут существовать в виде двух геометрических изомеров: син- (цис-) и анти- (транс-).
Название геометрического изомера определяется взаимным расположением гидроксильной группы и старшего заместителя.
Более стабильной является анти-форма, которую можно получить из син-формы действием кислот, а облучением можно превратить анти-форму в син-форму:
син- (цис-) анти- (транс-)
Перегруппировка Бекмана
При обработке оксимов ароматических кетонов сильными кислотами происходит перегруппировка Бекмана и образуются амиды карбоновых кислот. Причем направление этой перегруппировки зависит от конфигурации кетоксима. Наличие электроноакцепторных заместителей в бензольном ядре повышает стабильность стереоизомерных оксимов.
Оксим син-конфигурации в присутствии сильной минеральной кислоты дает N-метиламид замещенной бензойной кислоты:
N-метиламид
м-нитробензойной кислоты
Из оксима анти-конфигурации в тех же условиях получают соответствующий амид уксусной кислоты:
амид уксусной кислоты
2. Реакции конденсации
2.1. Реакции конденсации ароматических альдегидов
1) Конденсация Клайзена-Шмидта
Ароматические альдегиды легко вступают в реакции конденсации с алифатическими альдегидами и кетонами, жирно-ароматическими кетонами и эфирами карбоновых кислот алифатического ряда в присутствии водных растворов щелочей с образованием α,β-ненасыщенных карбонильных соединений.
В этих реакциях, протекающих по типу альдольно-кротоновой конденсации, ароматические альдегиды ведут себя как карбонильные компоненты:
- реакция с алифатическими альдегидами:
- реакция с алифатическими кетонами:
- реакция с жирно-ароматическими кетонами:
- реакция с эфирами карбоновых кислот алифатического ряда
2) Конденсация Перкина
(конденсация с ангидридами карбоновых кислот)
Характерной реакцией ароматических альдегидов является их конденсация с ангидридами карбоновых кислот в присутствии ацетатов или карбонатов щелочных металлов.
В этом случае ароматические альдегиды выступают как активные карбонильные компоненты, а ангидриды играют роль метиленовой компоненты.
Продуктами конденсации Перкина являются коричные кислоты:
3) Бензоиновая конденсация
В условиях цианогидринного синтеза ароматические альдегиды в отличие от альдегидов алифатического ряда подвергаются бензоиновой конденсации (Н.Н.Зинин).
Если обработка алифатических альдегидов водно-спиртовыми растворами цианидов щелочных металлов приводит к образованию нитрилов α-гидроксикарбоновых кислот:
Бензальдегид в этих же условиях подвергается димеризации с образованием α-гидроксикетона – бензоина, который легко окисляется в дикетон – бензил:
4) Конденсация альдегидов с фенолами
Большое значение в синтезе красителей трифенилметанового ряда имеют реакции бензальдегида с фенолами за счет подвижных атомов водорода в пара-положении фенольного ядра:
2.2. Реакции конденсации ароматических кетонов
1) Конденсация Клайзена-Шмидта
Жирно-ароматические кетоны способны к различным реакциям конденсации за счет α-водородных атомов по отношению к карбонильное группе:
Реакция конденсации с участием двух молекул ацетофенона протекает в более жестких условиях: при температуре 4500С и с участием катализатора:
3. Действие галогенов на карбонильные соединения
Жирно-ароматические кетоны благодаря подвижности водородных атомов у α-углеродного атома весьма склонны к реакциям замещения водородных атомов:
Бензальдегид при действии хлора реагирует иначе – образуется хлорангидрид бензойной кислоты:
4. Реакции окисления
Ароматические альдегиды и кетоны легче вступают в реакции окисления, чем алифатические.
4.1. Окисление альдегидов
1) Автоокисление
Одна из особенностей ароматических альдегидов – их способность самопроизвольно окисляться кислородом воздуха до кислот (автоокисление).
Этот процесс ускоряется на свету и в присутствии катализаторов – солей тяжелых металлов.
Механизм реакции
Окисление протекает по цепному радикальному механизму, причем в качестве промежуточных продуктов реакции образуются гидропероксиды:
Поэтому ароматические альдегиды при длительном хранении должны быть стабилизированы антиоксидантами (гидрохинон).
2) Окисление аммиачным раствором гидроксида серебра
Если с бензольным кольцом ароматического альдегида связан электроно-донорный заместитель, то альдегидную группу можно окислить до карбоксильной группы аммиачным раствором гидроксида серебра:
4.2. Окисление кетонов
Жирно-ароматические кетоны окисляются иначе и легче, чем алифатические.
При окислении оксидом селена (SeO2) жирно-ароматические кетоны дают альдегидокетоны или α-дикетоны:
этилфенилкетон α-дикетон
При действии более сильных окислителей образуются ароматические кислоты:
5. Реакции восстановления
5.1. Восстановление альдегидов
Ароматические альдегиды могут быть легко восстановлены в соответствующие спирты и углеводороды:
Для восстановления альдегидов, содержащих в кольце заместители, склонные к реакциям восстановления, обычно подбирают восстановитель, обладающий высокой селективностью, например NaBH4:
м-нитробензальдегид
5.2. Восстановление кетонов
Восстановление ароматических кетонов в различных условиях приводит к образованию разных продуктов.
1) Каталитическое восстановление жирно-ароматических кетонов
Каталитическое восстановление кетонов, в которых функциональная группа непосредственно связана с бензольным кольцом, приводит к образованию ароматических спиртов, а затем углеводородов:
ацетофенон α-фенилэтиловый спирт этилбензол
2) Восстановление чисто ароматических кетонов
При обработке чисто ароматических кетонов щелочными металлами в апротонных растворителях образуются пинаконы, которые способны при действии кислот перегруппировываться в пинаколины:
Необходимо отметить, что чисто ароматические кетоны, особенно содержащие электронодонорные группы, не всегда легко восстанавливаются до соответствующих одноатомных спиртов.
Обычно эта реакция протекает при восстановлении дибораном в момент его образования:
3 NaBH4 + 4 BF3 → 3 NaBF4 + 2 [B2H6]
6. Окислительно-восстановительные реакции
1. Реакция Канниццаро
Ароматические альдегиды в присутствии 50%-ного водного и спиртового раствора КОН или NaOH образуют соответствующие спирт и соль кислоты:
бензальдегид бензиловый спирт натриевая соль
бензойной кисдлты
Аналогичную реакцию дают неенолизирующиеся альдегиды алифатического ряда, т.е. не имеющие подвижных атомов водорода в α-положении (например, формальдегид H-CHO и альдегиды R3C-CHO).
2. Смешанная реакция Канниццаро
При нагревании ароматического альдегида с избытком формальдегида в присутствии концентрированного раствора NaOH ароматический альдегид полностью восстанавливается в соответствующий спирт, в то время как формальдегид окисляется в муравьиную кислоту:
2. Реакции электрофильного замещения
Карбонильная группа является электроноакцепторным заместителем, дезактивирует ароматическое кольцо в реакциях электрофильного замещения и направляет электрофильный агент в м-положение.
1. Реакции нитрования
Нитрование бензальдегида осуществляется смесью безводного нитрата калия и концентрированной серной кислоты при температуре 00С:
м-нитробензальдегид
Нитрование ацетофенона легко осуществляется нитрующей смесью при температуре 00С:
м-нитроацетофенон
2. Реакции галогенирования
Ароматические альдегиды и кетоны при галогенировании в присутствии апротонных кислот Льюиса дают обычно смесь продуктов мета- и орто-замещения.
Но можно проводить реакцию таким образом, чтобы замещение проходило только по мета-положению.
Для этого реакцию проводят с избытком катализатора AlCl3 и галогенированию подвергается комплекс карбонильного соединения с хлоридом алюминия:
м-бромацетофенон
3. Специфические реакции ароматических кетонов
1. Нагревание с гидроксидом натрия
При нагревании с твердой щелочью бензофенон расщепляется с образованием бензола и бензоата натрия:
2. Расщепление амидом натрия
Чисто ароматические кетоны расщепляются амидом натрия с образованием амидов кислот:
3. Образование металлкетилов
При обработке чисто ароматических кетонов натрием или калием в инертном растворителе образуются окрашенные производные с парамагнитными свойствами, называемые металлкетилами:
Отдельные представители
Бензальдегид – бесцветная жидкость с запахом горького миндаля, т. кип. 179.5°С. На воздухе он быстро окисляется в бензойную кислоту. Бензальдегид встречается в природе в виде гликозида амигдалина в масле горьких миндалей, в косточках вишни, абрикоса, персика и т.д. Амигдалин под действием ферментов дает бензальдегид, синильную кислоту и дисахарид генцибиозу. Бензальдегид в промышленности получают каталитическим окислением толуола. Широко применяется в синтезе красителей, лекарств и душистых веществ.
Коричный альдегид С6Н5-СН=СН-СНО – применяется в парфюмерной промышленности.
Ацетофенон – имеет запах цветов черемухи. Встречается в каменноугольной смоле. В промышленности его получают каталитическим окислением этилбензола кислородом воздуха. Применяется в парфюмерии.
Бензофенон – также применяется в парфюмерной промышленности, галлогенпроизводные о-аминобензофенона используются в синтезе успокаивающих лекарственных препаратов (транквилизаторов).
|
АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ И КЕТОНЫ
Ароматические альдегиды — органические соединения, в молекулах которых альдегидная группа связана с бензольным ядром или углеродом боковой дели.
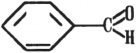
Строение. Представителем альдегидов первого типа является бензойный альдегид (бензальдегид).
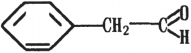
Примером альдегидов второго типа служит фенилуксусный альдегид (фенилацетальдегид):
Ароматические кетоны — это соединения, в молекулах которых карбонильная группа связана с двумя ароматическими радикалами.
Если один радикал ароматический, а другой — алифатический, то такие кетоны называют слгешанными (жирно-ароматическими): '
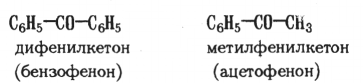
Номенклатура. Названия ароматических альдегидов обычно связывают с названиями соответствующих им ароматических кислот, в которые они переходят при окислении. По систематической номенклатуре к названию циклической системы добавляют окончание -кар б альдегид. Например, бензальдегид называют также бензенкарбальдегидом.
Названия кетонов часто связаны с названиями радикалов, например дифенилкетон, метилфенилкетон и т.д. По систематической номенклатуре названия составляют из названия соответствующего углеводорода, рассматривая циклические системы как замещающие радикалы, и окончания -он: СбЩСОСНз — фенилэтанон.
Изомерия. Изомерия ароматических альдегидов может быть связана с различным положением заместителей в бензольном ядре, а кетонов — еще и с положением карбонильной группы в боковой цепи.
Получение. Ароматические альдегиды можно получать:
1. Гидролизом ароматических галогенопроизводных:
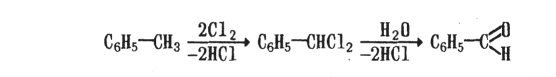
2. Окислением первичных ароматических спиртов:
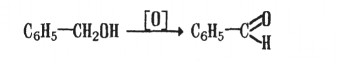
Для получения ароматических кетонов можно использовать следующие реакции:
1) окисление вторичных ароматических спиртов:
2) реакцию Фриделя—Крафтса:
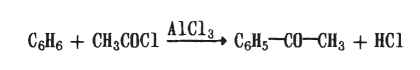
Физические свойства. Ароматические альдегиды — нерастворимые в воде жидкости. Имеют запах горького миндаля. С удалением альдегидной группы от ароматического ядра запах становится более резким.
Ароматические кетоны — жидкости или твердые вещества. Не растворяются в воде. Многие кетоны имеют приятный цветочный запах (например, ацетофенон пахнет черемухой).
Химические свойства. Ароматические альдегиды по своей активности напоминают альдегиды алифатического ряда. Они легко окисляются, участвуют в реакциях присоединения, замещения и т.д. Так, при восстановлении бензальдегид превращается в бензиловый спирт. Однако в отличие от алифатических альдегидов они не вступают в реакции альдолыюй конденсации (сами с собой), так как у них альдегидная группа соседствует с третичным углеродным атомом. Но они могут взаимодействовать с альдегидами и кетонами алифатического ряда:
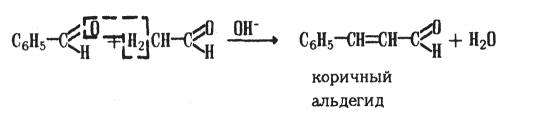
Вступая в реакцию Канниццаро, ароматические альдегиды в присутствии щелочи образуют спирт и соли кислоты:
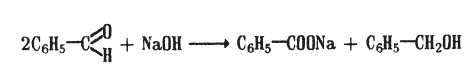
При нагревании с анилином можно получать азометины (Шиффовы основания):
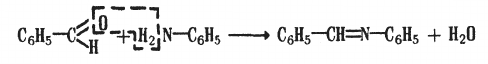
Одна из особенностей ароматических альдегидов — их способность самоокисляться на воздухе:
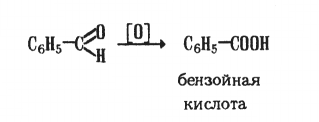
Окисление катализируется действием света или солями некоторых металлов.
Ароматические альдегиды с альдегидной группой в боковой цепи практически не отличаются в химическом отношении от альдегидов алифатического ряда.
Ароматические кетоны отличаются от кетонов алифатического ряда меньшей реакционной способностью.
При каталитическом восстановлении смешанных кетонов, имеющих карбонильную группу рядом с бензольным кольцом, образуются гомологи бензола:
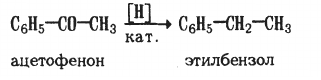
Смешанные кетоны при действии сравнительно сильных окислителей превращаются в ароматические кислоты:
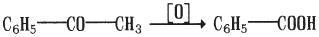
Отдельные представители. Бензальдегид (бензен- карбальдеги д)СбН5СН0 — жидкость с запахом горького миндаля, т.кип. 179 °С. Применяют в производстве красителей и многих органических веществ (арилметановых красителей, душистых соединений и т.д.). Используют в парфюмерии и пищевой промышленности.
Коричный альдегид (3-ф енилпропеналь) С6Н5-СН=СН-СН0 — жидкость с т.кип. 252 °С (с разложением). Используют в парфюмерии и пищевой промышленности (душистое вещество).
Салициловый альдегид (2-г идроксибен- зальдеги д) о-НО-С6Н4—1СНО — жидкость с т.кип. 196 °С. Служит для получения многих органических веществ, в том числе инсектицидов.
Ацетофенон (фенилэтанон, или метилфе- н и л к е т о н)С6Н5—С0СН3 — вещество с т.пл. 20 °С (т.кип. 202 °С). Используют в парфюмерии в качестве душистого вещества для отдушки мыла (запах черемухи) и в производстве лекарственных веществ.
АРОМАТИЧЕСКИЕ КАРБОНОВЫЕ КИСЛОТЫ
Ароматические карбоновые кислоты — органические вещества, молекулы которых содержат карбоксильную группу, связанную непосредственно с бензольным ядром или с атомом углерода боковой цепи:
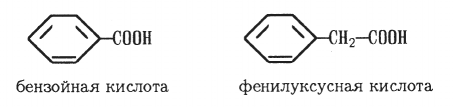
Строение. В зависимости от числа карбоксильных групп ароматические кислоты делятся на одно-, двух- и многоосновные.
Номенклатура. Названия кислот с карбоксильной группой, соединенной непосредственно с бензольным ядром, связаны с названием ароматических углеводородов, например толуоловая кислота (тривиальная номенклатура):
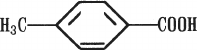
или по систематической номенклатуре — п-метилбензенкарбоновая.
Бели карбоксильная группа находится в боковой цепи, то названия таких кислот по систематической номенклатуре производят от названия соответствующих кислот алифатического ряда:
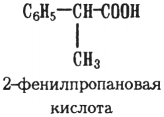
Изомерия. Изомерия одноосновных ароматических карбоновых кислот зависит от положения заместителей в бензольном ядре. Кроме этого ароматические кислоты с карбоксильной группой в бензольном ядре могут быть изомерны ароматическим кислотам с карбоксилом в боковой цепи. наНапример: 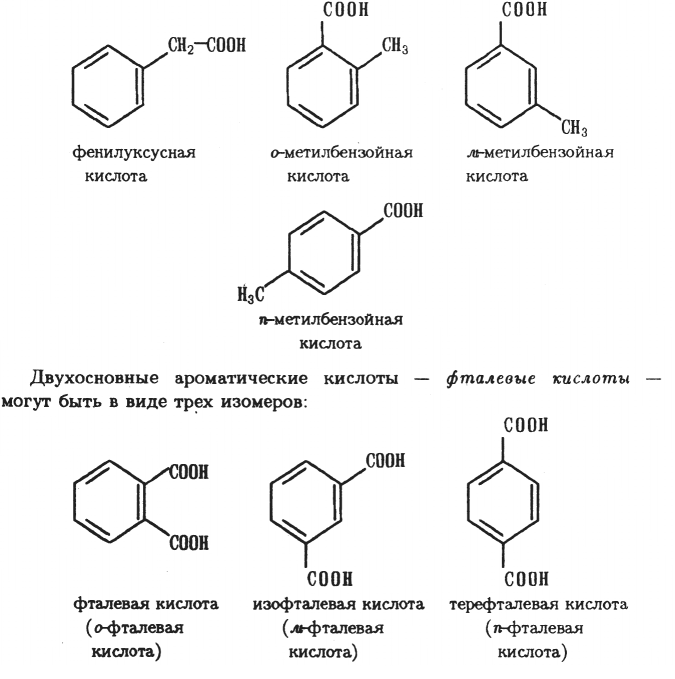
Получение. Одноосновные ароматические кислоты, например бензойную, можно получать следующими способами:
1. Окислением спиртов и альдегидов, омылением нитрилов и т.д. Эти способы использовались и для получения кислот алифатического ряда.
2. Окислением гомологов бензола, например толуола:
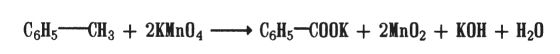
При действии на калиевую соль бензойной кислоты любой минеральной кислотой выделяют свободную бензойную кислоту.
В промышленности бензойную кислоту получают окислением толуола кислородом воздуха при 140 ‘Си небольшом давлении. В качестве катализатора используют оксид хрома. Для получения двухосновных ароматических кислот проводят окисление гомологов бензола с соответствующим числом заместителей и их положением. Например:
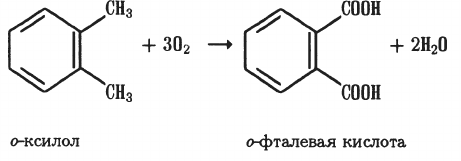
о-ксилол о-фталевая кислота
3. Гидролизом ароматических тригалогенопроизводных (с галогенами при одном и том же углеродном атоме):
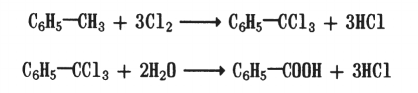
Физические свойства. Одноосновные и многоосновные ароматические кислоты — кристаллические вещества, плохо или совсем нерастворимые в воде. Исключение составляет бензойная кислота, которая хорошо растворяется в горячей воде. Температуры плавления и кипения ароматических кислот выше, чем кислот алифатического ряда (с тем же числом углеродных атомов).
Химические свойства. Химические свойства ароматических кислот определяются карбоксильной группой, а также связанным с ней бензольным ядром.
Для ароматических кислот характерны все основные химические превращения, которые были рассмотрены для кислот алифатического ряда.
1. Кислотные свойства. Ароматические одноосновные кислоты — более сильные кислоты, чем их алифатические аналоги. Например, рА’а бензойной кислоты равно 4,20 (рА'а уксусной кислоты составляет 4,75). Это объясняется электроноакцепторным характером бензольного кольца, которое оттягивает электроны от карбоксильной группы (в противоположность действию алкильных радикалов, связанных с этой группой). Вместе с тем бензольное кольцо может проявлять и электронодонорные свойства (в сравнении с водородным атомом). В этом легко убедиться, сопоставляя кислотность муравьиной кислоты, рКа которой равно 3,75, с бензойной. Таким образом, говоря о природе бензольного ядра, необходимо учитывать его возможные электронодонорные или электроноакцепторные свойства, которые могут проявляться в зависимости от электронной природы групп, с которыми оно связано.
Сила бензойной кислоты может существенно изменяться в зависимости от взаимного расположения карбоксила и заместителя и от его природы (табл. 22).
Т а б л и ц а 22. Значения рГа некоторых замещенных бензойных кислот типа ХСбН4СООН (р^а бензойной кислоты = 4,20)
X
|
рАа
|
о-изомер
|
./м-изомер
|
rt-изомер
|
С1
|
2,94
|
3,83
|
3,99
|
Вг
|
2,85
|
3,81
|
4,00
|
сн3
|
4,08
|
4,27
|
4,37
|
ОСНз
|
4,09
|
4,09
|
4,47
|
ОН
|
2,98
|
4,08
|
4,58
|
no2
|
2,17
|
3,45
|
3,43
|
2. Солеобразовапие. Взаимодействуя со щелочами, ароматические кислоты образуют соли:
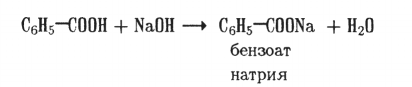
3. Образование сложных эфиров:
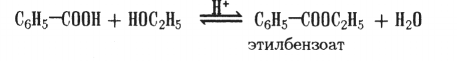
4. Образование галогенангидридов и ангидридов кислот:
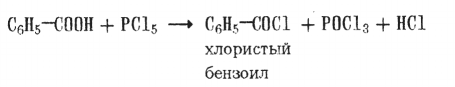
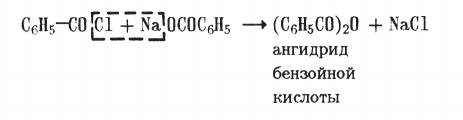
При взаимодействии хлористого бензоила с солями бензойной кислоты образуются ее ангидриды:
Двухосновные ароматические кислоты обладают более сильными кислотными свойствами, чем одноосновные. Остальные химические свойства практически не отличаются от химического поведения одноосновных кислот.
Ароматические кислоты с карбоксильной группой в боковой цепи в химическом отношении подобны алифатическим карбоновым кислотам.
Отдельные представители. Бензойная кислота (бен- зенкарбоновая) СеН5—СООН — белое кристаллическое вещество с т.пл. 122 °С. Применяют в производстве красителей и в качестве консервирующего средства.
Фенилуксусная кислота (фенилэтановая) CeHs-СН2С00Н — кристаллическое вещество с т.пл. 78 °С; рКа = 4,30.
Коричная кислота (3-ф енилпропеновая) Cf,H5—СН=СН—СООН известна в двух геометрических формах — цис-изомер (т.пл. 134 °С) и траис-изомер (т.пл. 68 °С). Эта кислота сочетает в себе свойства ароматической кислоты и непредельного соединения.
Салициловая кислота (о-гидроксибензой- н а я) о-НО—С6Н5—СООН — кристаллическое вещество с т.пл. 159 °С;
рКа = 3,0. С FeCl3 дает фиолетовое окрашивание (за счет фенольной группы). Используют в органическом синтезе и в производстве лекарственных препаратов (например, ацетилсалициловая кислота, применяемая как жаропонижающее средство).
Антраниловая кислота (о-a минобензойная) 0-H2N--CgHj-СООН — кристаллическое вещество с т.пл. 145 °С; pJa = 5,0. Используют для получения различных красителей, например индиго, и в многочисленных органических синтезах.
Хлористый бензоил CeHs—С0С1 — жидкость с т.кип. 197 °С. Находит применение в качестве бензоилирующего агента.
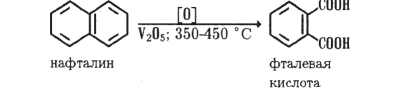
Фталевая кислота (о-ф талевая, или 1,2-6 е н - зенди карбоновая) — кристаллическое вещество с т.пл. 200 °С (с разл.). Получают окислением нафталина кислородом воздуха в присутствии V2O5:
Применяют в производстве красителей, фталевого ангидрида. Используют как пластификатор.
При нагревании о-фталевая кислота легко образует фталевъш ангидрид (т.пл. 131 °С). Он используется при производстве полимеров, красителей, пластификаторов, инсектицидов и лекарственных веществ.
Терефталевая кислота (1,4-6 ензендикарбо- новая, или n-ф талевая) — кристаллическое вещество с т.пл. 425 °С (в запаянном капилляре). Легко образует диметиловый эфир, который при взаимодействии с этиленгликолем дает полимерный продукт — полиэтилентерефталат, используемый при производстве полиэфирного волокна — лавсана:
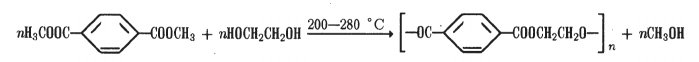
Производные терефталевой кислоты могут служить для получения термостойких полимеров. Например, при поликонденсации дихлорангидрида этой кислоты с л-фенилен- диамином получают полифенилентерефталамид (кевлар, аренка):
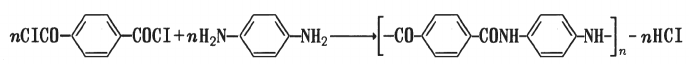
Температура плавления этого полимера 300-320°С. Термостойкие полимеры используются в производстве кордных тканей для шин, изготовления термостойкой элекгроизоля- ции, спецодежды и др. |
 Скачать 260.28 Kb.
Скачать 260.28 Kb.