ЗАВИСИМОСТЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ И ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОТ СТРОЕНИЯ МОЛЕКУЛЫ. Лекция 4 зависимость физикохимических свойств и
 Скачать 0.67 Mb. Скачать 0.67 Mb.
|
|
Лекция 4 ЗАВИСИМОСТЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ И ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОТ СТРОЕНИЯ МОЛЕКУЛЫ Направленный синтез основан на том, что уже проверенное лекарственное вещество немного совершенствуется и модернизируется специалистами, а после проверяется на животных. Нужно заметить, что совсем малые изменения в структуре препарата могут сильно поменять активность вещества. Так, например, если в молекуле морфина заменить всего один атом водорода на метильную группу, то получится совсем другое средство – кодеин – средство от кашля, чье болеутоляющее действие уже снижено в десять раз. Если в той же молекуле морфина заменить 3 атома водорода на метильную группу, получится – тебаин, который вызывает судороги. Целенаправленный синтез лекарственных веществ подразумевает создание веществ с заранее заданными фармакологическими свойствами. Синтез новых структур с предполагаемой активностью чаще всего проводится в том классе химических соединений, где уже найдены вещества, обладающие определенной направленностью действия. Классические закономерности влияния химической структуры молекулы на фармакологический эффект, используемые в настоящее время: Влияние непредельных связей. Ненасыщенные соединения значительно активнее насыщенных. Например, трихлорэтилен более сильное снотворное средство, чем хлорэтан. Разветвление углеродной цепи усиливает физиологическое действие препарата. Например, в группе барбитуратов (препаратов снотворного действия) барбамил более эффективен как снотворный препарат, чем барбитал. Длина цепи. В пределах до С5 обычно происходит нарастание физиологического эффекта, а далее, начиная с С6 и выше, физиологический эффект уменьшается и, наконец, пропадает. Это объясняется тем, что при увеличении количества углеродных атомов в цепи растворимость веществ понижается, вследствие чего они не поступают в кровь и не достигают соответствующих центров, а поэтому и не вызывают необходимого эффекта. Оптическая изометрия. Установлено, что левовращающие изомеры часто активнее правовращающих. Установлено также, что изомеры действуют различно на вкусовые нервные окончания и имеют различную силу действия. Например, правовращающие аспарагиновая и глютаминовая кислоты сладкого вкуса, а их левовращающие изомеры - безвкусны. Введение галогенов. Галогенопроизводные как жирного, так и ароматического ряда обладают более активным действием, чем соответствующие им углеводороды. Например, метан не является наркотическим веществом, хлористый метил СНзСl уже обладает легким наркотическим действием, хлористый этил СНзСН2Cl и хлороформ СНСlз обладают соответственно более выраженным наркотическим действием. Введение аминогруппы. Приводит к усилению жаропонижающих свойств, например анилин обладает ясно выраженным антипиритическим свойством. Одновременно аминогруппа придает соединению токсичность, поэтому анилин, как известно, не является лекарственным препаратом. Одновременное присутствие в ароматическом ядре аминогруппы и гидроксила придает молекуле анестезирующие свойства, которые еще более усиливаются этерификацией гидроксила. Введение нитрогруппы (-N02) в ароматическое ядро придает молекуле антибактериальное действие, а также действие на центр дыхания. Введение нитрозогруппы (-N=O) направляет вещество к нервному центру, ответственному за расширение кровеносных сосудов (амилнитрит, натрия нитрит). Химическое строение. Как правило, вещества сходной химической структуры обладают однотипными фармакологическими свойствами. В связи с этим лекарственные вещества часто классифицируют по их химическому строению. Например, различные производные барбитуровой кислоты (барбитураты) оказывают сходное угнетающее влияние на ЦНС и применяются в качестве снотворных, а наиболее активные из них - в качестве средств для наркоза. Однако в ряде случаев сходное действие оказывают вещества разного химического строения (например, атропин и платифиллин). Физические и физико-химические свойства. Действие лекарственных веществ может зависеть от их физических и физикохимических свойств, таких как растворимость и характер растворителя. Как правило, для того, чтобы лекарственное вещество оказало действие, оно должно растворяться в воде или жидкостях организма. Чем лучше растворяется вещество, тем скорее окажет действие. Большое значение имеет и характер растворителя. Например, фенол плохо растворяется в воде, но водные растворы фенола являются хорошими антисептиками и хорошо растворяются в масле, но масляные растворы фенола значительно более слабые антисептики. По силе антисептического действия 1%-ный водный раствор фенола равен примерно 10%-ному масляному раствору. Это объясняется тем, что сродство фенола к маслам значительно больше, чем к липидам микробной клетки. Лекарственная форма оказывает существенное влияние на действие лекарственных веществ. Растворы, как правило, всасываются быстрее, чем порошки, порошки быстрее, чем таблетки и пилюли. Растворы, приготовленные на разных растворителях, всасываются с разной скоростью. Быстрее всего всасываются спиртовые, затем водные и затем масляные растворы. Лекция 5 КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ СПИРТОВ И АЛЬДЕГИДОВ Спиртами алхимики называли все летучие вещества. Впервые этиловый спирт выделен из продуктов брожения в Италии в 11-12 вв. Абсолютированный этиловый спирт получил перегонкой водного раствора над поташом (карбонатом калия) Т. Е. Ловиц (1796). В 1855 М. Бертло синтезировал этиловый спирт из этилена (через этилсерную кислоту). Производство синтетического этилового спирта началось с 1930 в США. Спирт этиловый 95%, 96 % ФС.2.1.0036.15 (Spiritus aethylicus) Спирт этиловый 95% содержит от 94,9 % до 96,0% этанола С2Н6О); спирт этиловый 96% содержит от 95,1% до 96,9% этанола, в ГФ Х имеется ФС на спирты этиловые 90, 70 и 40%-ный. Описание. Прозрачная бесцветная подвижная жидкость с характерным спиртовым запахом. Растворимость. Смешивается с водой, хлороформом, ацетоном и глицерином во всех отношениях. Получение Брожение сахаристых веществ под влиянием дрожжевых ферментов. C6H12O6 → 2C2H5OH + 2CO2 Из крахмала. При гидролизе крахмала образуется глюкоза 2(С6H10O5)n + H2O → nC12H22O11 (мальтоза) → 2C6H12O6 C6H12O6 → 2C2H5OH + 2CO2 Для брожения используют: сок плодово-ягодных культур, зерно, картофель, мелассу- отход сахароварения. Брожение происходит в присут. дрожжей при 15-30 °С, длительность от 10-15 ч до 2-3 сут. Реакц. смесь после брожения (бражка) содержит 10-14% спирта, воду, а также нелетучие примеси: дрожжи, соли, несбраживаемые углеводы, красящие вещества, глицерин, а также летучие примеси: метиловый, пропиловый, изобутиловый, изоамиловый. Последние три спирта составляют основу сивушного масла. Метиловый спирт содержится в зерно-картофельной и свекловичной бражке. Далее полученную бражку подвергают ректификации (процесс основан на разных температурах кипения компонентов смеси). При этом получают 700, а затем 95-960, это спирт сырец (в котором содержатся летучие примеси метанол, сивушные масла, альдегиды и др.) Полученный спирт-сырец подвергают второй ректификации с целью очищения от примесей. В результате получается ректификационный спирт. Получить 100% этиловый спирт ректификацией невозможно, так как температуры кипения абсолютного спирта и спирта, содержащего 4% воды одинаковы. Для получения абсолютного этанола используют химические методы связывания воды: этилат алюминия, сульфат натрия, негашеная известь (CaO), но в медицине абсолютный спирт не используется. Для получения технического спирта используются синтетические методы получения: Из этилена прямой гидратацией Из ацетилена по реакции Кучерова. 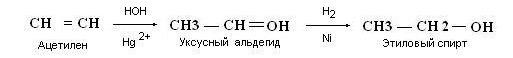 Медицинский спирт получают только методом брожения сахаристых веществ. Подлинность: ГФ: Образование этилацетата. Субстанцию смешивают с ледяной уксусной кислотой и концентрированной серной кислотой, при нагревании ощущается запах этилацетата.  Йодоформенная проба. При взаимодействии спирта этилового с йодом в щелочной среде при нагревании образуется осадок желтого цвета с характерным запахом. Не ГФ: Окисление до альдегидов При окислении спирта дихроматом калия в присутствии серной кислоты при нагревании ощущается запах уксусного альдегида. 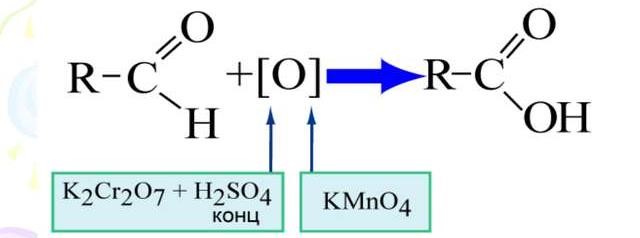 Чистота: ГФ требует испытание на кислотность и устанавливает допустимый ее предел. С помощью ГХ устаналивают наличие примесей: метанола, этилацетата, метилацетата, уксусного альдегида, сивушных масел. Также проверяют фурфурол, восстанавливающие вещества, нелетучие вещества, сульфаны, хлориды, тяжелые металлы. Количественное определение Спирт этиловый 95% имеет плотность от 0,808 до 0,812 г/см3, спирт этиловый 96%: от 0,804 до 0,811 г/см3. Измеряют с помощью ареометра или пикнометра. Также концентрацию этилового спирта вычисляют по показателю преломления (рефрактометрия) В настойках – по температуре кипения. Хранение: В плотно укупоренной упаковке, вдали от огня. Применение: Для приготовления настоек, экстрактов, как консервант. в виде компрессов как раздражающее средство, антисептическое средство, противошоковое средство (5-20% при в/в) Можно в качестве седативного и снотворного средства, хотя прием нерационален из-за угнетения центра дыхания. Энергетическое действие (при терапии истощенных больных) При окислении 1 г спирта высвобождается 7,2 ккал Как пеногаситель при бронхообструкции При отравлении этиленгликолем и метанолом. ФС.2.1.0043.15 Формальдегида раствор Formaldehydi solution CH2O М. м. 30,03 Получение Формальдегид получают окислением метилового спирта кислородом воздуха. После охлаждения формальдегид (бесцветный газ с острым запахом) растворяют в воде до получения 34,5-38%- водного раствора, который называют формалином. 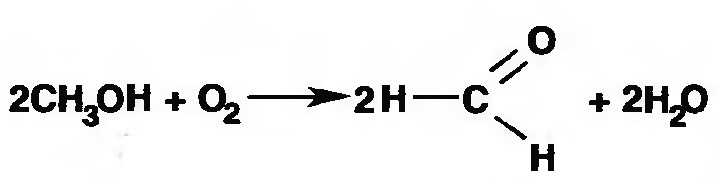 Описание раствора формальдегида Прозрачная бесцветная жидкость с резким характерным запахом. Смешивается с водой и спиртом 96 %. Стабилизация и хранение. Раствор формальдегида следует хранить в защищенном от света месте, при температуре не ниже +15 °С. При более низкой температуре происходит полимеризация с образованием параформа (параформальдегида) [СН2О]n — твердого белого вещества. Для предохранения от полимеризации к раствору добавляют до 1% метилового спирта. Его роль - предупреждение окислительновосстановительного процесса превращения формальдегида в муравьиную кислоту. При выпадении осадка параформа бутыль оставляют на сутки при комнатной температуре, далее осадок отфильтровывают и определяют фактическое содержание формальдегида. Лекарственные формы готовят исходя из фактического содержания. Подлинность По ФС Реакция «серебряного зеркала». К субстанции добавляют аммиачный раствор серебра нитрата; выделяется металлическое серебро в виде зеркала или серого осадка 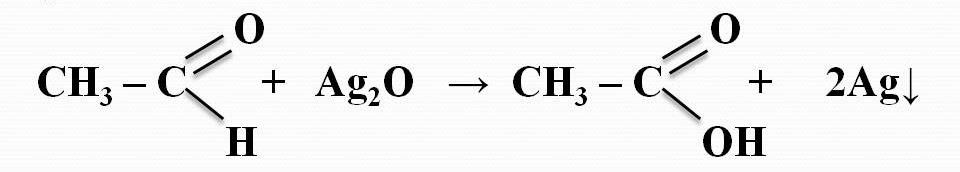 Реакция конденсации с салициловой кислотой (специфическая реакция) Салициловую кислоту растворяют в конц. серной кислоте. К полученному раствору прибавляют субстанцию и осторожно нагревают, появляется неисчезающее ярко-красное окрашивание (ауриновый краситель). 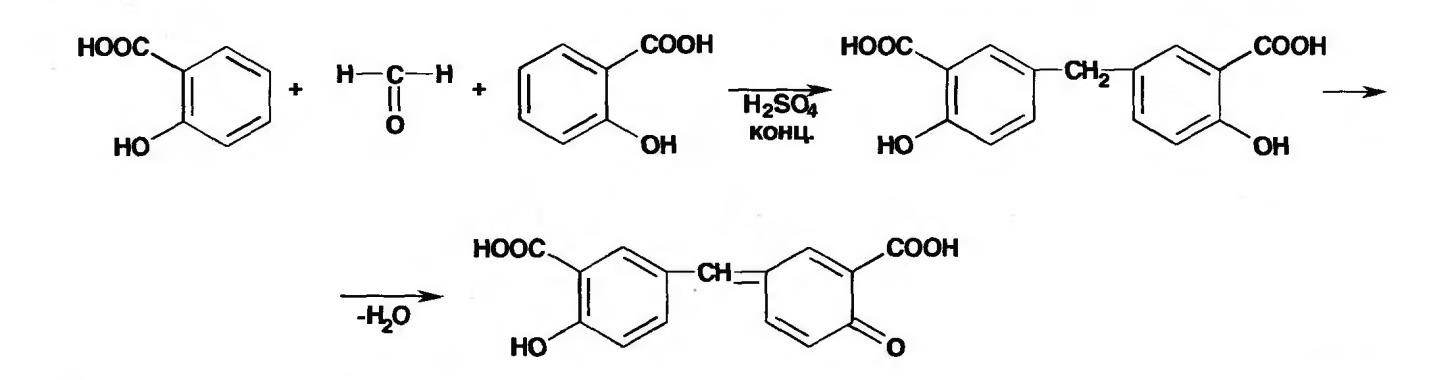 Не ФС: реакция с реактивом Фелинга, Нессера Чистота ГФ устанавливает допустимый предел кислотности. В результате получения, а затем и хранения формальдегида незначительно образуется муравьиная кислота, которая способствует образованию нерастворимого параформа. Количество муравьиной кислоты не должно превышать 0,2%. Определяют ее, титруя гидроксидом натрия (индикатор фенолфталеин). Количественное определение. 1. Йодометрия. Количественное определение формальдегида в растворе и хлоралгидрата можно провести, используя реакцию окисления альдегидов йодом в щелочной среде. Йод при этом образует гипойодит (сильный окислитель): Гипойодит окисляет альдегиды до кислот:  Затем добавляют избыток серной кислоты, непрореагировавший гипойодит превращается в йод, который оттитровывают тиосульфатом натрия 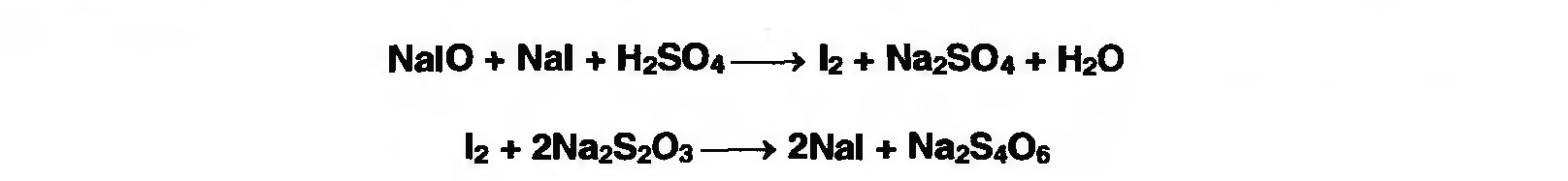 Применение Является протоплазматическим ядом, не может назначаться внутрь Применяется 0,5% раствор как дезинфицирующее средство для мытья рук, обработки хирургических инструментов, протирания ног при потливости. Для консервации анатомических и биологических препаратов. Гексаметилентетрамин (уротропин, метенамин) Hexamethylentetraminum 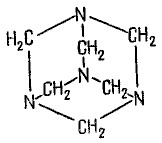 М.м. 140,19 г/моль Гексаметилентетрамин синтезирован А.М. Бутлеровым из параформальдегида и аммиака в 1860 г., но медицинское применение нашел только в 1895 г. Он представляет собой продукт конденсации формальдегида и аммиака. 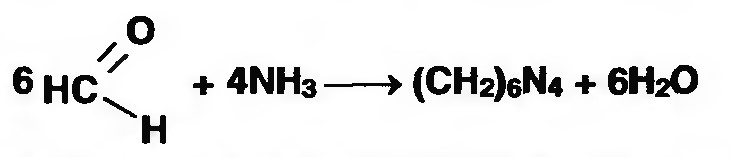 По химическому строению гексаметилентетрамин может быть отнесен к гетероциклическим соединениям, производным триазина. Способы его испытаний и фармакологическое действие основаны на реакциях гидролиза, сопровождающихся образованием формальдегида. Описание: Бесцветные кристаллы или белый кристаллический порошок, без запаха, жгучего и сладкого, а затем горьковатого вкуса. При нагревании улетучивается, не плавясь, так как гидролизуется с образованием аммиака и формальдегида. Хорошо растворим в воде и спирте, хлороформе. Нерастворим в эфире. Водные растворы имеют слабощелочную реакцию. Подлинность ФС Гидролиз гексаметилентетрамина (добавление кислоты служит для усиления гидролиза) (CH2)6N4 + 2H2SO4 + 6HOH→ 6 формальдегид + 2(NH4)2SO4 Затем к реакционной смеси добавляют NaOH ощущается запах аммиака 2(NH4)2SO4 + 4NaOH → 4NH3 + 2Na2SO4 + 4H2O Не ФС на третичный атом азота – общеалкалоидные реактивы на формальдегид, после кислотного гидролиза (реакция с салициловой кислотой) Примеси В гексаметилентетрамине недопустимы примеси солей аммония и параформа, что возможно при нарушении условий хранения препарата. Обе примеси открывают реактивом Несслера (после добавления реактива не должно появляться ни желтого окрашивания, ни осадка). Для этого к раствору препарата добавляют реактив и нагревают на водяной бане. В присутствии солей аммония возникнет желтое окрашивание. Параформ при нагревании дает формальдегид, который с реактивом Несслера образует металлическую ртуть. Количественное определение Метод нейтрализации (Фармакопейный анализ) (CH2)6N4 + 2H2SO4 + 6HOH→ 6формальдегид + 2(NH4)2SO4 Навеску препарат нагревают с точно известным объемом серной кислоты. После охлаждения избыток серной кислоты оттитровывается NaOH индикатор метиловый красный. При экспресс-анализе используют ацидиметрию. Метенамин ввиду наличия в его молекуле четырех атомов азота имеет в водных растворах щелочную реакцию. Поэтому количественное определение можно также выполнить методом кислотно-основного титрования, без реакции гидролиза. Образуются малоустойчивые соли: Индикатор смешанный: метиловый оранжевый + метиловый синий (1:1) (зеленая→ фиолетовая) Т = 0,0140 г/мл Хранение В хорошо укупоренной таре. Особенности технологии 40% раствор гексаметилентетрамина для инъекций Растворы уротропина при обычной температуре сравнительно устойчивы и обладают бактерицидным действием. При повышении же температуры происходит гидролиз гексаметилентетрамина с образованием формальдегида и аммиака, поэтому приготовление его 40% раствора проводят в асептических условиях (1 класс чистоты), без тепловой стерилизации. Лекарственное вещество должно быть сорта «для инъекций». На предприятиях используют стерилизующию фильтрацию с использованием мембранных фильтров. Применение Препарат можно рассматривать как пролекарство. Как дезинфицирующее средство внутрь и внутривенно. Его действие основано на образовании формальдегида в кислой среде, который и оказывает дезинфицирующее действие. Применяется при заболеваниях мочевых путей. Лекция 6 КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ УГЛЕВОДОВ И ПРОСТЫХ ЭФИРОВ Глюкоза моногидрат (Декстроза) Glucosum ФС 42-2419-86 В природе глюкоза широко встречается во фруктах и ягодах. Является необходимой составной частью крови человека. Норма в крови 5,5 ммоль. 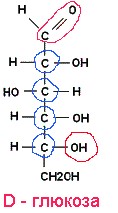 C6H12O6 * H2O М.м. 198,17 Описание. Белый кристаллический порошок, без запаха, сладкого вкуса. Медленно растворима в 1,5ч воды, мало растворима в 95% спирте. Подлинность По ФС. К раствору 0,2 г препарата в 5мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично – красный осадок.  Не ФС. Реакция серебряного зеркала К раствору глюкозы добавляют аммиачный раствор нитрата серебра, при нагревании на стенках пробирки выделяется металлическое серебро 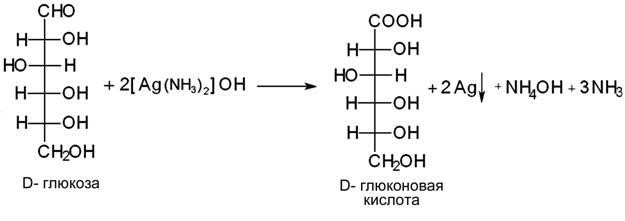 Реакция на многоатомные спирты К раствору глюкозы приливают несколько капель раствора сульфата меди и гидроксида натрия. Образуется комплекс меди – василькового цвета. 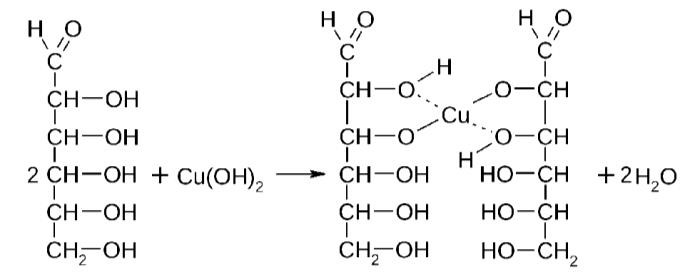 Специфическая реакция (позволяет открывать глюкозу в присутствии других восстановителей) с тимолом после добавления концентрированной серной кислоты появляется темно-красное окрашивание Определение удельного вращения. Глюкоза является оптически активным веществам, из-за наличия в молекуле четырех асимметрических атомов углерода. В водном растворе в динамическом равновесии находятся линейная форма глюкозы и циклические. Переход от ациклической формы к циклической 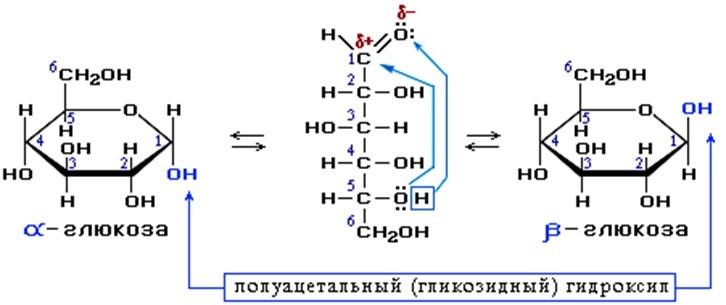 Для α-D-глюкозы величина угла вращения составляет +109,6 0, а для βD-глюкозы +20,5о. Согласно ФС удельное вращение 10% раствора глюкозы от +52,0 до +53,0°. Если определять угол вращения глюкозы сразу после ее растворения, то этот показатель составит +109,16 0С и конечного значения +52,30 достигнет только через несколько часов. Изменение во времени величины угла вращения называется мутаротацией. Для ускорения процесса муторатации к раствору добавляют несколько капель аммиака. Количественное определение Для субстанции глюкозы не предусмотрено. В растворах для инъекций глюкозу определяют рефрактометрически. Особенности изготовления растворов глюкозы: В ГФ имеются 2 примечания, в которых сказано, что при изготовлении любых растворов глюкозы следует учитывать, что она содержит 10% кристаллизационной воды, поэтому необходимо сделать пересчет на безводную глюкозу. При изготовлении растворов глюкозы для инъекций добавляют стабилизатор состоящий из хлороводородной кислоты и натрия хлорида. Добавление NaCl создает в растворе условия, способствующие сдвигу в сторону образования более устойчивой к окислению циклической формы. Кислота хлористоводородная обеспечивает РН 3,0 – 4,0, в данном диапазоне замедляются процессы окисления глюкозы. Применение Изотонические растворы (5%) глюкозы применяют для пополнения организма жидкостью и как источник питательного материала, при катаболизме которого выделяется энергия. Гипертонические растворы повышают осмотическое давление крови, поэтому жидкость начинает поступать в кровь в результате расширяются сосуды, улучшается детоксикационная функция печени, работа сердца, увеличивается диурез. Широко применяют при гипогликемии, инфекционных заболеваниях, болезнях печени, при шоке и коллапсе. Димедрол (ФС 42-0232-07) (МНН - Дифенгидрамин) (Dimedrolum) 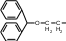 CH3 N HCl CH3 М.м. 291,82 N,N – диметил – 2 – (дифенилметокси)-этиламина гидрохлорид Описание. Белый или почти белый кристаллический порошок. Растворимость: очень легко растворим в воде; легко в спирте и хлороформе, очень мало растворим в эфире. Подлинность. Образование оксониевых солей. На часовое стекло наносят серную кислоту концентрированную и прибавляют субстанцию; появляется яркожелтое окрашивание, постепенно переходящее в кирпично-красное. При прибавлении нескольких капель воды окраска исчезает (соли гидролизуются при добавлении воды). 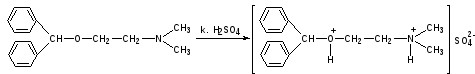 На хлорид-ион с нитратом серебра. Сl-+Ag+ → AgCl↓ Количественное определение: По ФС – Метод неводного титрования Титрование проводят в среде ледяной уксусной кислоты, для связывания HCl добавляют ртути (II) ацетат. В качестве титранта используют хлорную кислоту. Индикатор кристаллический фиолетовый, титруют до желто-зеленой окраски раствора. 2HCl+ Hg(CH3COO)2 → HgCl2 + 2CH3COOH 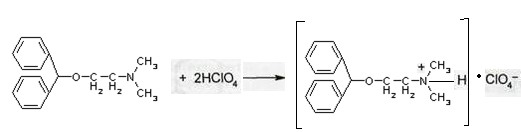 Экспресс-анализ. Прямая алкалиметрия в водной среде по связанной HCl с добавлением хлороформа - органического растворителя. Титрантом является ги дроксид натрия. Индикатор фенолфталеин. Добавление органического растворителя необходимо для растворения образующегося основания димедрола. Если растворитель не добавить, то выделяющееся основание в водном растворе будет образовывать суспензию белого цвета. Уравнение: [димедрол]*HCl+NaOH → [димедрол основание]↓+ NaCl + HOH Аргентометрия – метод Фаянса. Индикатор бромтимоловый синий. Хранение. В защищенном от света месте. Применение. Применяют при аллергических заболеваниях, особенно при поражении кожи и слизистых оболочек. Лекция 7 КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ КАЛЬЦИЯ ГЛЮКОНАТ ФС.2.1.0019.15 Calcii gluconas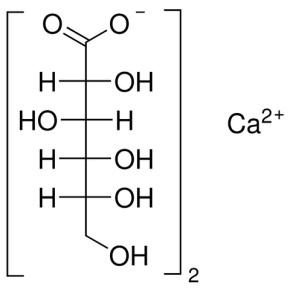 Описание. Белый или почти белый зернистый или кристаллический порошок без запаха. Легко растворим в кипящей воде, умеренно (медленно) растворим в воде, практически нерастворим в спирте 96 %. Подлинность1. Определение иона кальция Соли кальция окрашивают пламя в красный цвет С оксалатом аммония – образуется осадок белого цвета CaСl2 + (NH4) 2C2O4 →СаС2O4↓ + 2NH4Cl2. Определение глюконат-иона. В нейтральных растворах при действии хлоридом железа (III) появляется светло-зеленое окрашивание 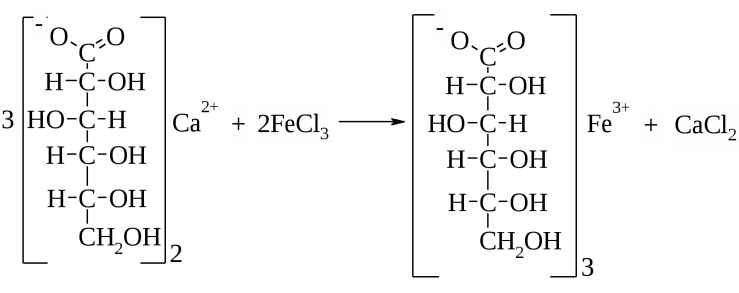 Количественное определениеКомплексонометрия. Титрант – 0.05М раствор трилона Б, индикатор – кислотный хром темно-синий. Условие: аммиачный буфер. Хранение В хорошо укупоренной упаковке, в защищенном от света месте. Особенности изготовления лекарственных формКальция глюконат медленно растворим в 50 частях воды и растворим в 5 частях кипящей воды, таким образом, 10% раствор пересыщен. Растворение проводят при нагревании в течение 3 ч. Далее раствор охлаждают, фильтруют, разливают в ампулы и стерилизуют в автоклаве при температуре 110°С в течение 1 часа. При оценке качества инъекционных растворо учитывают, что при длительном кипячении раствор глюконата кальция часто карамелизуется (желтеет), а примеси оксалата кальция, во время растворения образуют комплексы с глюконатом кальция, которые при хранении раствора в ампулах, выпадают в осадок. Применение: Как кровоостанавливающее, при аллергических заболеваниях, при недостаточности паращитовидных желез, сопровождающейся тетанией, препарат обладает токомиметическим действием (т.е. повышает тонус и сократительную способность мышц матки). Аскорбиновая кислота (витамин с) Acidum ascorbinicum γ-лактон 2,3-дегидро-L-гулоновой кислотыHO OH 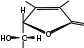 O OCH2OH М.м. 176,13 Аскорбиновая кислота, возможно, имеет генетическое родство с моносахаридами, что проявляется в сходстве структурных фрагментов молекул. Поэтому витамин С содержится в органах многих культурных и диких растений. 1. ПолучениеПолучают аскорбиновую кислоту из сорбозы (диастереоизомер фруктозы). Путем окисления и некоторых других превращений. Второе название витамина С- аскорбиновая кислота – не совсем правильно, так как он по строению он представляет собой не кислоту, а лактон.  Описание: Белый кристаллический порошок кислого вкуса. Она легко растворима в спирте, воде, нерастворима в эфире, бензоле, хлороформе. Удельное вращение. От +20,5 до +21,5 º (10 % раствор). ПодлинностьКислотные свойства Аскорбиновая кислота не содержит свободной карбоксильной группы, но 5% раствор имеет рН от 2,1 до 2,6. Кислотный характер аскорбиновой кислоты обусловлен атомом водорода гидроксильной группы в положении 3. Второй гидроксил – кислотными свойствами не обладает. Енольный гидроксил взаимодействует с щелочами и гидрокарбонатом натрия. 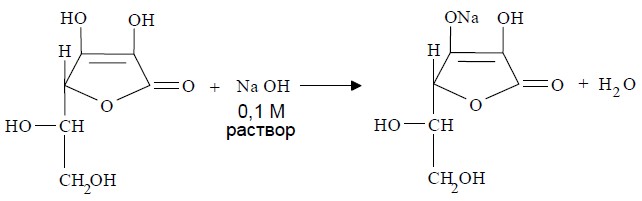 В качестве реактива также можно использовать FeSO4, в результате образуется фиолетовый аскорбинат железа. FeCl3 использовать нельзя, так как он является окислителем. Восстановительные свойства: Характерной частью молекулы аскорбиновой кислоты обуславливающей ее химические свойства является ендиольная группировка. Благодаря подвижности водородных атомов енольных гидроксильных групп аскорбиновая кислота легко окисляется, аскорбиновая кислота восстанавливает серебро из нитрата серебра уже при комнатной температуре в отличие от альдегидов. 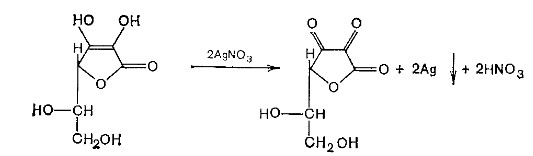 стадия - Аскорбиновая кислота окисляется до дикетоаскорбиновой кислоты (кетонная форма) способной снова восстанавливаться до аскорбиновой кислоты. стадия – Разложение дикетоаскорбиновой кислоты до фурфурола, процесс необратимый. Количественное определениеЙодатометриметрический метод (прямое титрование). Субстанцию растворяют в воде, прибавляют раствор калия йодида и хлороводородной кислоты и титруют раствором калия йодата до появления стойкого слабо-синего окрашивания (индикатор - крахмал). 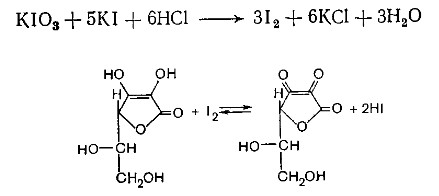 При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом — КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты. Йодометрия (обратное титрование). 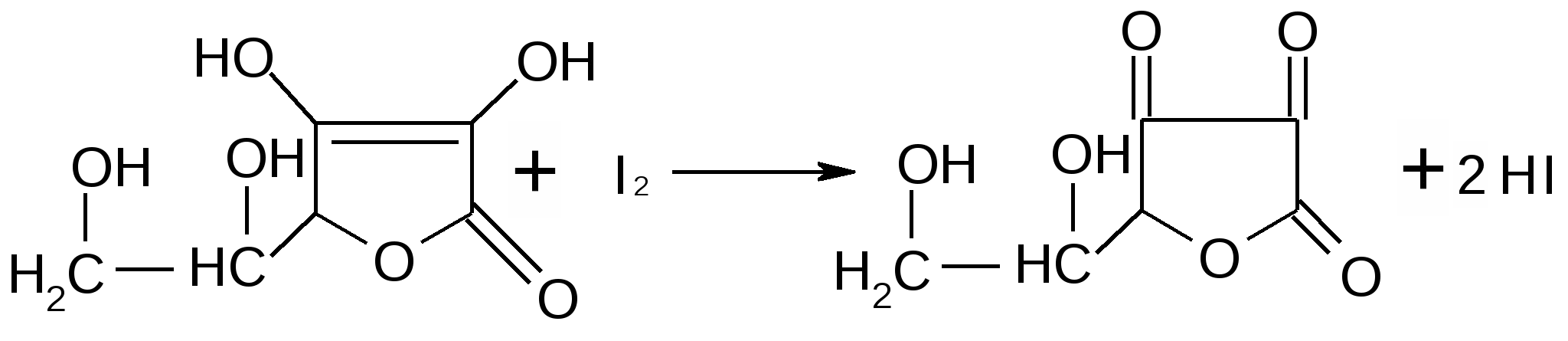 Алкалиметрия. Титруют гидроксидом натрия как одноосновную кислоту по енольному гидроксилу в 3-м положении. Стабилизация лекарственных формКислота аскорбиновая используется в виде растворов для инъекций. Поскольку в растворах она легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (Na2SO3, Na2S2O5). В раствор для инъекций добавляют натрия гидрокарбонат, так как препарат имеет кислую реакцию среды, раздражающую ткани. ХранениеВ сухом защищенном от света месте, в хорошо укупоренной неметаллической таре. ПрименениеВ отличие от животных у человека не синтезируется. Наибольшее ее количество обнаруживается в надпочечниках, значительное количество содержится в лейкоцитах. Аскорбиновая кислота необходима для синтеза стероидных гормонов, норадреналина, адреналина. Витамин С обладает адаптогенным действием, повышает умственную и физическую работоспособность. Усиливает желудочную секрецию, всасывание железа, синтез гликогена, альбумина, протромбина, обезвреживание токсических веществ. При недостатке развивается цинга. Лекция 8 КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ АМИНОКИСЛОТАминокислоты, класс органических соединений, объединяющих в себе свойства кислот и аминов, т. е. содержащих наряду с карбоксильной группой —COOH аминогруппу —NH2. В зависимости от положения аминогруппы относительно карбоксильной группы различают α-, β-, γ-, δ-, ε- и др. аминокислоты. Физические свойства Аминокислоты — бесцветные кристаллические вещества, растворимые в воде; в водном растворе молекулы имеют структуру главным образом амфотерных (двузарядных) ионов. Например, строение простейшей аминокислоты — глицина — можно выразить формулой Оптическая изомерия: Оптическое вращение – способность вещества вращать плоскость поляризации при прохождении через него поляризованного луча. В зависимости от природы оптически активного вещества, вращение плоскости поляризации может иметь разные направления и величины. Если вращение по часовой стрелке (+), то вещество правовращающее. Значение удельного вращения используют для определения подлинности, чистоты, количественного определения. Глютаминовая кислота (ФС 42-0229-07)Acidum glutaminicum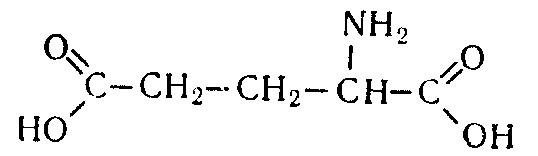 альфа-аминоглутаровая кислотаОписание. Белый кристаллический порошок или бесцветные кристаллы. Легко растворим в кипящей воде, мало растворим в воде. Удельное вращение. От + 30,5 до + 32,5º в пересчете на сухое вещество (10% раствор субстанции в 1 М растворе хлористоводородной кислоты). Получение. В больших количествах содержится в белках мозга, злаковых культурах. Из них она и получается. Ранее путем кислотного гидролиза, сейчас синтетически из глутаровой кислоты. Подлинность На аминогруппу (-NH2) Нингидриновая проба. Субстанцию растворяют в воде, добавляют раствор нингидрина и нагревают; появляется сине-фиолетовое окрашивание. Схема реакции: 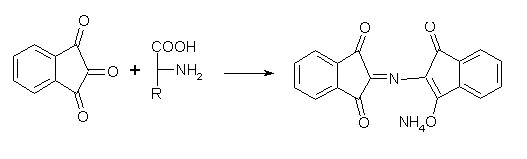 Количественное определение: Метод нейтрализации по карбоксильной группе. Аминогруппа мешает нейтрализации расположенной рядом карбоксильной группы, так как связывает водород. Нейтрализация идет по удаленной от аминогруппы карбоксильной группе. Титрант - 0,1 М раствор натрия гидроксида до перехода желтой окраски в голубовато-зеленую (индикатор бромтимоловый синий). HOOC-CH2-CH2-CH(NH2)-COOH + NaOH → NaOOC-CH2-CH2-CH(NH3+)COO- + H2O Поэтому f=1! Формольное титрование. Чтобы аминогруппа не мешала титрованию и по второй карбоксильной группе, ее связывают добавлением формальдегида. При этом протекает реакция: 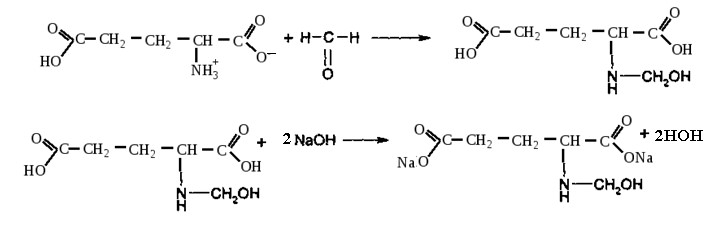 Теперь фактор эквивалентности становится равен ½! Метод Кьельдаля. Точную навеску АК, смешивают с порошком K2SO4, CuSO4 (10:1). К полученой смеси прибавляют H2SO4. Проводят реакцию в колбе Кьельдаля, соединенной с холодильником и специальным приемником. При нагреве идет минерализация: C→CO2; N→NH3→(NH4)2SO4Нагревают до полного просветления раствора, затем колбу охлаждают, прибавляют NaOH. Идет процесс нейтрализации избытка H2SO4, разрушение аммониевой соли. H2SO4 + NaOH → Na2SO4 + H2O(NH4)2SO4 + NaOH → Na2SO4 + NH3 + H2O Аммиак в специальном приемнике реагирует с борной кислотой: 2NH3 + 4H3BO3 → (NH4)2B4O7 + 5H2OТитруют HCl в присутствии м/о + м/с. Разрушается тетраборат с образованием H3BO4 + NH4Cl. Применение: Таблетки при заболеваниях центральной нервной системы, при различных психических расстройствах. Хранение: В хорошо упакованной таре, недоступно для света. Аминокапроновая кислота ФС.2.1.0001.15 Acidum aminocaproicum  Получение: В настоящее время синтетическим путем из циклогексанона Описание. Белый или почти белый кристаллический порошок или бесцветные кристаллы без запаха. Легко растворим в воде. Подлинность по ФС С нингидрином – сине-фиолетовое окрашивание Субстанцию растворяют в воде, прибавляют фенолфталеин и натрия гидроксид; должно появиться красное окрашивание. После прибавления 0,1 мл формалина, нейтрализованного по фенолфталеину (слабо-розовое окрашивание), окраска Количественное определение Формольное титрование Метод Кьельдаля Неводное титрование. Растворитель – ледяная уксусная кислота. Титрант 0,1 М раствор хлорной кислоты до перехода фиолетовой окраски в сине-зеленую (индикатор - кристаллический фиолетовый). Хранение. В плотно укупоренной упаковке. Применение:Как кровоостанавливающее средство. |
