Хим связи. СРОП Виды Х С. Лекция 7 Тема по мудулу Химическая связь План Введение Понятие химической связи Ковалентная связь Ионная связь
 Скачать 52.37 Kb. Скачать 52.37 Kb.
|
|
Лекция № 7 Тема по мудулу Химическая связь План Введение Понятие химической связи Ковалентная связь Ионная связь Другие виды связей Заключение Основные понятия и законы: химическая связь; энергия и длиня химической связи; метод валентных связей, типы химической связи: ковалентная, ионная, металлическая; донорно-акцепторный механизм образования ковалентной связи; перекрывание орбиталей; направленность, насыщаемость и полярность ковалентной связи; гибридизация; валентный угол; ординарная, двойная и тройная связь; σ- и π-связи; ковалентность и валентность; дипольный момент; степень ионности. Перечень умений: определять тип химических связей, анализировать механизм их образования; изображать перекрывание атомных орбиталей, электронные схемы молекул и их геометрическую форму; оценивать полярность связей и молекул; устанавливать взаимосвязь между типом химической связи и свойствами веществ [1]. Химическая связь – совокупность взаимодействий, приводящих к связыванию атомов в устойчивые сложные частицы (молекулы, ионы, радикалы) и агрегаты (кристаллы, стекла и др.). Эти взаимодействия имеют электрическую природу и возникают при перераспределении валентных электронов между атомами. Основным условием образования химической связи является уменьшение энергии сложной частицы по сравнению с энергией изолированных (не взаимодействующих) атомов. 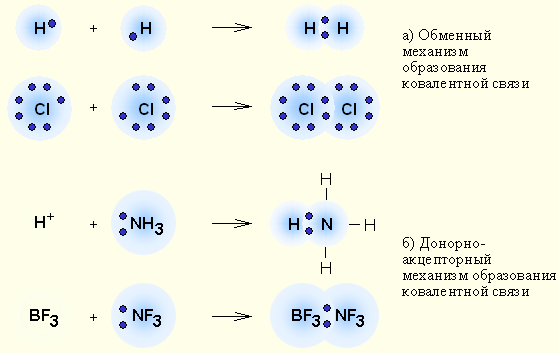 Рисунок 1 Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи Энергия, выделяющаяся при образовании связи, называется энергией химической связи. В расчете на одну химическую связь ее энергию обычно выражают электронвольтах эВ (1эВ = 1,602·10-19Дж), а в расчете на моль связей – в кДж/моль (1эВ соответствует 96,5 кДж/моль). Чем больше энергия химической связи, тем связь прочнее. Другой важной характеристикой химической связи является ее длина (l) – расстояние между центрами (ядрами) химически связанных атомов в их устойчивых положениях. Длину связи измеряют в нанометрах (1нм = 10-9 м). Удобной единицей является также ангстрем Ǻ (1Ǻ = 10-10 м = 0,1 нм). Наибольшее распространение получили два квантовомеханических подхода к описанию химической связи: метод молекулярных орбиталей (МО) и метод валентных связей (ВС). Метод МО рассматривает состояния электронов в молекуле – молекулярные орбитали как многоцентровые, охватывающие ядра всех атомов, входящих в молекулу. Метод ВС представляет молекулу как систему двухцентровых молекулярных орбиталей, каждая из которых отвечает одной связи (одной черточке в структурной химической формуле) между двумя соседними атомами в молекуле. В зависимости от характера распределения валентных электронов различают три основных типа химической связи[2]. Если валентные электроны преимущественно локализованы (находятся) между атомами, связь называют ковалентной. Если же валентные электроны локализованы преимущественно на более электроотрицательных атомах, связь называют ионной. Наконец, если валентные электроны полностью делокализованы и свободно перемещаются по всему объему кристалла, связь называют металлической. Ковалентная связь В большинстве случаев реализуются два механизма образования ковалентной связи: 1) спаривание электронов двух атомов при условии противоположной ориентации их спинов; 2) донорно-акцепторное взаимодействие, при котором общей становится электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора). Другими словами, ковалентная связь образуется при перекрывании либо атомных орбиталей (АО) с неспаренными электронами, спины которых противоположны, либо свободной АО с АО, содержащей пару электронов. Рассмотрим образование молекулы Н2 из атомов. Атомы водорода имеют электронную конфигурацию 1s 1 , т.е. на s-орбиталях находятся неспаренные электроны. Перекрывание валентных АО, ведущее к образованию МО в молекуле Н2, можно изобразить графически следующим образом: На схемах заштрихована область перекрывания АО. Чем больше эта область, тем прочнее химическая связь. При дальнейшем сближении атомов с некоторого момента начинают преобладать силы отталкивания положительно заряженных ядер и энергия системы повышается. Оптимальная область перекрывания соответствует минимальной энергии и определенной длине связи [3]. Вследствие спаривания валентных электронов между атомами водорода образовалась одна ковалентная связь, которую в структурных химических формулах изображают с помощью черточки между химически связанными атомами: Н-Н. Образование молекулы из атомов можно также представить в виде электронных схем, обозначив электроны внешних энергетических уровней атомов точками. Тогда одна ковалентная связь обозначается не черточками, а парой точек: Н:Н. Другой механизм образования ковалентной связи можно показать на примере образования той же молекулы Н2 из ионов Н + и Н - . Ион Н + электронов не имеет и его АО 1s свободна: 1s . Ион Н - содержит два электрона, которые занимают 1s-орбиталь: 1s 2 или 1s . Между этими ионами возможно образование ковалентной связи по донорноакцепторному механизму: Образовалась молекула с ковалентной связью, которая ничем не отличается от связи, возникающей при образовании молекулы водорода из атомов, кроме происхождения обобществленной электронной пары. По способу перекрывания АО и симметрии образующихся МО различают: σ-связь, когда область перекрывания лежит на линии, соединяющей ядра атомов; π-связь, если область перекрывания лежит в плоскости, проходящей через линию, соединяющую ядра атомов, по обе стороны от нее. Такая связь образуется только тогда, когда уже невозможно образование σ-связи. Дело в том, что в случае π-связи перекрывание АО менее эффективно, т.е. энергетически она менее выгодна, чем σ-связь. δ-связь образуется при перекрывании всех четырех лопастей d-электронных орбиталей, расположенных в параллельных плоскостях. Количество ковалентных связей, образованных данным атомом, называется его ковалентностью. Не следует путать ковалентность и степень окисления. Это не одно и то же. Например, в молекуле S2 ковалентность серы равна двум, а ее степень окисления равна нулю. Ковалентность определяется числом АО, которые принимают участие в образовании связей. При этом следует учитывать как АО с неспаренными электронами, Н Н Н - Н + + → Н Н или Н:Н или Н – Н E r Eсв l Рис. 1. Энергия системы из атомов водорода: r – расстояние между центрами атомов; Е – энергия системы; l – длина химиической связи; Eсв – энергия химической связи так и АО с неподеленными электронными парами, а также свободные АО валентной оболочки. Например, атом углерода в основном состоянии имеет два неспаренных электрона (2s 2р ). Однако он легко переходит в возбужденное состояние, сопровождающееся распариванием электронной пары, и приобретает электронную конфигурацию 2s 2р с четырьмя неспаренными электронами. Таким образом, максимальная ковалентность углерода равна четырем и определяется она числом АО с неспаренными электронами. Атом бора в возбужденном состоянии (В*: 2s 2р ) содержит три неспаренных электрона, одна АО остается свободной и может участвовать в образовании связи по донорно-акцепторному механизму. Следовательно, максимальная ковалентность бора также равна четырем. А у атома азота (N: 2s 2р ) кроме трех неспаренных электронов имеется неподеленная пара (атом N – донор электронов) и его максимальная ковалентность равна четырем. В образовании связей участвуют АО только наружной валентной оболочки. Так у атомов углерода, бора и азота связи образуются с участием только четырех АО второго энергетического уровня, что ограничивает возможные величины ковалентности этих атомов (не более четырех). Это свойство ковалентной химической связи называется насыщаемостью. Насыщаемость и направленность ковалентной связи обуславливают состав молекулы и ее существование в виде дискретной частицы с определенной структурой и геометрией. Во многих случаях атомы образуют связи за счет валентных электронов разных подуровней, например, s- и р-электронов. Несмотря на различие форм и энергий исходных АО, образовавшиеся связи могут оказаться равноценными и симметричными. Эти факты объясняются представлениями о гибридизации валентных орбиталей, согласно которым в таких случаях исходные АО как бы «смешиваются» и образуются новые орбитали иной формы. Последние называют гибридными АО, а сам процесс их образования – гибридизацией. Число гибридных АО равно числу исходных, а их форма и энергия одинаковы и отличаются от исходных. Гибридные орбитали располагаются в пространстве максимально симметрично. Гибридизация требует затрат энергии, которые затем компенсируются за счет большей энергии химических связей, образованных гибридными АО, Важным свойством химической связи является ее полярность. Если химическая связь образована между атомами с одинаковой электроотрицательностью (ЭО), то электронная пара располагается симметрично относительно обоих атомов. Такая связь называется неполярной (например, Н – Н). Если же ЭО атомов различные, то электроны смещаются к атому с большей ЭО. Такое смещение электронов называется поляризацией химической связи, а сама связь называется полярной (например, Н–Cl). Степень полярности определяется разностью ЭО. Чем больше 8ЭО атомов, тем выше полярность химической связи. Поляризация химической связи приводит к появлению на атомах избыточных зарядов, равных по величине и противоположных по знаку (Н +δ :Cl-δ ). Центры тяжести этих зарядов находятся на расстоянии, равном длине химической связи (l). Таким образом, возникает дипольный момент, являющийся количественной характеристикой полярности химической связи, величина которого рассчитывается по формуле: µ = δ⋅ → l Здесь стрелочка указывает на векторный характер дипольного момента. Его направление по договоренности совпадает с направлением смещения электронов ( H : Cl → ). Порядок величины → µ можно найти, если принять l = 1Ǻ = 10-10 м, а δ принять по порядку величины равной заряду электрона (10-19 Кл), т.е. 10 10 10 Кл м 10 19 29 µ = ⋅ = ⋅ − − − → . Единицей измерения дипольного момента является дебай (Д): 1Д = 3,33·10-30 Кл·м. Дипольный момент молекулы представляет собой векторную сумму дипольных моментов всех химических связей. Результат сложения зависит от геометрии молекул. ИОННАЯ СВЯЗЬ Ионную связь можно рассматривать как предельный случай полной поляризации ковалентной связи [4]. Если разность электроотрицательностей по Полингу 8ЭО атомов, образующих связь, больше 2, то можно считать, что электроны практически полностью перешли к атому с большей ЭО ( Na : Cl → ) и атомы превратились в ионы (Nа +Cl- ). Химическая связь в этом случае осуществляется за счет сил электростатического взаимодействия между противоположно заряженными ионами. Эта связь, в отличие от ковалентной, не характеризуется направленностью и насыщаемостью (в том смысле, какой мы вкладывали в эти термины при рассмотрении ковалентной связи). Количество ионов противоположного заряда, которое может расположиться вокруг данного иона, определяется, главным образом, размерами взаимодействующих ионов [5]. Для кристаллических ионных соединений понятие отдельных молекул, например, молекулы NаCl, теряет смысл, и весь кристалл можно рассматривать как гигантскую молекулу, состоящую из огромного числа ионов: NаnCln. Используемая запись NаCl указывает только на соотношение ионов Nа + и Clв кристаллической решетке. Конечно, электроны полностью не переходят от одного атома к другому даже в случае больших 8ЭО. Поэтому для характеристики химической связи часто используют понятие степени ионности, которая показывает (в долях единицы или процентах) степень смещения электронов от одного атома к другому. Косвенно степень ионности можно оценить по 8ЭО. Чем больше 8ЭО, тем выше степень ионности химической связи. В некоторых молекулах одновременно образуются ковалентные и ионные химические связи. Общее число химических связей, образованных данным атомом, называется валентностью. Силы Ван-дер-Ваальса (Вандерваа́льсовы си́лы) — силы межмолекулярного (и межатомного) взаимодействия с энергией 10—20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Й. Д. Ван дер Ваальсом в 1869 году. Вандерваальсовы силы межатомного взаимодействия инертных газов обуславливают возможность существования агрегатных состояний инертных газов (газ, жидкость и твёрдые тела). К вандерваальсовым силам относятся взаимодействия между диполями (постоянными и наведёнными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия, а также водородные связи, определяют формирование пространственной структуры биологических макромолекул. Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1] Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода. В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-). Двухэлектронная трёхцентровая связь — одна из возможных электроно-дефицитных связей. Характерна тем, что пара валентных электронов локализована в пространстве сразу трёх атомов (отсюда и понятие «электроно-дефицитности» — «нормальным» случаем является двухэлектронная двухцентровая связь). Общее описание механизма образования электронодефицитных связей даётся в рамках теории молекулярных орбиталей (модель «несвязывающих» орбиталей). Проблема дефицита электронов отпадает в кольцегранной модели Снельсона-Кушелева. Заключение Химическая связь — это взаимодействие атомов, осуществляемое путём обмена электронами или их перехода от одного атома к другому. Причиной образования химической связи является стремление системы к более устойчивому состоянию с минимально возможным запасом энергии. При образовании химической связи атомы стремятся приобрести устойчивую электронную оболочку. Химическая связь имеет единую природу. Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа — электронно-ядерное взаимодействие. Различают четыре основных вида химической связи: ковалентную, ионную, металлическую и водородную. Химическая связь, возникающая в результате образования общих электронных пар, называется ковалентной. Ионная связь — это связь, которая возникает между атомами, сильно различающимися по значениям электроотрицательности. Металлическая связь — это связь между положительными ионами металлов и общими электронами, которые свободно движутся по всему объёму. Водородная связь — это связь между атомом водорода, ковалентно связанным с другим электроотрицательным атомом. http://ea.donntu.edu.ua/bitstream/123456789/22619/7/%D0%9B%D0%B5%D0%BA%D1%86%D0%B8%D1%8F_7_%D0%A5%D0%B8%D0%BC%D0%A1%D0%B2%D1%8F%D0%B7%D1%8C.pdf Список использованной литературы Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М.: «Химия», 1987. — С. 124. — 320 с. Леменовский Д.А., Левицкий М.М. Российский химический журнал (журнал Российского химического общества им. Д. И. Менделеева). — 2000. — Т. XLIV, вып.6. — С. 63—86. Serway, R.; Moses, C.; Moyer, C. Modern Physics (англ.). — 3rd ed.. — Thomson Brooks Cole, 2005. — 682 p. Бердиева Зулфия Мухиддиновна Виды химических реакций и связей // Academy. 2019. №12 (51). URL: https://cyberleninka.ru/article/n/vidy-himicheskih-reaktsiy-i-svyazey (дата обращения: 10.09.2021). Яблоков В.А., Захарова О.М. Системная организация содержания обучения химии // Universum: Психология и образование: электрон. Научн. Журн. 2016. №5(23) / [Электронный ресурс]. - Режим доступа: URL://7uni-versum.com/ru/psy/archiv/item/2505 (дата обращения 7.09.2021). |
